5 Merkmale Einer Chemischen Reaktion
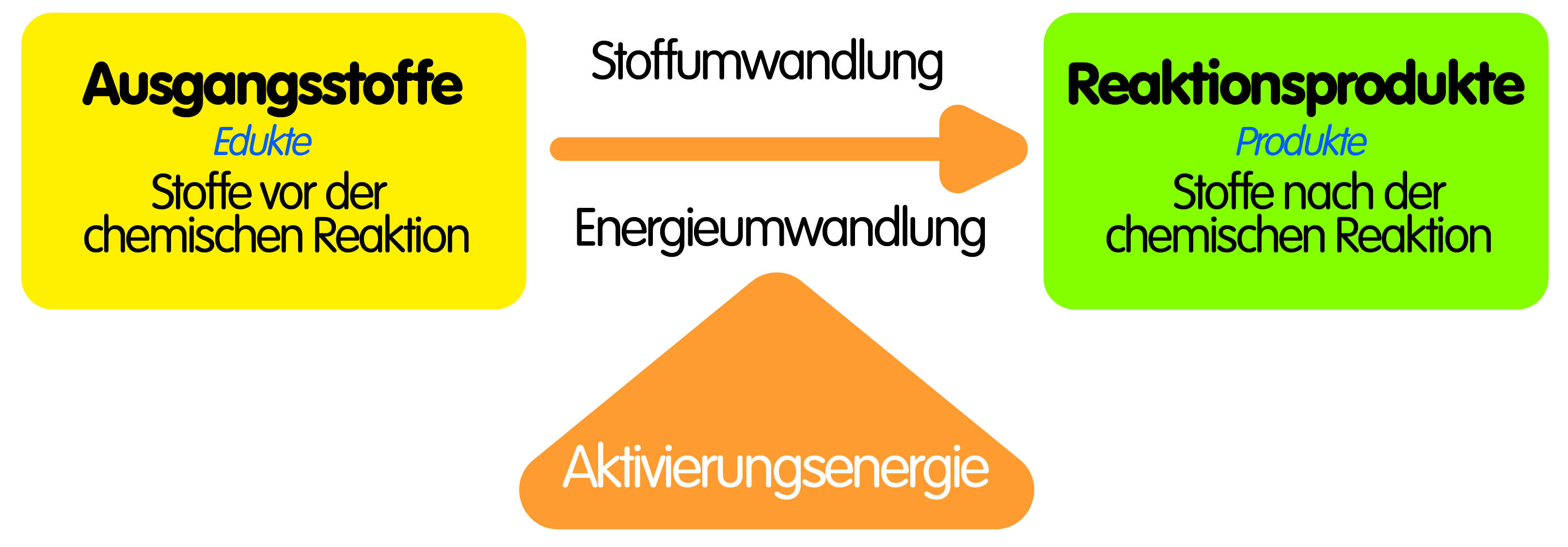
Chemische Reaktionen sind allgegenwärtig, sowohl in der Natur als auch in unserem täglichen Leben. Vom Kochen eines Eies bis zum Rosten von Eisen sind sie die treibende Kraft hinter Veränderungen in der Zusammensetzung von Stoffen. Um eine chemische Reaktion zu erkennen und von einer physikalischen Veränderung zu unterscheiden, gibt es bestimmte Merkmale, die beobachtet werden können. Diese Merkmale sind jedoch nicht immer eindeutig, und es ist wichtig, den Kontext und mehrere Hinweise zu berücksichtigen, um eine fundierte Schlussfolgerung zu ziehen.
Fünf Merkmale einer chemischen Reaktion
Es gibt fünf Hauptmerkmale, die auf eine chemische Reaktion hindeuten können. Diese sind:
1. Farbveränderung
Eine Farbveränderung ist oft ein deutliches Zeichen für eine chemische Reaktion. Viele chemische Verbindungen haben charakteristische Farben, und wenn sich diese Farbe während eines Prozesses ändert, deutet dies darauf hin, dass sich die Zusammensetzung der Stoffe geändert hat. Dies bedeutet, dass neue Stoffe mit unterschiedlichen Farbigkeiten entstanden sind.
Beispiele:
- Das Braunwerden eines angeschnittenen Apfels, wenn er der Luft ausgesetzt wird. Dies ist eine Reaktion, bei der Enzyme im Apfel mit Sauerstoff reagieren, um Melanin zu bilden, ein braunes Pigment.
- Das Mischen von zwei farblosen Lösungen, das zu einer farbigen Lösung führt (z.B. das Mischen von Kaliumiodid und Bleinitrat, das zu gelbem Bleiodid führt).
- Das Ausbleichen von Farbstoffen durch Bleichmittel. Bleichmittel oxidieren die Farbstoffe, wodurch ihre chemische Struktur verändert wird und sie ihre Farbe verlieren.
Es ist jedoch wichtig zu beachten, dass nicht jede Farbveränderung auf eine chemische Reaktion zurückzuführen ist. Beispielsweise kann sich die Farbe eines Stoffes ändern, wenn er erhitzt oder verdünnt wird, ohne dass eine chemische Reaktion stattfindet. Um sicherzustellen, dass die Farbveränderung auf eine chemische Reaktion zurückzuführen ist, müssen andere Merkmale ebenfalls berücksichtigt werden.
2. Gasentwicklung
Die Gasentwicklung, oft in Form von Blasen, ist ein weiteres häufiges Merkmal einer chemischen Reaktion. Wenn ein Gas freigesetzt wird, deutet dies darauf hin, dass neue Stoffe entstanden sind, die gasförmig sind. Diese Gase können sichtbar sein, wie Blasen in einer Flüssigkeit, oder sie können unsichtbar sein, aber dennoch durch ihren Geruch oder ihre Fähigkeit, eine Flamme zu entzünden, nachgewiesen werden.
Beispiele:
- Das Brausen einer Brausetablette in Wasser. Die Brausetablette enthält eine Säure (z.B. Zitronensäure) und ein Carbonat (z.B. Natriumhydrogencarbonat). Wenn die Tablette in Wasser gegeben wird, reagieren die Säure und das Carbonat miteinander und setzen Kohlendioxidgas frei, das als Blasen sichtbar wird.
- Die Reaktion von Säure mit einem Metall, wie z.B. Zink mit Salzsäure, bei der Wasserstoffgas freigesetzt wird.
- Die Gärung von Zucker durch Hefe, bei der Kohlendioxidgas entsteht.
Auch hier gilt, dass nicht jede Gasentwicklung auf eine chemische Reaktion zurückzuführen ist. Das Kochen von Wasser erzeugt Dampf, aber dies ist eine physikalische Veränderung (Phasenübergang), keine chemische Reaktion. Die Gasentwicklung muss also mit anderen Merkmalen kombiniert werden, um eine sichere Aussage treffen zu können.
3. Niederschlagsbildung
Ein Niederschlag ist ein unlöslicher Feststoff, der sich während einer chemischen Reaktion in einer Flüssigkeit bildet. Er entsteht, wenn sich zwei oder mehr gelöste Stoffe miteinander verbinden und eine neue Verbindung bilden, die in dem Lösungsmittel unlöslich ist. Der Niederschlag kann als feine Trübung, flockige Substanz oder als feste Ablagerung am Boden des Gefäßes sichtbar sein.
Beispiele:
- Das Mischen von Silbernitratlösung mit Natriumchloridlösung, das zu einem weißen Niederschlag von Silberchlorid führt.
- Die Bildung von Kalkablagerungen in Wasserkochern und Rohren. Dies ist eine Reaktion, bei der gelöste Calcium- und Magnesiumionen mit Carbonationen reagieren und unlösliche Carbonate bilden.
- Das Ausfällen von Proteinen in Milch, wenn sie erhitzt oder mit Säure versetzt wird.
Die Niederschlagsbildung ist ein relativ eindeutiges Zeichen für eine chemische Reaktion, da sie die Bildung einer neuen Substanz anzeigt. Allerdings ist es wichtig, die Löslichkeit von Stoffen zu berücksichtigen und sicherzustellen, dass der gebildete Feststoff tatsächlich ein neues Produkt der Reaktion ist und nicht einfach nur ein zuvor gelöster Stoff, der aufgrund von veränderten Bedingungen ausfällt.
4. Temperaturänderung
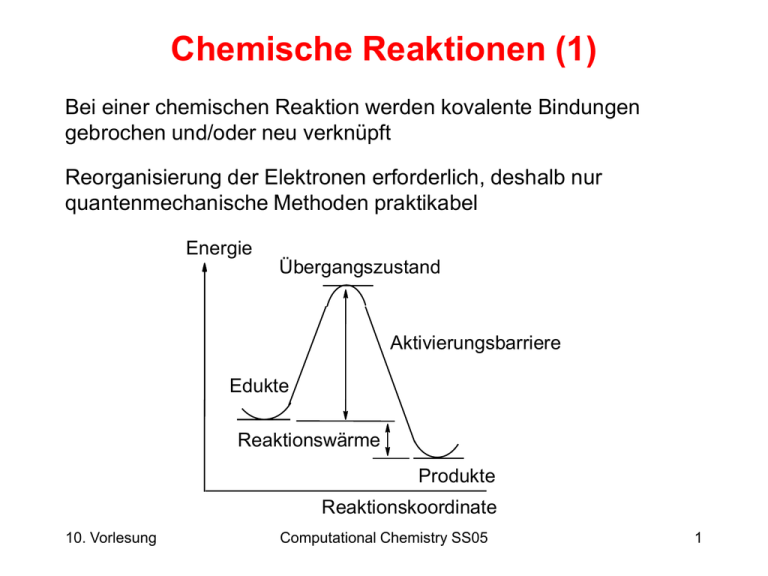
Eine Temperaturänderung ist ein weiteres Indiz für eine chemische Reaktion. Chemische Reaktionen setzen entweder Energie frei (exotherme Reaktionen) oder verbrauchen Energie (endotherme Reaktionen). Exotherme Reaktionen führen zu einer Erwärmung der Umgebung, während endotherme Reaktionen zu einer Abkühlung führen.
Beispiele:
- Die Verbrennung von Holz oder Gas, bei der Wärme freigesetzt wird (exotherm).
- Das Mischen von Säure und Base, bei dem Wärme freigesetzt wird (Neutralisationsreaktion, exotherm).
- Das Auflösen von Ammoniumnitrat in Wasser, das zu einer Abkühlung der Lösung führt (endotherm).
- Die Reaktion in einem Kühlpack, die durch das Mischen von Chemikalien ausgelöst wird und eine Abkühlung bewirkt (endotherm).
Es ist wichtig zu beachten, dass Temperaturänderungen auch durch physikalische Prozesse verursacht werden können. Beispielsweise kann sich Wasser erwärmen, wenn es in die Sonne gestellt wird. Um sicherzustellen, dass die Temperaturänderung auf eine chemische Reaktion zurückzuführen ist, muss die Temperaturänderung signifikant und mit anderen Merkmalen der Reaktion verbunden sein. Oftmals wird die Temperaturänderung nur mit einem Thermometer messbar.
5. Lichtemission
Die Lichtemission, auch als Chemilumineszenz bekannt, ist ein starkes Indiz für eine chemische Reaktion. Bei manchen Reaktionen wird Energie in Form von Licht freigesetzt. Dies kann als sichtbares Leuchten oder als Emission von ultraviolettem oder infrarotem Licht wahrgenommen werden.
Beispiele:
- Das Leuchten eines Knicklichts. Ein Knicklicht enthält zwei Chemikalien, die in getrennten Kammern aufbewahrt werden. Wenn das Knicklicht geknickt wird, vermischen sich die Chemikalien und reagieren miteinander, wodurch Licht freigesetzt wird.
- Das Leuchten von Glühwürmchen. Glühwürmchen produzieren Licht durch eine chemische Reaktion, bei der Luciferin und Luciferase beteiligt sind.
- Die Verbrennung von Magnesium, die mit einem hellen weißen Licht einhergeht.
Die Lichtemission ist ein eindeutiger Beweis für eine chemische Reaktion, da sie die Freisetzung von Energie in Form von Licht direkt anzeigt. Sie tritt jedoch nicht bei allen chemischen Reaktionen auf und ist oft schwer zu beobachten, es sei denn, die Reaktion ist stark genug, um sichtbares Licht zu erzeugen.
Zusammenfassung
Das Erkennen einer chemischen Reaktion erfordert die Beobachtung und Interpretation verschiedener Merkmale. Farbveränderungen, Gasentwicklung, Niederschlagsbildung, Temperaturänderungen und Lichtemission sind wichtige Hinweise, die auf eine Veränderung in der Zusammensetzung von Stoffen hindeuten können. Es ist jedoch wichtig, diese Merkmale im Kontext zu betrachten und zu berücksichtigen, dass nicht jedes einzelne Merkmal allein einen eindeutigen Beweis für eine chemische Reaktion darstellt. Die Kombination von mehreren Beobachtungen und ein Verständnis der beteiligten Stoffe und Prozesse sind entscheidend, um eine fundierte Schlussfolgerung zu ziehen.
Wenn Sie also das nächste Mal eine Veränderung in Ihrer Umgebung beobachten, nehmen Sie sich einen Moment Zeit, um die möglichen Ursachen zu überlegen. Beobachten Sie die oben genannten Merkmale genau. Vielleicht erleben Sie gerade eine chemische Reaktion!

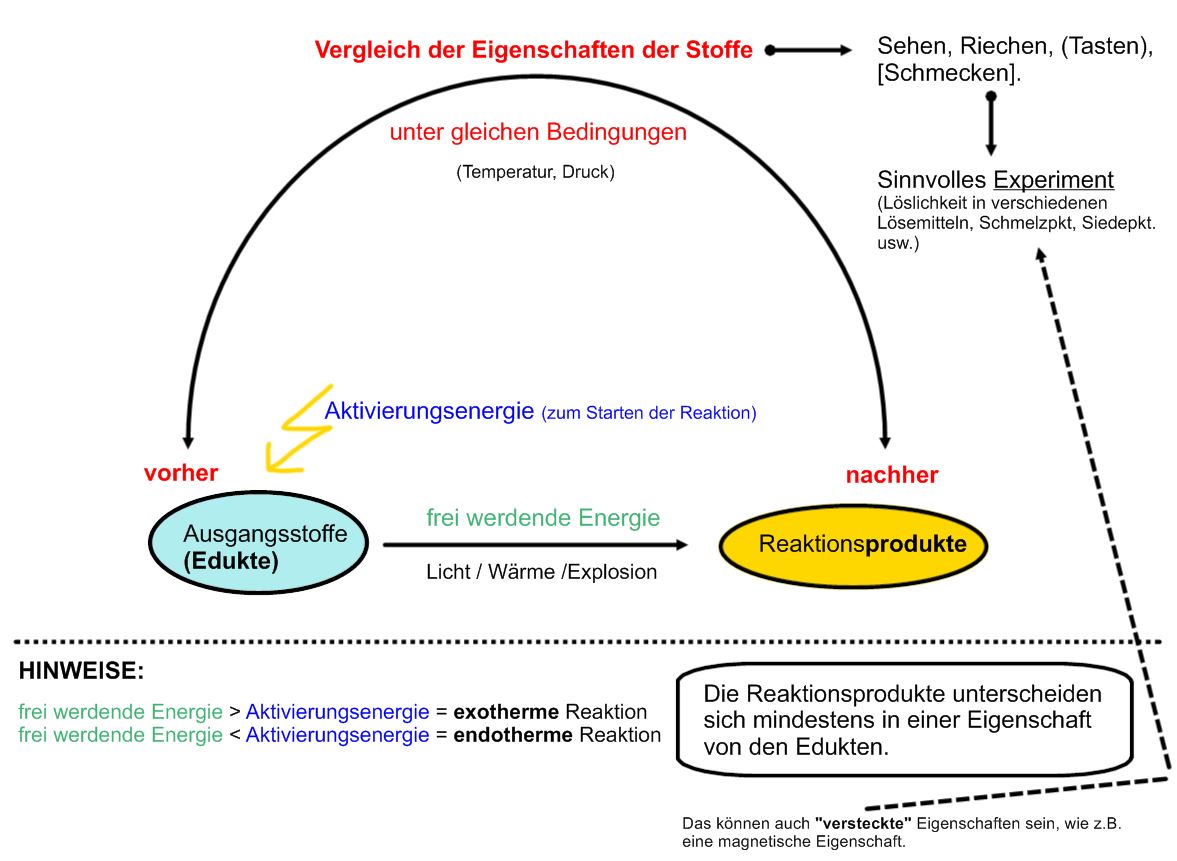



![5 Merkmale Einer Chemischen Reaktion Chemische Reaktion • Merkmale, Redoxreaktionen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/11/Chemische-Reaktion_Chemische-Reaktion-und-Energie_WP_2-1-1024x576.jpg)


![5 Merkmale Einer Chemischen Reaktion Chemische Reaktion • Merkmale, Redoxreaktionen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/11/Chemische-Reaktion_Physikalischer_Vorgang_WP_1-1-1024x576.jpg)