Aufbau Und Funktion Einer Batterie
Batterien sind allgegenwärtig in unserem modernen Leben. Von Smartphones und Laptops bis hin zu Autos und Notstromversorgungen – sie liefern die Energie, die viele unserer Geräte benötigen. Um Batterien effektiv zu nutzen und ihre Lebensdauer zu verlängern, ist es wichtig, ihren Aufbau und ihre Funktionsweise zu verstehen. Dieser Artikel bietet einen umfassenden Überblick über die Grundlagen der Batterie, insbesondere für Neuankömmlinge und Expats, die sich in Deutschland zurechtfinden müssen.
Grundlagen der Batterie: Was ist eine Batterie?
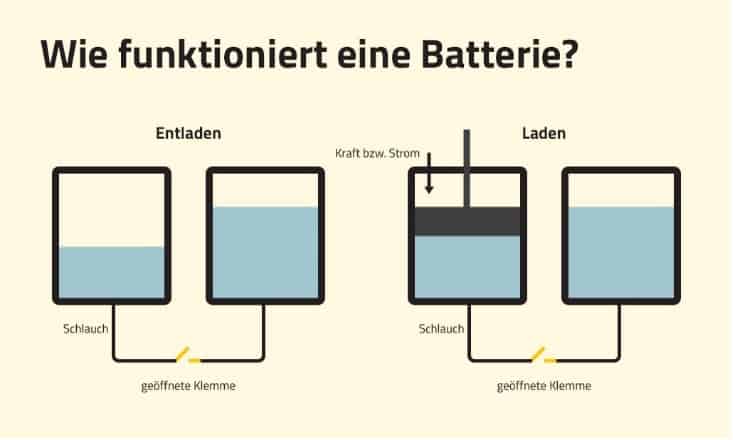
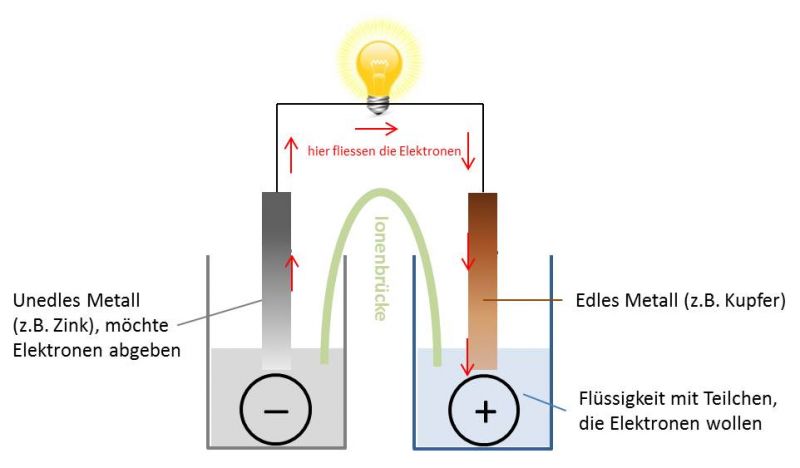
Im Kern ist eine Batterie ein elektrochemisches Gerät, das chemische Energie in elektrische Energie umwandelt. Diese Umwandlung erfolgt durch chemische Reaktionen innerhalb der Batterie, die einen Fluss von Elektronen erzeugen. Vereinfacht gesagt, eine Batterie speichert elektrische Energie in chemischer Form und gibt sie bei Bedarf wieder ab.
Es ist wichtig, den Unterschied zwischen einer Batterie und einem Akkumulator (wiederaufladbare Batterie) zu verstehen. Während beide elektrische Energie speichern und abgeben, kann eine Batterie nur einmal entladen werden (primäre Batterie), während ein Akkumulator mehrmals geladen und entladen werden kann (sekundäre Batterie).
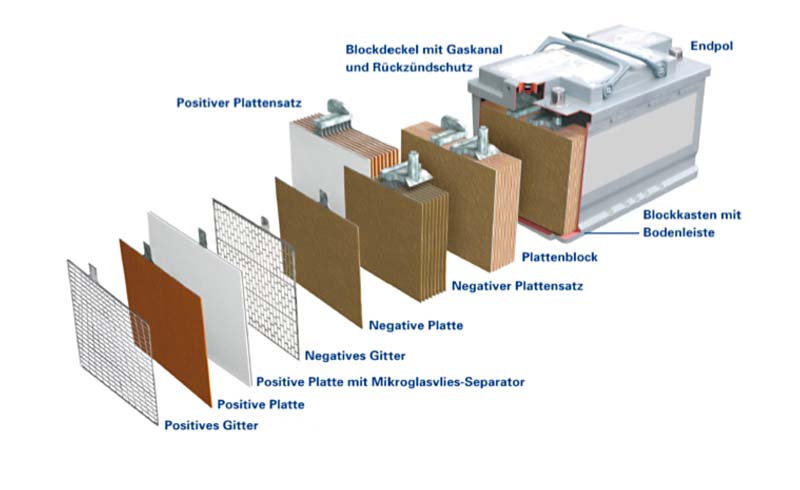
Der Aufbau einer Batterie: Die Hauptkomponenten
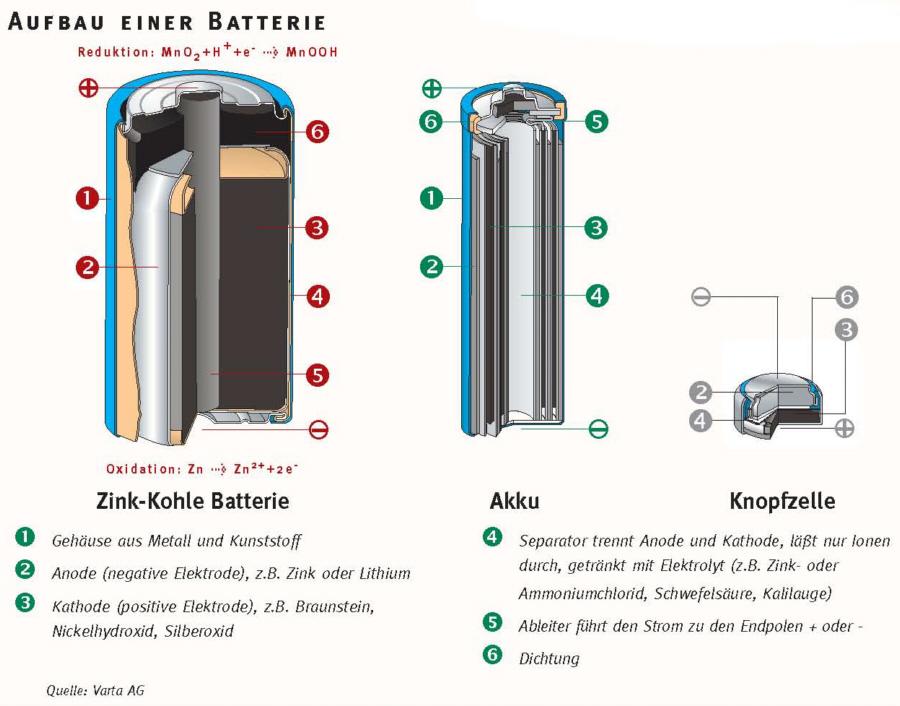
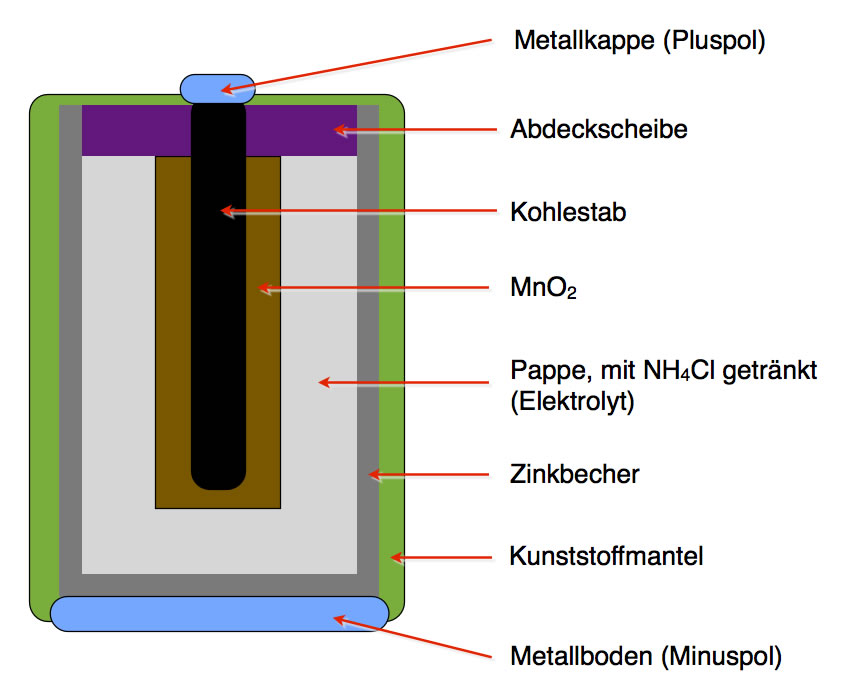
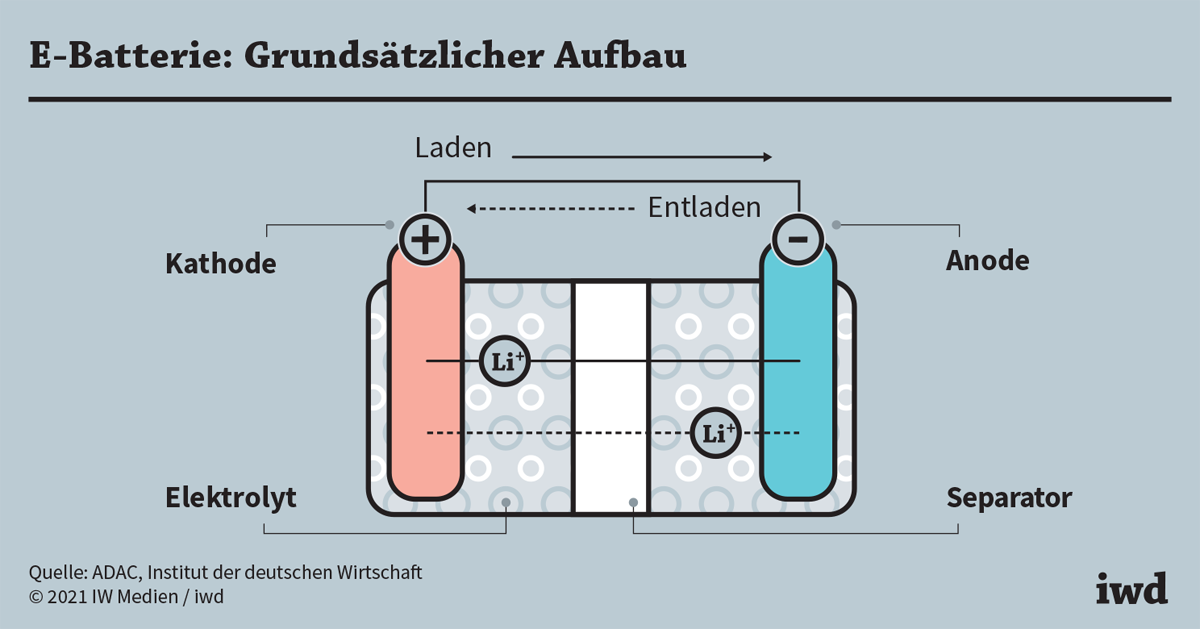
Unabhängig vom Typ (z.B. Alkali, Lithium-Ionen, Blei-Säure) bestehen Batterien aus mehreren grundlegenden Komponenten:
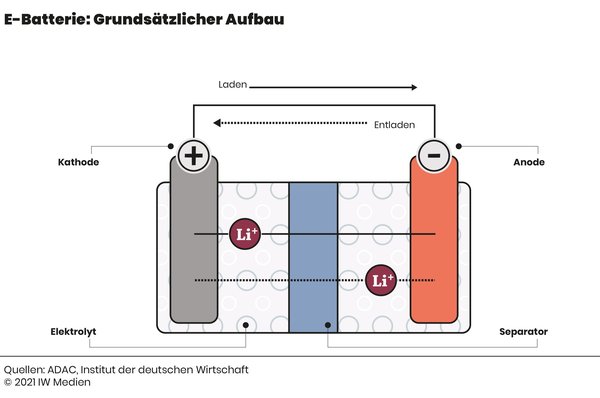
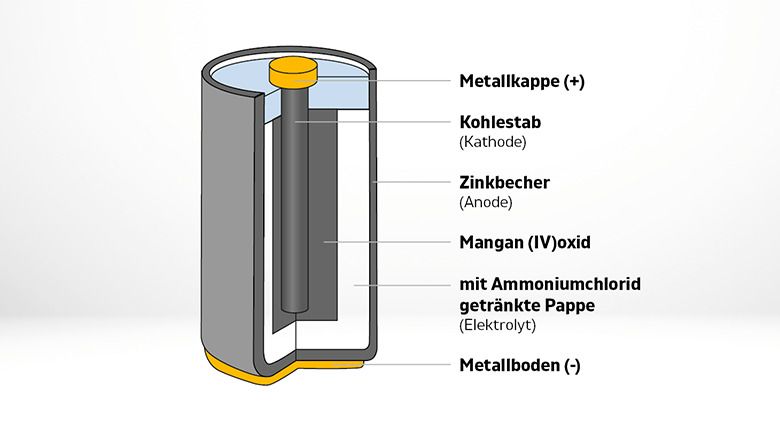
1. Kathode (Pluspol):
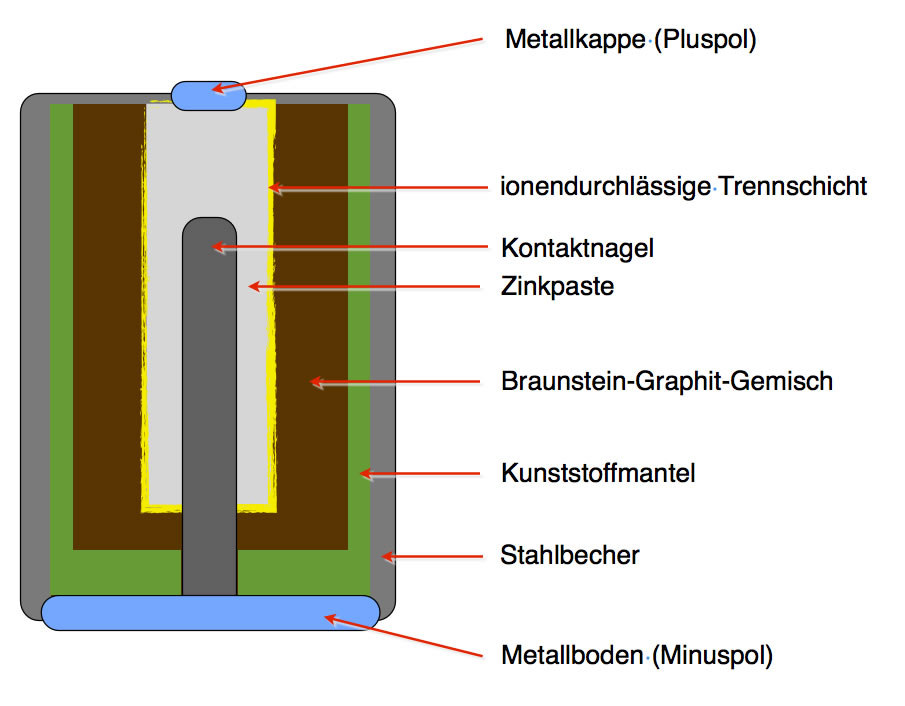
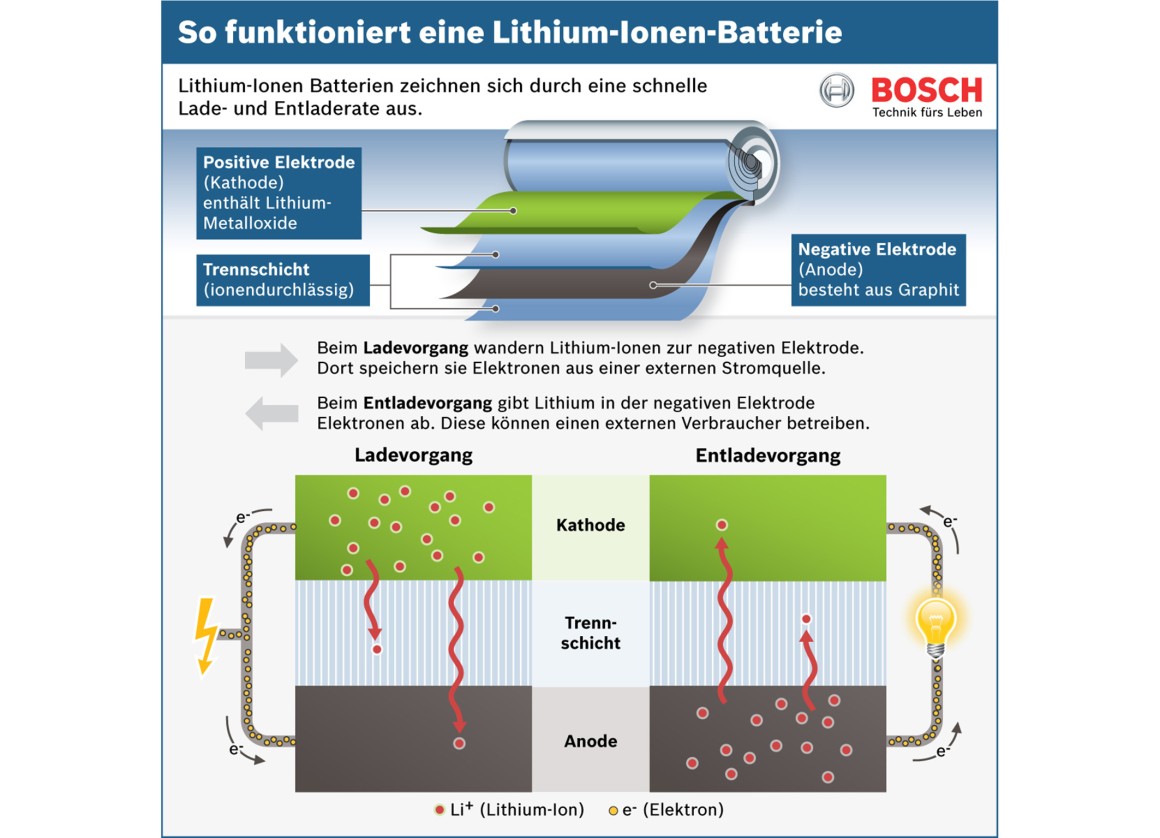
Die Kathode ist die Elektrode, an der die Reduktion stattfindet (Elektronen werden aufgenommen). Sie besteht typischerweise aus einem Material, das Elektronen leicht aufnehmen kann. In einer Alkali-Batterie ist das beispielsweise Mangandioxid (MnO2). In Lithium-Ionen-Batterien werden oft Lithiummetalloxide wie Lithium-Cobalt-Oxid (LiCoO2) verwendet. Die Kathode ist mit dem Pluspol (+) der Batterie verbunden.
2. Anode (Minuspol):
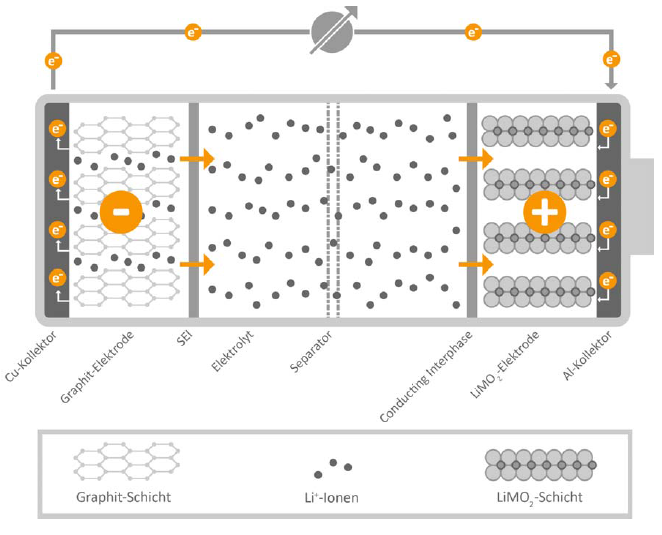
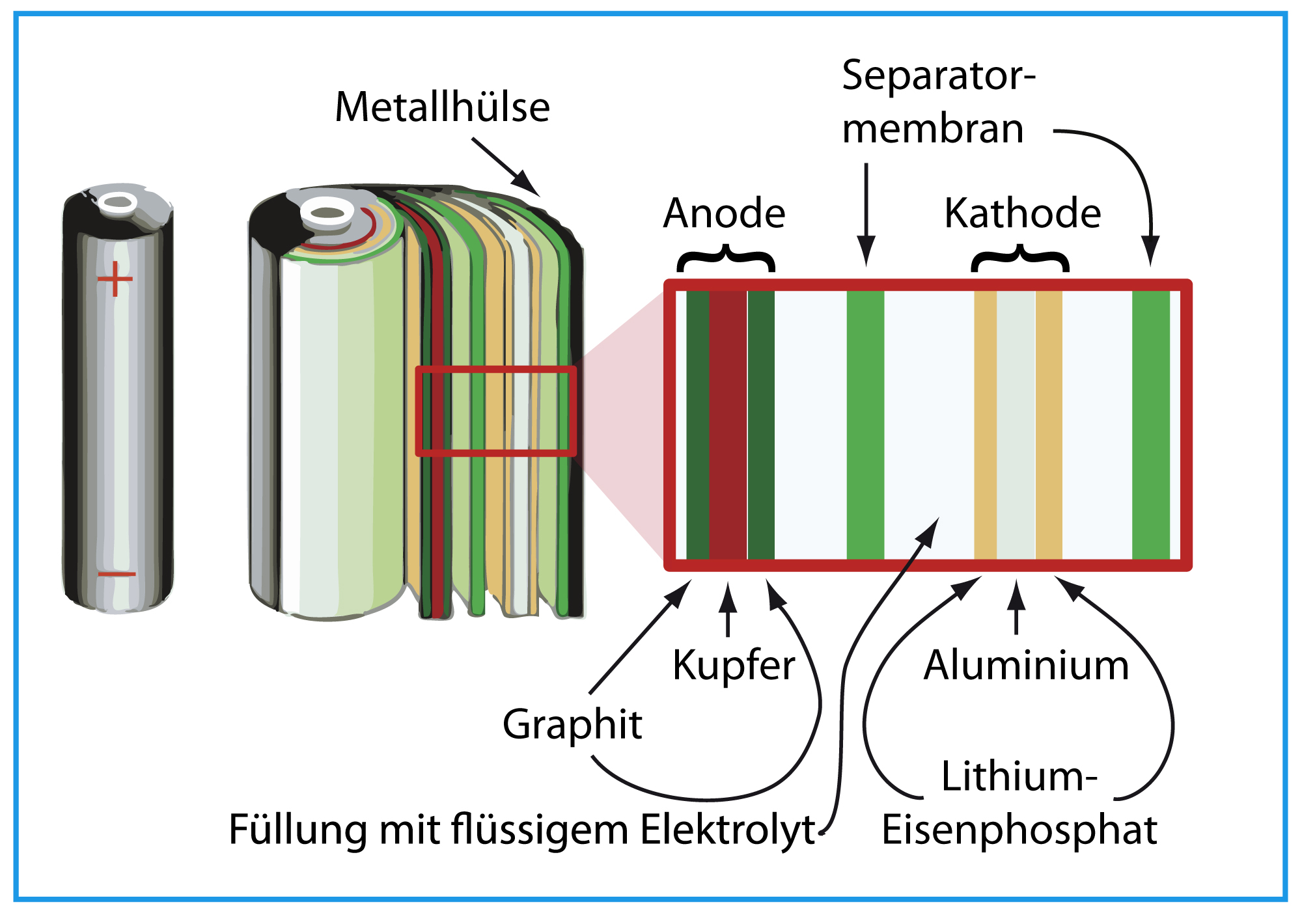
Die Anode ist die Elektrode, an der die Oxidation stattfindet (Elektronen werden abgegeben). Sie besteht aus einem Material, das leicht Elektronen abgeben kann. In einer Alkali-Batterie ist das Zink (Zn). In Lithium-Ionen-Batterien wird oft Graphit verwendet, in das Lithium-Ionen eingelagert werden können. Die Anode ist mit dem Minuspol (-) der Batterie verbunden.
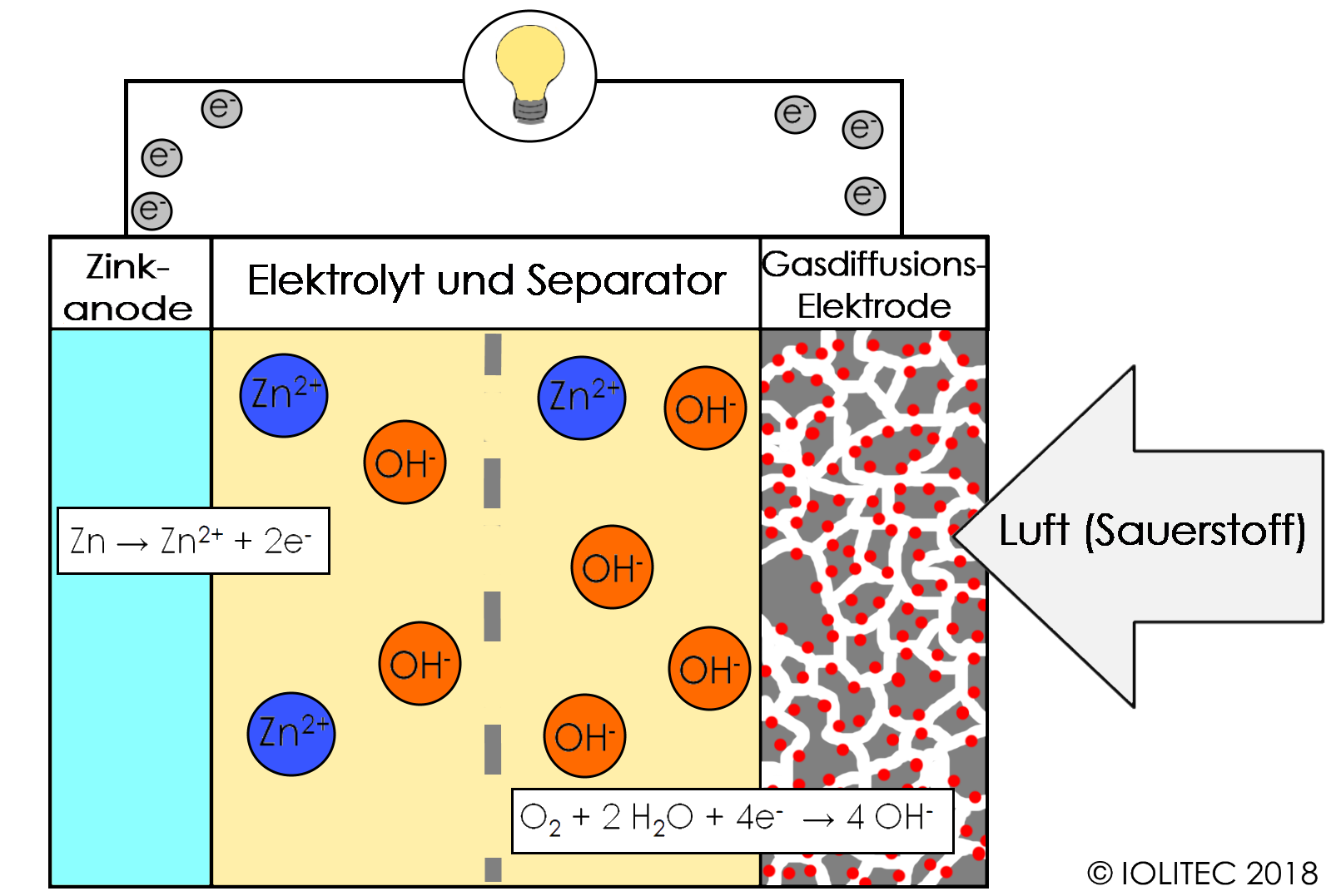
3. Elektrolyt:
Der Elektrolyt ist eine chemische Substanz, die als Medium für den Ionentransport zwischen Kathode und Anode dient. Er ermöglicht den Fluss von Ionen, der den Stromkreis schließt. Der Elektrolyt muss elektrisch leitfähig sein, darf aber keine elektronische Leitfähigkeit aufweisen, um einen internen Kurzschluss zu verhindern. In Alkali-Batterien wird eine Kaliumhydroxid-Lösung (KOH) als Elektrolyt verwendet. In Lithium-Ionen-Batterien werden organische Lösungen mit Lithiumsalzen verwendet.
4. Separator:
Der Separator ist eine Membran, die Kathode und Anode voneinander trennt, um einen direkten Kurzschluss zu verhindern. Gleichzeitig muss er für Ionen durchlässig sein, um den Stromfluss zu ermöglichen. Der Separator besteht oft aus einem porösen Polymer wie Polyethylen (PE) oder Polypropylen (PP).
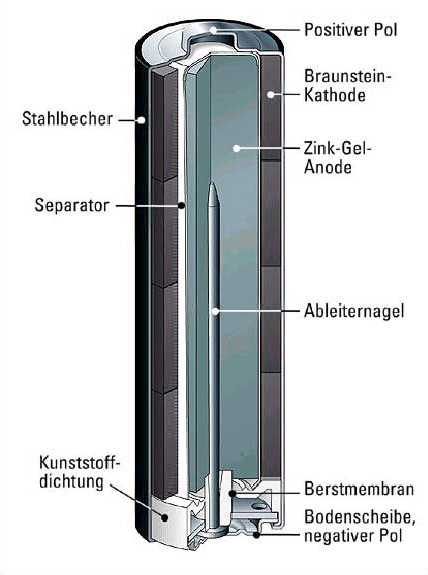
5. Gehäuse:
Das Gehäuse dient dazu, die internen Komponenten der Batterie zusammenzuhalten und vor äußeren Einflüssen wie Feuchtigkeit und Beschädigung zu schützen. Es besteht in der Regel aus Metall oder Kunststoff.
6. Stromableiter (Kollektoren):
Diese metallischen Komponenten dienen dazu, den Strom von den Elektroden abzuleiten und an die externen Anschlüsse der Batterie weiterzuleiten. Sie sind typischerweise aus Kupfer oder Aluminium gefertigt.
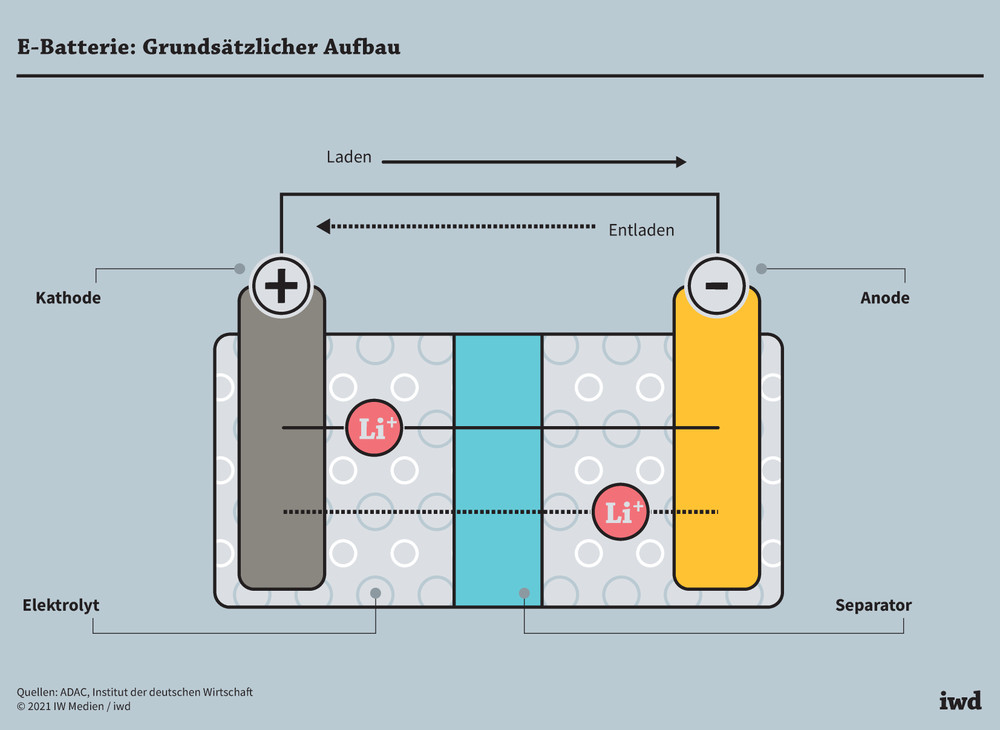
Die Funktionsweise einer Batterie: Der elektrochemische Prozess
Die Funktionsweise einer Batterie beruht auf einer elektrochemischen Reaktion, die in zwei Halbreaktionen unterteilt ist:
1. Oxidation an der Anode:
An der Anode gibt das Anodenmaterial Elektronen ab (Oxidation). Diese Elektronen fließen durch den externen Stromkreis zu dem Gerät, das mit Strom versorgt werden soll. Gleichzeitig entstehen Ionen, die durch den Elektrolyten zur Kathode wandern.
Beispiel (Alkali-Batterie): Zn (s) → Zn2+ (aq) + 2e-
Hier wird festes Zink (Zn) zu Zink-Ionen (Zn2+) und gibt dabei zwei Elektronen (2e-) ab.
2. Reduktion an der Kathode:
An der Kathode nehmen die Kathodenmaterialien die Elektronen auf, die aus dem externen Stromkreis kommen (Reduktion). Zusammen mit den Ionen, die aus dem Elektrolyten wandern, bilden sie neue chemische Verbindungen.
Beispiel (Alkali-Batterie): 2MnO2 (s) + H2O (l) + 2e- → Mn2O3 (s) + 2OH- (aq)
Hier reagiert Mangandioxid (MnO2) mit Wasser (H2O) und nimmt zwei Elektronen (2e-) auf, um Mangan(III)-oxid (Mn2O3) und Hydroxid-Ionen (OH-) zu bilden.
Der Fluss von Elektronen durch den externen Stromkreis erzeugt den elektrischen Strom, der das angeschlossene Gerät mit Energie versorgt. Solange die elektrochemische Reaktion ablaufen kann, liefert die Batterie Strom.
Verschiedene Batterietypen: Ein Überblick
Es gibt viele verschiedene Batterietypen, die sich in ihrer chemischen Zusammensetzung, Leistung und Anwendungsbereichen unterscheiden. Hier sind einige der gängigsten Typen:
1. Alkali-Batterien:
Alkali-Batterien sind weit verbreitet und relativ kostengünstig. Sie verwenden Zink und Mangandioxid als Elektroden und eine Kaliumhydroxid-Lösung als Elektrolyt. Sie sind ideal für Geräte mit geringem bis mittlerem Strombedarf wie Fernbedienungen, Taschenlampen und Spielzeug.
2. Lithium-Ionen-Batterien:
Lithium-Ionen-Batterien sind wiederaufladbar und bieten eine hohe Energiedichte. Sie werden in Smartphones, Laptops, Elektroautos und vielen anderen Anwendungen eingesetzt. Sie verwenden Lithiummetalloxide als Kathode und Graphit als Anode. Der Elektrolyt besteht aus organischen Lösungen mit Lithiumsalzen.
3. Blei-Säure-Batterien:
Blei-Säure-Batterien sind wiederaufladbar und werden häufig in Autos, Motorrädern und Notstromversorgungen eingesetzt. Sie verwenden Blei(II)-oxid als Kathode und Blei als Anode. Der Elektrolyt ist Schwefelsäure.
4. Nickel-Metallhydrid (NiMH)-Batterien:
NiMH-Batterien sind wiederaufladbar und bieten eine höhere Energiedichte als Nickel-Cadmium (NiCd)-Batterien. Sie werden in Digitalkameras, tragbaren Audiogeräten und einigen Hybridautos eingesetzt. Sie verwenden Nickelhydroxid als Kathode und eine Metallhydridlegierung als Anode.
5. Lithium-Polymer-Batterien:
Lithium-Polymer-Batterien sind eine Variante der Lithium-Ionen-Technologie, bei der ein polymerer Elektrolyt verwendet wird. Sie sind flexibler und leichter als herkömmliche Lithium-Ionen-Batterien und können in verschiedenen Formen hergestellt werden. Sie werden häufig in Smartphones, Tablets und tragbaren Geräten eingesetzt.
Wichtige Aspekte beim Umgang mit Batterien: Sicherheit und Entsorgung
Der sichere Umgang mit Batterien ist von entscheidender Bedeutung, um Unfälle zu vermeiden und die Umwelt zu schützen. Hier sind einige wichtige Punkte:
- Korrekte Polarität beachten: Achten Sie beim Einlegen von Batterien in Geräte auf die richtige Polarität (+ und -).
- Batterien nicht kurzschließen: Vermeiden Sie es, Batterien kurzzuschließen, da dies zu Überhitzung und Brandgefahr führen kann.
- Beschädigte Batterien entsorgen: Beschädigte oder ausgelaufene Batterien sollten umgehend fachgerecht entsorgt werden.
- Batterien nicht öffnen oder zerlegen: Das Öffnen oder Zerlegen von Batterien kann gefährliche Chemikalien freisetzen.
- Batterien trocken lagern: Lagern Sie Batterien an einem trockenen Ort, um Korrosion zu vermeiden.
- Entsorgung: Verbrauchte Batterien dürfen nicht in den Hausmüll geworfen werden. Sie müssen fachgerecht entsorgt werden, da sie schädliche Schwermetalle enthalten können. In Deutschland gibt es spezielle Sammelstellen für Batterien, z.B. in Supermärkten und Drogerien.
Batterien in Deutschland: Praktische Informationen
In Deutschland gibt es ein gut ausgebautes System zur Sammlung und Entsorgung von Batterien. Sie können verbrauchte Batterien kostenlos bei Sammelstellen in Supermärkten, Drogerien, Baumärkten und Recyclinghöfen abgeben. Achten Sie auf die Kennzeichnung "Batterie" und das Symbol der durchgestrichenen Mülltonne.
Viele Geräte werden heutzutage mit wiederaufladbaren Batterien (Akkus) betrieben. Es ist ratsam, auf wiederaufladbare Batterien umzusteigen, um die Umweltbelastung zu reduzieren und langfristig Kosten zu sparen.
Zusammenfassend lässt sich sagen, dass ein Verständnis des Aufbaus und der Funktion von Batterien Ihnen hilft, diese effektiv und sicher zu nutzen. Achten Sie auf die korrekte Verwendung, Lagerung und Entsorgung, um die Lebensdauer Ihrer Batterien zu verlängern und die Umwelt zu schonen.


![Aufbau Und Funktion Einer Batterie Alkali Mangan Batterie • Aufbau und Reaktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/05/WP_Alkali-Mangan-Batterie-1-1024x576.jpg)