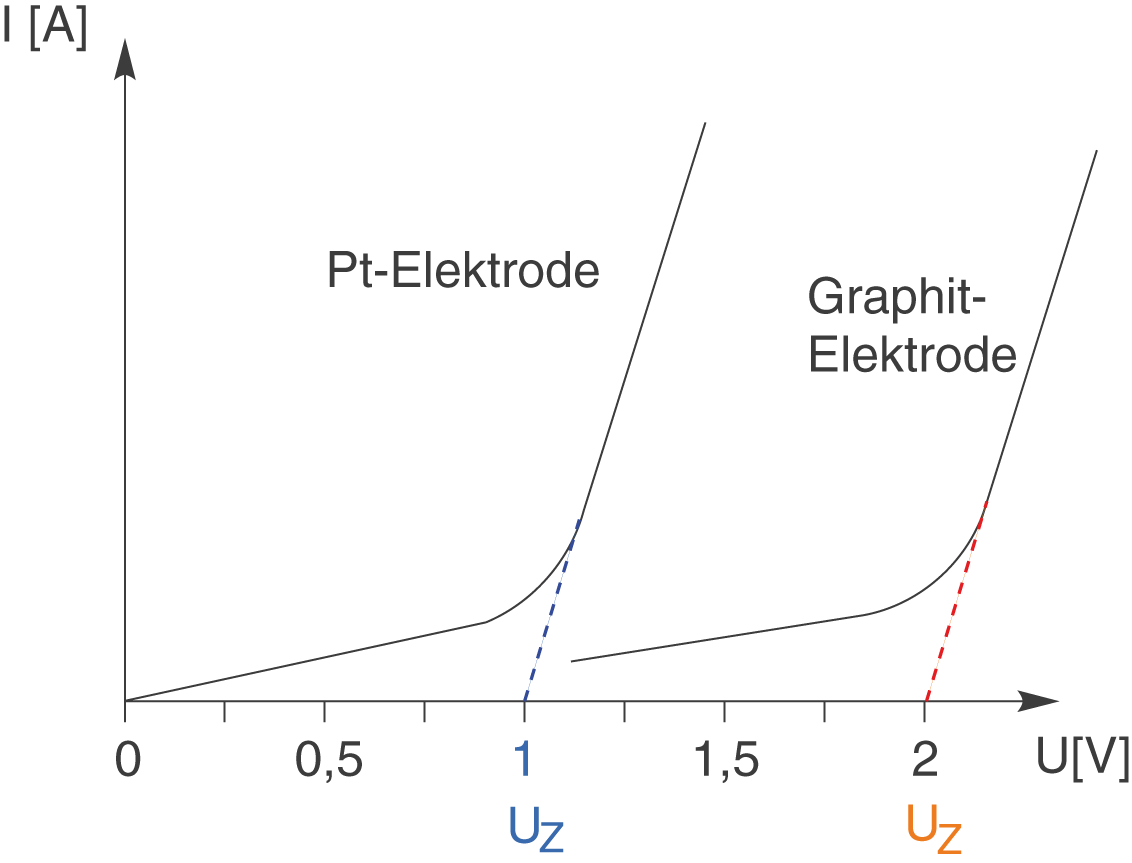
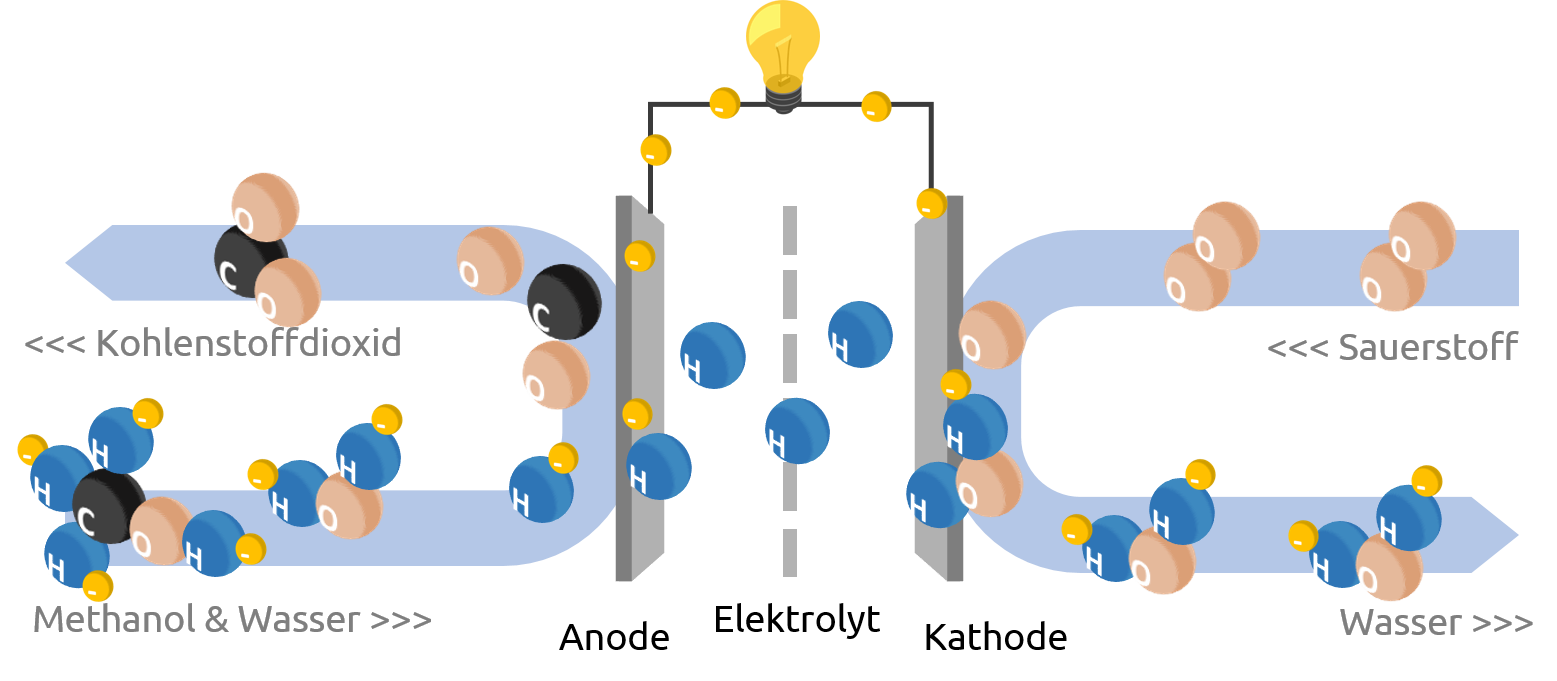
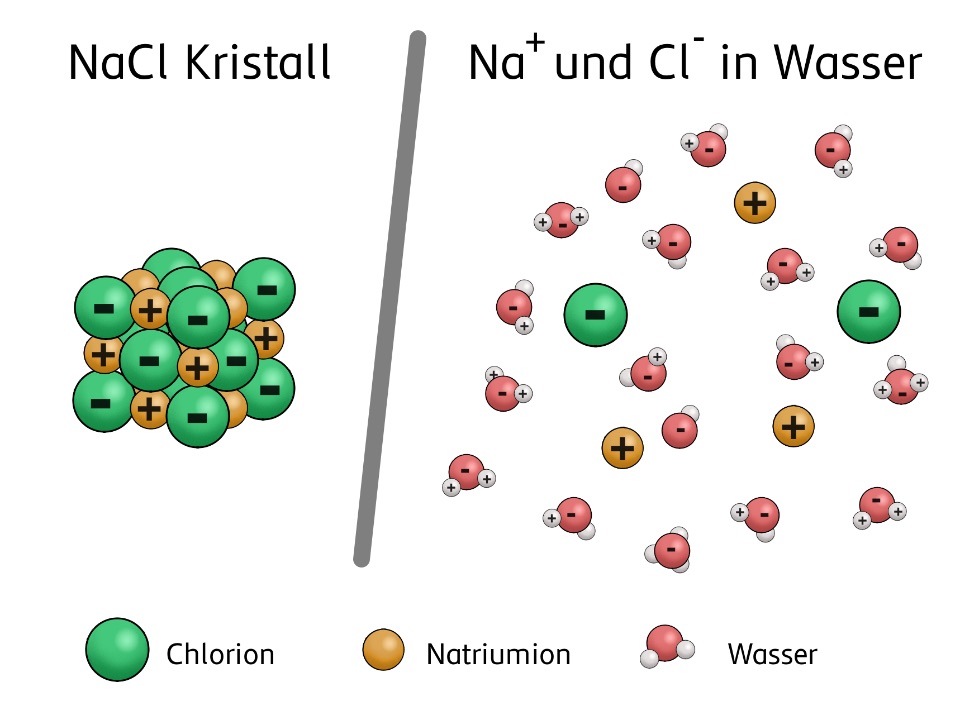
Aufspaltung Durch Strom In Der Chemie
Hallo liebe Reisefreunde! Eure neugierige Weltenbummlerin meldet sich wieder, diesmal mit einer etwas ungewöhnlicheren Geschichte im Gepäck. Normalerweise berichte ich ja von pittoresken Gassen, atemberaubenden Bergpanoramen oder den köstlichsten lokalen Spezialitäten. Aber auf meiner letzten Reise – es verschlug mich in die faszinierende Welt der Chemie (ja, ihr habt richtig gelesen!) – habe ich etwas entdeckt, das mich so begeistert hat, dass ich es unbedingt mit euch teilen muss. Es geht um die sogenannte "Aufspaltung durch Strom", oder, wie die Chemiker sagen, die Elektrolyse.
Meine unerwartete Begegnung mit der Elektrolyse
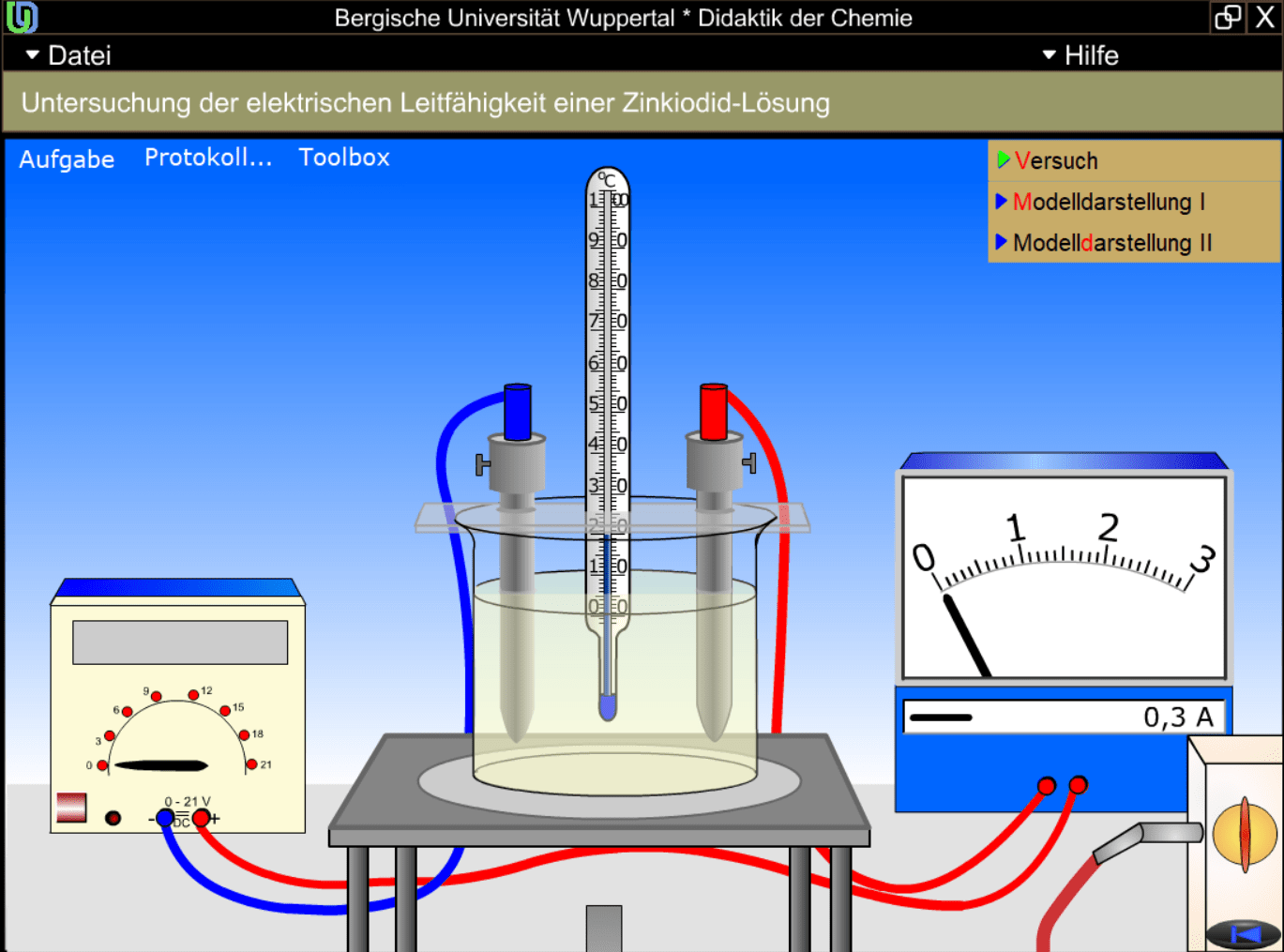
Wie bin ich überhaupt darauf gekommen? Nun, ich war in einem kleinen, unscheinbaren Museum in einem Universitätsstädtchen. Eigentlich wollte ich mir nur die lokale Kunst ansehen, aber dann entdeckte ich eine Ausstellung über die Geschichte der Chemie. Und da, inmitten von alten Apparaturen und staubigen Büchern, stieß ich auf ein faszinierendes Experiment: die Elektrolyse von Wasser. Der freundliche Museumsführer, ein älterer Herr mit leuchtenden Augen hinter einer dicken Brille, erklärte mir geduldig, wie man mit Hilfe von elektrischem Strom Wasser in seine Bestandteile, Wasserstoff und Sauerstoff, zerlegen kann. Ich war sofort gefesselt! Es fühlte sich an, als würde ich eine verborgene Zauberkraft entdecken, die in der Lage ist, die Grundbausteine der Natur zu manipulieren.
Was genau ist Elektrolyse?
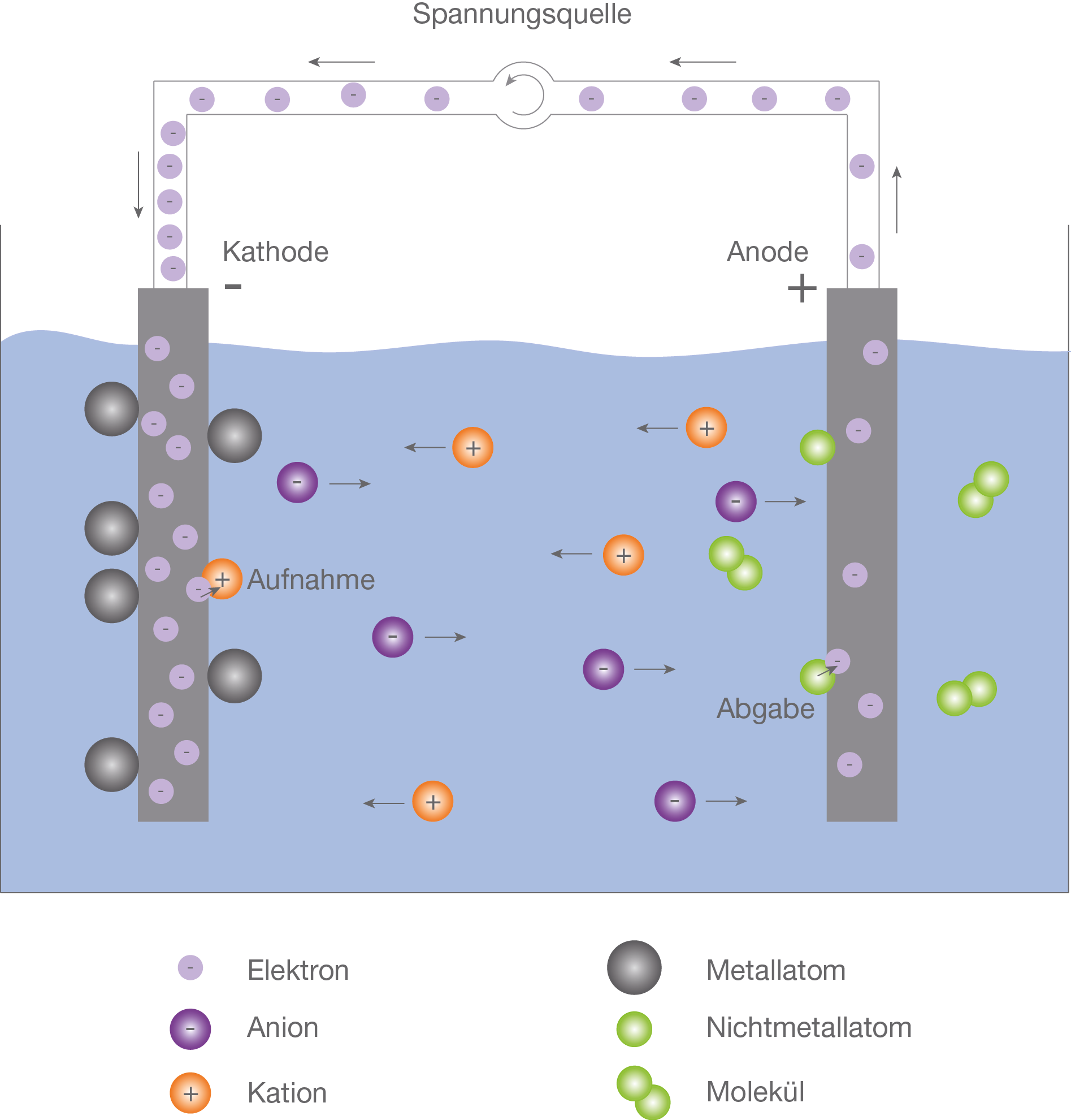
Stellt euch vor, ihr habt ein Glas Wasser. Einfach so, ganz normales H2O. Und jetzt kommt die Elektrolyse ins Spiel. Man taucht zwei Elektroden (das sind im Grunde genommen leitfähige Drähte) in das Wasser und schließt sie an eine Stromquelle an. Und was passiert dann? An der einen Elektrode, der Anode (die positive), bildet sich Sauerstoff. An der anderen Elektrode, der Kathode (die negative), bildet sich Wasserstoff. Man kann das sogar sehen! Kleine Bläschen steigen auf und sammeln sich über den Elektroden. Es ist wie ein kleines, kontrolliertes Feuerwerk, nur ohne Feuer und mit chemischen Elementen als Protagonisten.
Der Clou an der Sache ist, dass man dabei die chemischen Bindungen des Wassers aufbricht. Die elektrische Energie wird genutzt, um die Wassermoleküle in ihre einzelnen Atome zu zerlegen. Das ist wirklich beeindruckend! Und das Beste daran: die Produkte, Wasserstoff und Sauerstoff, sind extrem nützlich. Wasserstoff kann als sauberer Brennstoff verwendet werden, und Sauerstoff ist natürlich lebensnotwendig für uns alle.
Ein kleiner Exkurs in die Chemie (keine Angst, es wird nicht langweilig!)
Vielleicht fragt ihr euch jetzt, warum ich euch das alles erzähle. Schließlich bin ich doch Reisebloggerin und keine Chemikerin! Aber ich finde, dass die Elektrolyse ein wunderbares Beispiel dafür ist, wie faszinierend und allgegenwärtig die Chemie in unserem Leben ist. Und es ist auch ein Beweis dafür, dass Wissenschaft nicht langweilig und kompliziert sein muss, sondern spannend und aufregend sein kann.
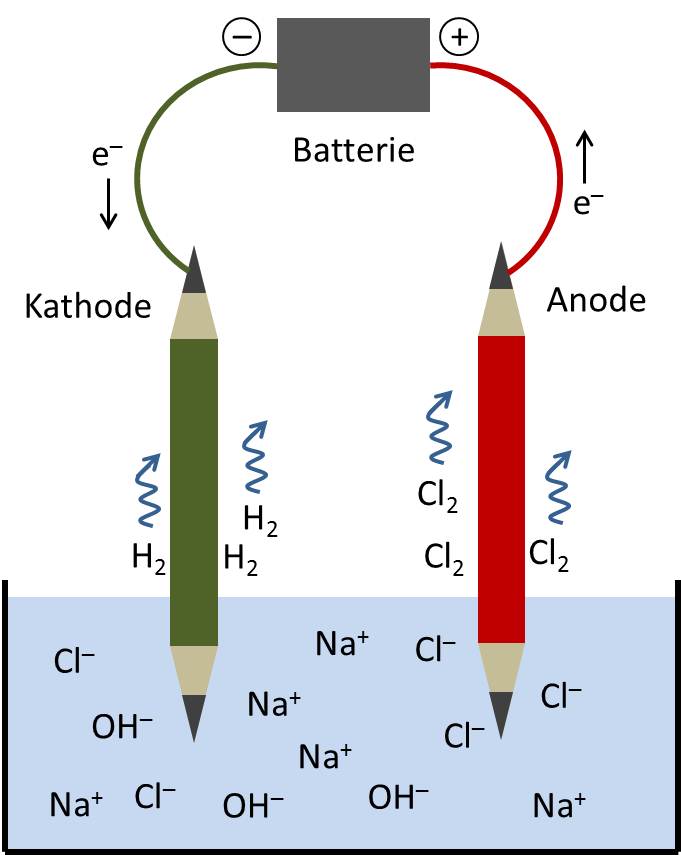
Die Elektrolyse ist nicht nur auf Wasser beschränkt. Man kann auch andere Stoffe mit Hilfe von Strom aufspalten. Denkt zum Beispiel an Kochsalz (Natriumchlorid). Wenn man geschmolzenes Kochsalz elektrolysiert, erhält man Natrium (ein sehr reaktionsfreudiges Metall) und Chlor (ein giftiges Gas). Klingt vielleicht nicht so appetitlich, aber es ist ein wichtiger Prozess in der chemischen Industrie. Mit Elektrolyse werden beispielsweise auch Aluminium, Kupfer und viele andere Metalle gewonnen. Ohne Elektrolyse gäbe es viele Dinge, die wir heute für selbstverständlich halten, nicht!
Die praktische Anwendung der Elektrolyse – mehr als nur ein Laborexperiment
Ich war erstaunt, als ich erfuhr, wie vielfältig die Elektrolyse in der Praxis eingesetzt wird. Hier nur einige Beispiele:
- Wasserstoffproduktion: Wie bereits erwähnt, ist Wasserstoff ein vielversprechender Energieträger der Zukunft. Die Elektrolyse von Wasser ist eine saubere und effiziente Methode, um Wasserstoff herzustellen.
- Metallgewinnung: Viele Metalle, wie Aluminium und Kupfer, werden durch Elektrolyse aus ihren Erzen gewonnen.
- Galvanisierung: Bei der Galvanisierung werden Metallgegenstände mit einer dünnen Schicht eines anderen Metalls überzogen, um sie vor Korrosion zu schützen oder ihnen ein schöneres Aussehen zu verleihen.
- Chlorproduktion: Chlor wird unter anderem zur Desinfektion von Schwimmbecken und zur Herstellung von Kunststoffen verwendet.
Ich fand es besonders spannend zu erfahren, dass auch bei der Herstellung von Mikrochips Elektrolyse eine wichtige Rolle spielt. Winzige Leiterbahnen werden mit Hilfe von Elektrolyse auf die Siliziumwafer aufgebracht. Ohne Elektrolyse gäbe es also keine Smartphones, keine Computer und keine Tablets!
Mein Fazit: Chemie ist überall!
Meine Reise in die Welt der Elektrolyse hat mir gezeigt, dass Chemie viel mehr ist als nur Formeln und Reagenzgläser. Sie ist ein fundamentaler Bestandteil unserer Welt und beeinflusst unser Leben in vielerlei Hinsicht. Ich kann nur jedem empfehlen, sich ein bisschen mit den Grundlagen der Chemie zu beschäftigen. Es öffnet einem die Augen für die Wunder der Natur und für die Leistungen der Wissenschaft.
Und wer weiß, vielleicht inspiriert euch meine Geschichte ja dazu, bei eurer nächsten Reise mal ein etwas anderes Museum zu besuchen oder euch ein Buch über Chemie zu kaufen. Ihr werdet überrascht sein, was es alles zu entdecken gibt! Und wer weiß, vielleicht trefft ihr ja auch einen freundlichen Museumsführer, der euch mit seiner Begeisterung für die Wissenschaft ansteckt.
Also, packt eure Koffer und macht euch auf die Suche nach neuen Abenteuern – egal ob in fernen Ländern oder in den Tiefen der Chemie! Und vergesst nicht: Die Welt ist voller Wunder, man muss sie nur entdecken wollen!
Eure reiselustige Chemiefan!