Aus Welchen Bestandteilen Bestehen Proteine
Proteine, die vielseitigen Arbeitspferde der Zelle, sind nicht nur essenzielle Nahrungsbestandteile, sondern auch fundamentale Bausteine des Lebens selbst. Sie sind verantwortlich für eine immense Bandbreite an Funktionen, von der Katalyse biochemischer Reaktionen bis hin zur Strukturgebung und dem Transport von Molekülen. Doch woraus bestehen diese komplexen Moleküle eigentlich? Die Antwort liegt in einer hierarchischen Struktur, die von einfachen Aminosäuren bis hin zu hochkomplexen dreidimensionalen Gebilden reicht.
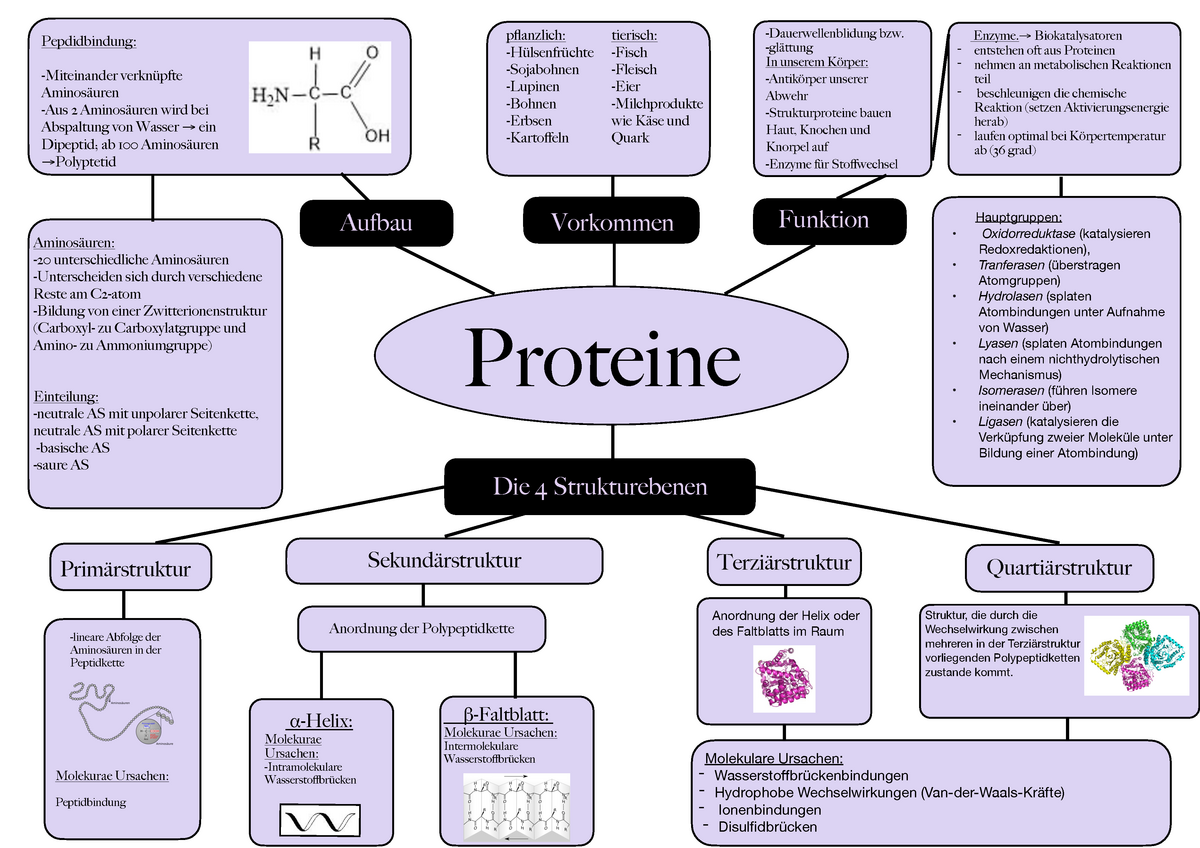
Die Grundbausteine: Aminosäuren
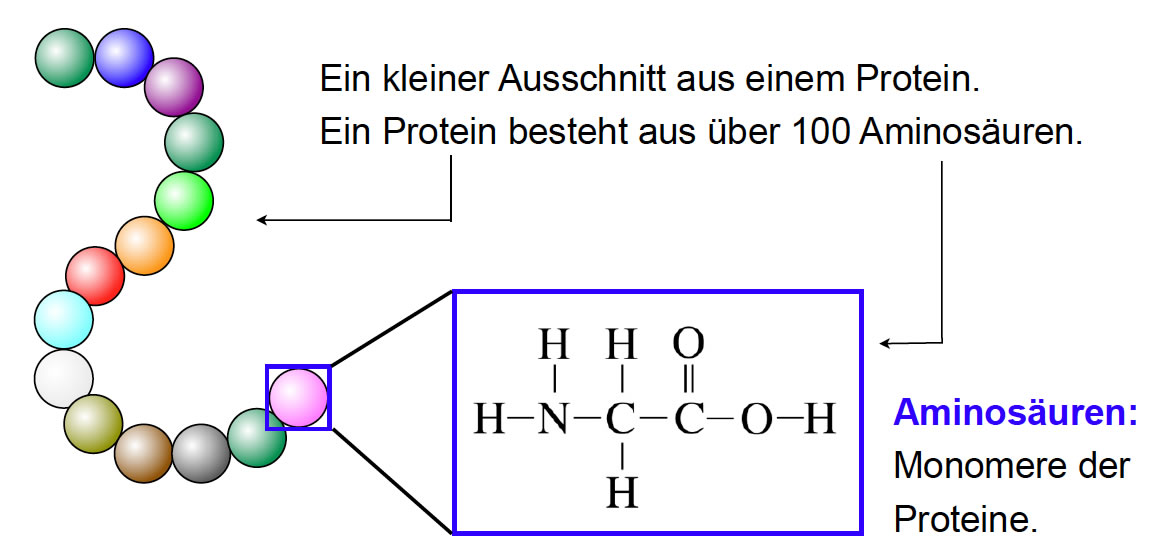
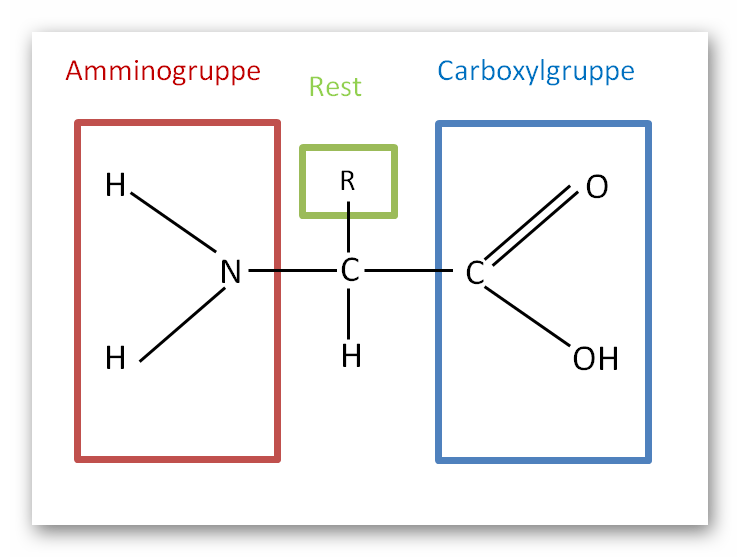
Am Anfang steht die Aminosäure. Sie ist der fundamentale Baustein jedes Proteins. Jede Aminosäure besteht aus einem zentralen Kohlenstoffatom (α-C-Atom), an das vier Gruppen gebunden sind: eine Aminogruppe (-NH2), eine Carboxylgruppe (-COOH), ein Wasserstoffatom (-H) und ein variabler Rest (R-Gruppe). Die Aminogruppe verleiht der Aminosäure ihre basischen, die Carboxylgruppe ihre sauren Eigenschaften. Die R-Gruppe ist das entscheidende Merkmal, das jede der 20 proteinogenen Aminosäuren voneinander unterscheidet. Diese R-Gruppen können unterschiedliche chemische Eigenschaften besitzen: sie können polar, unpolar, geladen oder ungeladen sein. Diese Vielfalt in den R-Gruppen ist es, die den Proteinen ihre enorme funktionelle Diversität verleiht.
Die 20 proteinogenen Aminosäuren
Die 20 proteinogenen Aminosäuren bilden das Alphabet, mit dem die Proteine geschrieben werden. Einige Beispiele sind:
- Alanin (Ala, A): Eine kleine, unpolare Aminosäure.
- Glycin (Gly, G): Die kleinste Aminosäure, ohne Chiralitätszentrum, was ihr eine besondere Flexibilität verleiht.
- Valin (Val, V): Eine weitere unpolare Aminosäure mit einer verzweigten Seitenkette.
- Leucin (Leu, L): Ähnlich wie Valin, aber mit einer längeren, verzweigten Seitenkette.
- Isoleucin (Ile, I): Ein Isomer von Leucin, ebenfalls unpolar und verzweigt.
- Phenylalanin (Phe, F): Eine aromatische Aminosäure.
- Tyrosin (Tyr, Y): Eine aromatische Aminosäure, die durch Anfügung einer Hydroxylgruppe an Phenylalanin entsteht.
- Tryptophan (Trp, W): Die größte aromatische Aminosäure mit einem Indolring.
- Serin (Ser, S): Eine polare, ungeladene Aminosäure mit einer Hydroxylgruppe.
- Threonin (Thr, T): Ähnlich wie Serin, aber mit einer zusätzlichen Methylgruppe.
- Cystein (Cys, C): Eine polare, ungeladene Aminosäure mit einer Thiolgruppe (-SH), die Disulfidbrücken bilden kann.
- Methionin (Met, M): Eine unpolare Aminosäure mit einem Schwefelatom in ihrer Seitenkette.
- Asparagin (Asn, N): Eine polare, ungeladene Aminosäure mit einer Amidgruppe.
- Glutamin (Gln, Q): Ähnlich wie Asparagin, aber mit einer längeren Seitenkette.
- Asparaginsäure (Asp, D): Eine saure (negativ geladene) Aminosäure.
- Glutaminsäure (Glu, E): Eine weitere saure (negativ geladene) Aminosäure.
- Lysin (Lys, K): Eine basische (positiv geladene) Aminosäure.
- Arginin (Arg, R): Eine stark basische (positiv geladene) Aminosäure.
- Histidin (His, H): Eine basische Aminosäure, deren Ladung vom pH-Wert abhängt.
- Prolin (Pro, P): Eine spezielle Aminosäure, deren Seitenkette an das α-N-Atom gebunden ist und eine ringförmige Struktur bildet.
Die Reihenfolge, in der diese Aminosäuren in einer Polypeptidkette angeordnet sind, wird durch die genetische Information in der DNA bestimmt. Diese Reihenfolge ist die Grundlage für die einzigartige dreidimensionale Struktur und Funktion jedes Proteins.
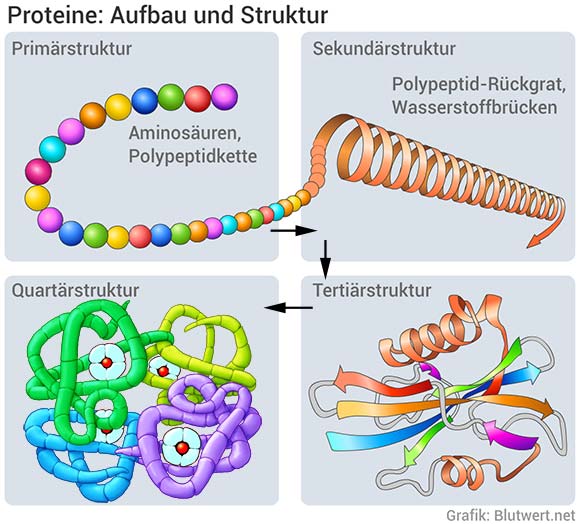
Die Primärstruktur: Die Aminosäuresequenz
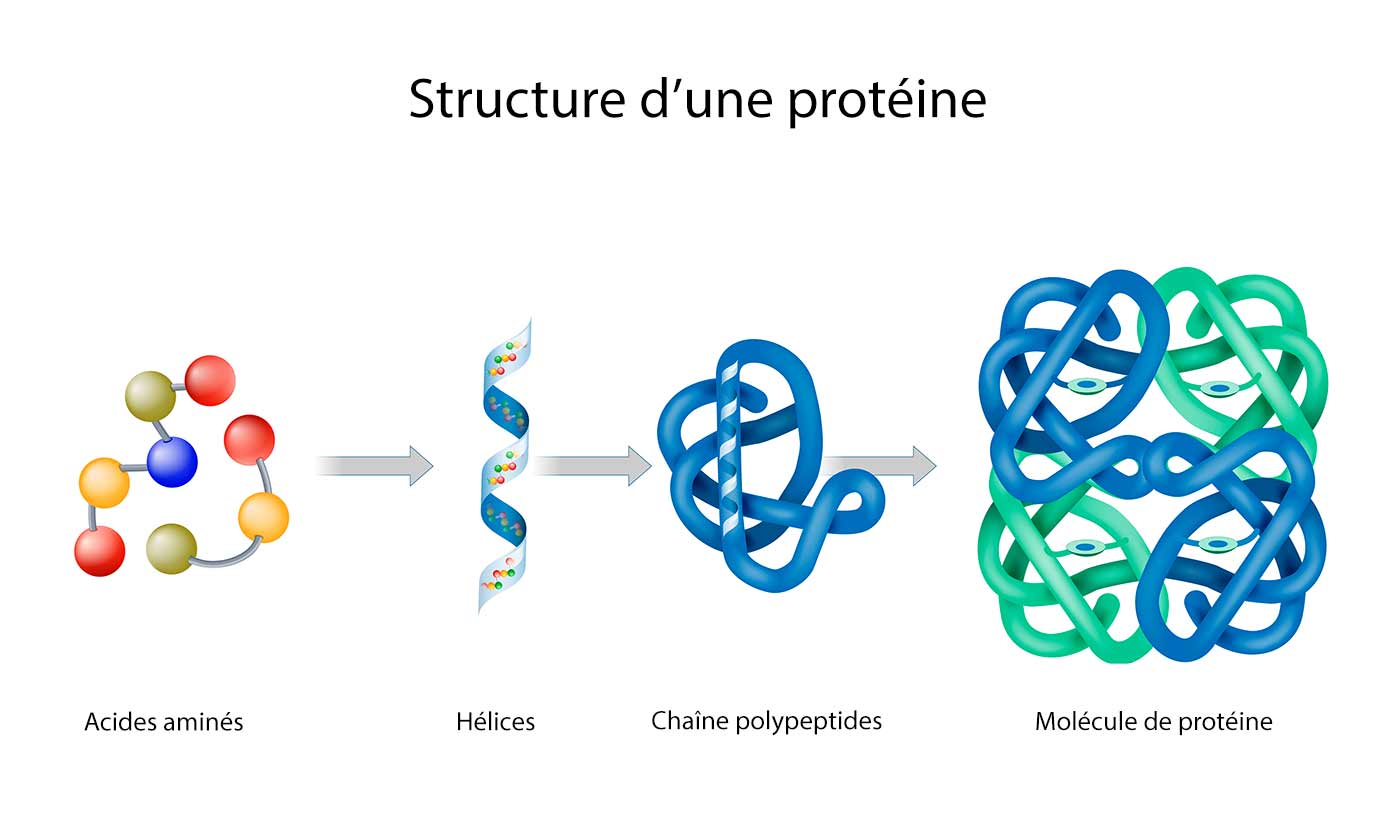
Die Primärstruktur eines Proteins ist schlicht die lineare Abfolge der Aminosäuren, die durch Peptidbindungen miteinander verbunden sind. Eine Peptidbindung entsteht, wenn die Carboxylgruppe einer Aminosäure mit der Aminogruppe der nächsten Aminosäure reagiert, wobei ein Wassermolekül abgespalten wird. Diese Kette von Aminosäuren, die durch Peptidbindungen verbunden sind, wird als Polypeptidkette bezeichnet. Die Primärstruktur ist von entscheidender Bedeutung, da sie die Grundlage für alle höheren Strukturebenen bildet. Eine einzige falsche Aminosäure an der falschen Stelle kann die gesamte Struktur und Funktion eines Proteins beeinträchtigen, wie beispielsweise bei der Sichelzellenanämie, bei der ein einziger Aminosäureaustausch in der β-Globin-Kette des Hämoglobins zu verheerenden Folgen führt.
Die Sekundärstruktur: Lokale Faltungen
Die Sekundärstruktur bezieht sich auf lokal gefaltete Abschnitte der Polypeptidkette, die durch Wasserstoffbrückenbindungen stabilisiert werden. Die zwei häufigsten Sekundärstrukturen sind die α-Helix und das β-Faltblatt. In einer α-Helix windet sich die Polypeptidkette spiralförmig um eine imaginäre Achse, wobei die Seitenketten der Aminosäuren nach außen ragen. Die Wasserstoffbrückenbindungen bilden sich zwischen dem Carbonylsauerstoff einer Aminosäure und dem Amidwasserstoff der Aminosäure vier Positionen weiter entlang der Kette. β-Faltblätter hingegen bestehen aus zwei oder mehr Polypeptidketten (oder Abschnitten derselben Kette), die nebeneinander liegen und durch Wasserstoffbrückenbindungen zwischen den Carbonyl- und Amidgruppen stabilisiert werden. β-Faltblätter können parallel oder antiparallel verlaufen, je nachdem, ob die Polypeptidketten in die gleiche oder entgegengesetzte Richtung verlaufen.
Die Tertiärstruktur: Die Gesamtstruktur
Die Tertiärstruktur beschreibt die dreidimensionale Gesamtstruktur eines einzelnen Polypeptidkette. Sie entsteht durch die Interaktion verschiedener Seitenketten der Aminosäuren miteinander. Diese Interaktionen umfassen:
- Wasserstoffbrückenbindungen: Zwischen polaren Seitenketten.
- Ionische Bindungen: Zwischen geladenen Seitenketten.
- Van-der-Waals-Kräfte: Zwischen unpolaren Seitenketten.
- Disulfidbrücken: Kovalente Bindungen zwischen den Thiolgruppen von Cysteinresten.
- Hydrophobe Interaktionen: Unpolare Seitenketten lagern sich im Inneren des Proteins zusammen, um den Kontakt mit Wasser zu minimieren.
Diese Interaktionen führen dazu, dass sich die Polypeptidkette in eine spezifische und einzigartige Form faltet. Die Tertiärstruktur ist entscheidend für die Funktion des Proteins, da sie die Form des aktiven Zentrums (bei Enzymen) oder der Bindungsstelle für andere Moleküle bestimmt.
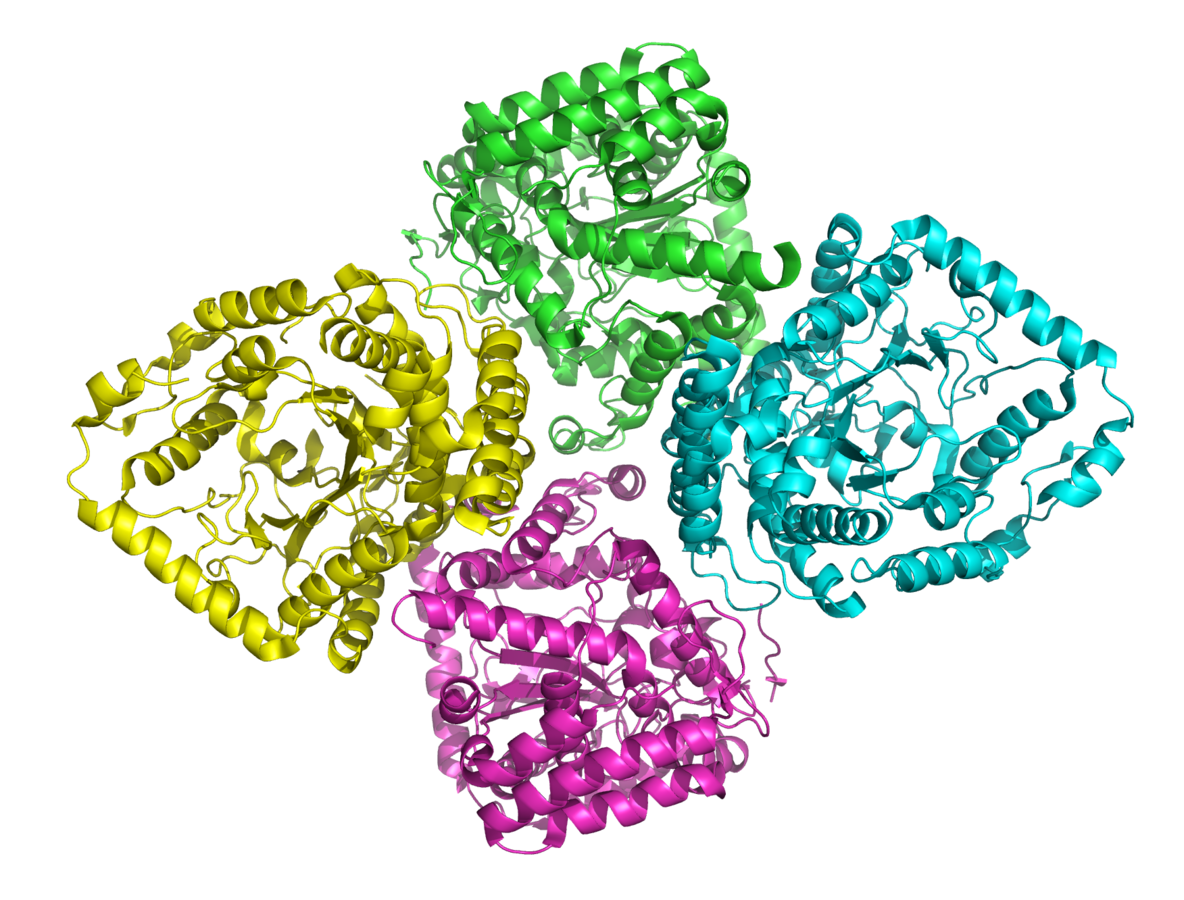
Die Quartärstruktur: Multimere Proteine
Nicht alle Proteine haben eine Quartärstruktur. Diese Strukturebene tritt auf, wenn ein Protein aus zwei oder mehr Polypeptidketten besteht, die auch als Untereinheiten bezeichnet werden. Die Quartärstruktur beschreibt, wie diese Untereinheiten zusammengefügt und räumlich angeordnet sind. Die Untereinheiten können identisch oder unterschiedlich sein und werden durch die gleichen nicht-kovalenten Wechselwirkungen zusammengehalten, die auch die Tertiärstruktur stabilisieren (Wasserstoffbrückenbindungen, ionische Bindungen, Van-der-Waals-Kräfte, hydrophobe Interaktionen) sowie durch kovalente Disulfidbrücken. Ein bekanntes Beispiel für ein Protein mit Quartärstruktur ist Hämoglobin, das aus vier Untereinheiten besteht: zwei α-Globin- und zwei β-Globin-Ketten. Die Quartärstruktur ist für die kooperative Bindung von Sauerstoff an Hämoglobin von entscheidender Bedeutung.
Fazit
Proteine sind komplexe Makromoleküle, deren Struktur und Funktion eng miteinander verknüpft sind. Von den einfachen Aminosäuren bis hin zu den hochkomplexen Quartärstrukturen bildet jede Strukturebene die Grundlage für die nächste. Das Verständnis der Zusammensetzung und Struktur von Proteinen ist von grundlegender Bedeutung für das Verständnis der Biologie auf molekularer Ebene. Die vielfältigen Funktionen, die Proteine im Körper erfüllen, machen sie zu unverzichtbaren Akteuren in nahezu allen biologischen Prozessen. Ihre komplexe Architektur, entstanden aus den einfachen Bausteinen, den Aminosäuren, ist ein Zeugnis der Eleganz und Effizienz der Natur.
![Aus Welchen Bestandteilen Bestehen Proteine Proteine • Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/08/WP_Bilder_Proteine_Strukturebenen-eines-Proteins-1024x576.jpg)
![Aus Welchen Bestandteilen Bestehen Proteine Proteine • Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/08/WP_Proteine_2-1024x576.jpg)
![Aus Welchen Bestandteilen Bestehen Proteine Proteine • Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/08/WP_Proteine_1-1024x576.jpg)
![Aus Welchen Bestandteilen Bestehen Proteine Proteine • Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/08/WP_Proteine_4-1024x576.jpg)
![Aus Welchen Bestandteilen Bestehen Proteine Proteine • Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/08/WP_Bilder_Proteine_Tertiaerstruktur-Protein-1024x576.jpg)





![Aus Welchen Bestandteilen Bestehen Proteine Aminosäuren Aufbau • Grundstruktur und Strukturformel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/07/Thumbnail_Proteine-1024x576.png)

