Chemische Bindungen Im Vergleich Arbeitsblatt Lösungen
Willkommen zurück zu unserer kleinen Entdeckungsreise durch die faszinierende Welt der Chemie! Heute tauchen wir in ein Thema ein, das vielleicht auf den ersten Blick trocken erscheinen mag, aber tatsächlich die Grundlage für alles um uns herum bildet: Chemische Bindungen. Keine Sorge, wir werden es nicht zu kompliziert machen! Denk einfach an chemische Bindungen als die "Klebstoffe", die Atome zusammenhalten und Moleküle bilden. Und Moleküle wiederum sind die Bausteine aller Stoffe, von dem Wasser, das du trinkst, bis zu der Luft, die du atmest.
Was sind chemische Bindungen überhaupt?
Stell dir vor, Atome sind wie kleine Legosteine. Sie wollen sich miteinander verbinden, um stabiler zu werden. Diese Verbindung entsteht durch die Anziehungskräfte zwischen den Atomen – das sind die chemischen Bindungen. Es gibt verschiedene Arten dieser Bindungen, jede mit ihren eigenen Eigenschaften und Stärken.
Im Grunde geht es darum, dass Atome ihre äußeren Elektronenschalen füllen möchten. Jedes Atom "strebt" nach einer Konfiguration, die ihm Stabilität verleiht. Das kann es erreichen, indem es Elektronen abgibt, aufnimmt oder teilt. Genau diese Interaktion der Elektronen ist die Grundlage für die verschiedenen Arten von chemischen Bindungen.
Die wichtigsten Arten chemischer Bindungen im Vergleich
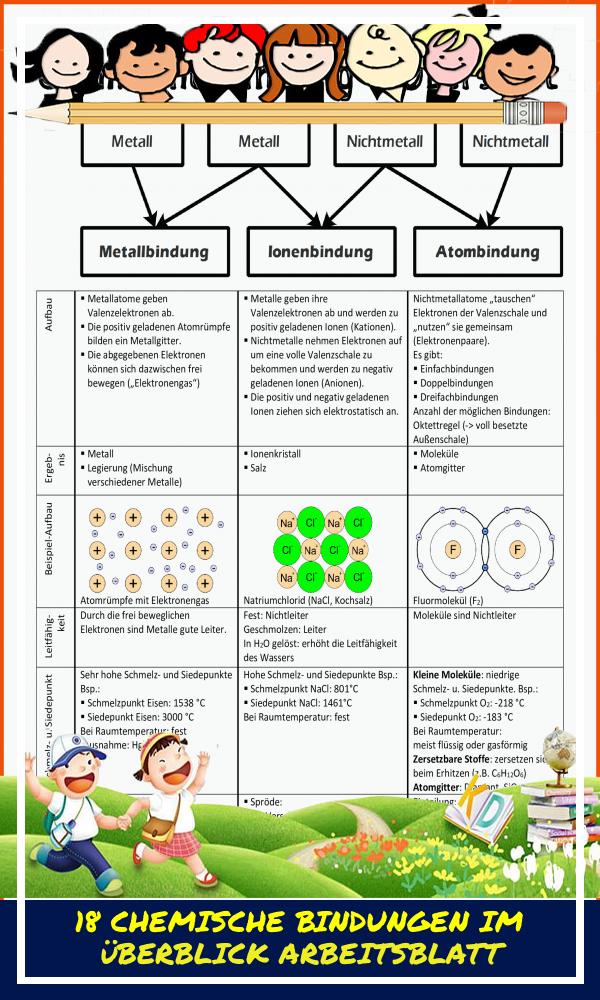
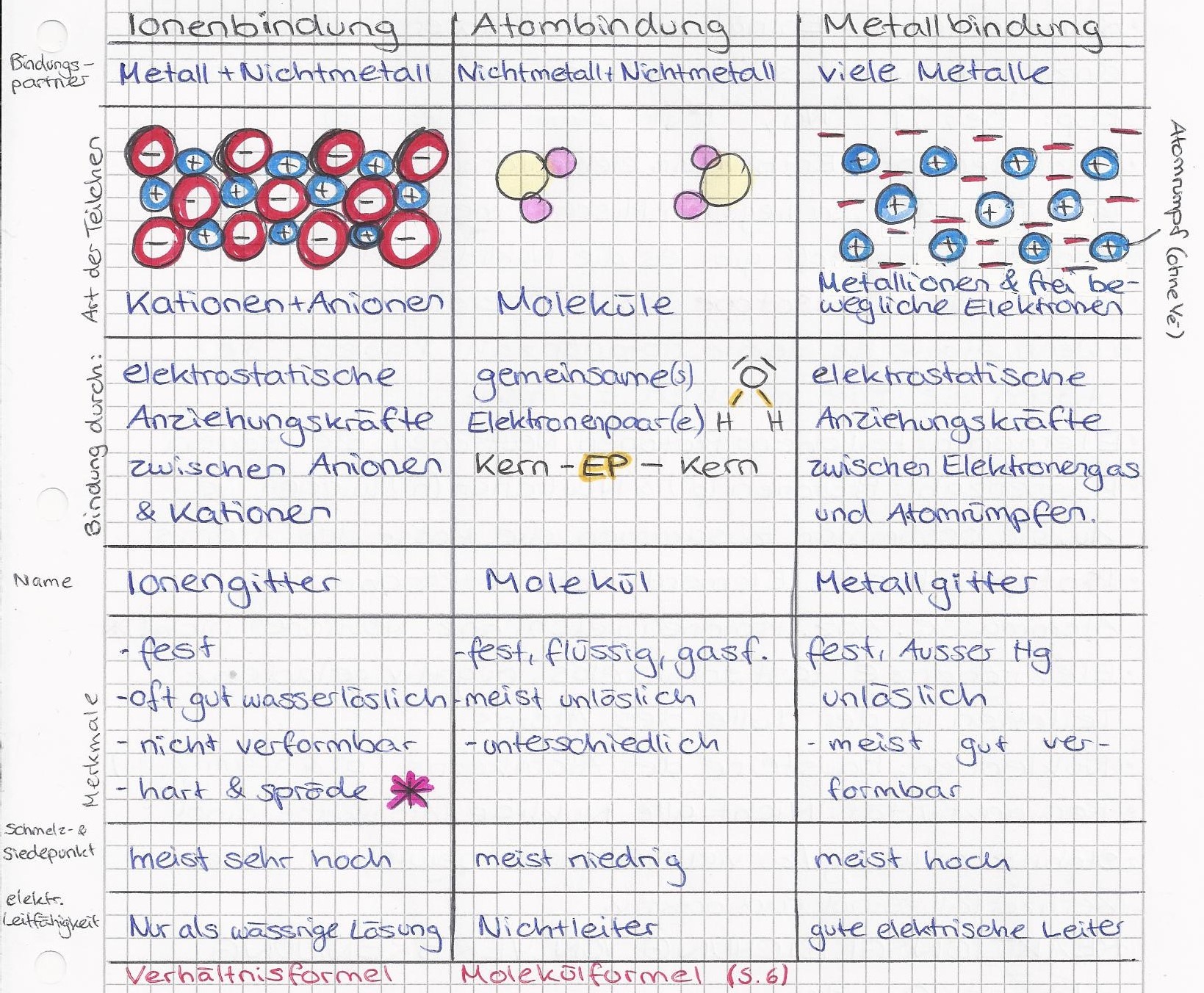
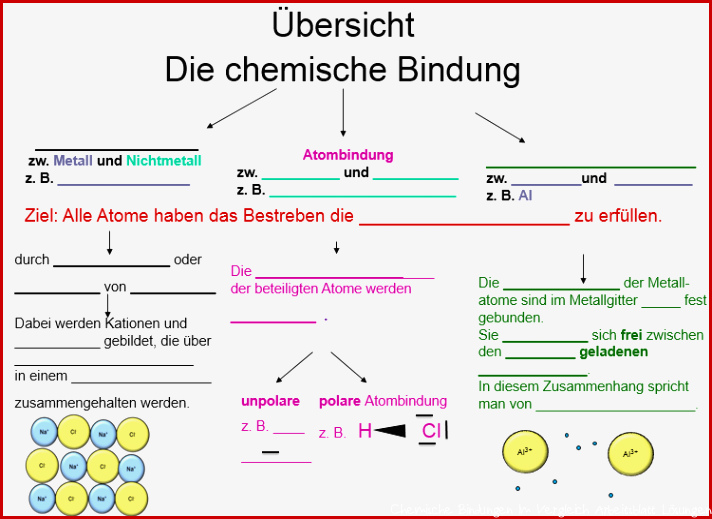
Es gibt verschiedene Arten von chemischen Bindungen, aber wir konzentrieren uns auf die drei wichtigsten: Ionenbindung, kovalente Bindung und metallische Bindung. Jede dieser Bindungsarten hat ihre eigenen charakteristischen Merkmale und führt zu unterschiedlichen Eigenschaften der resultierenden Stoffe.
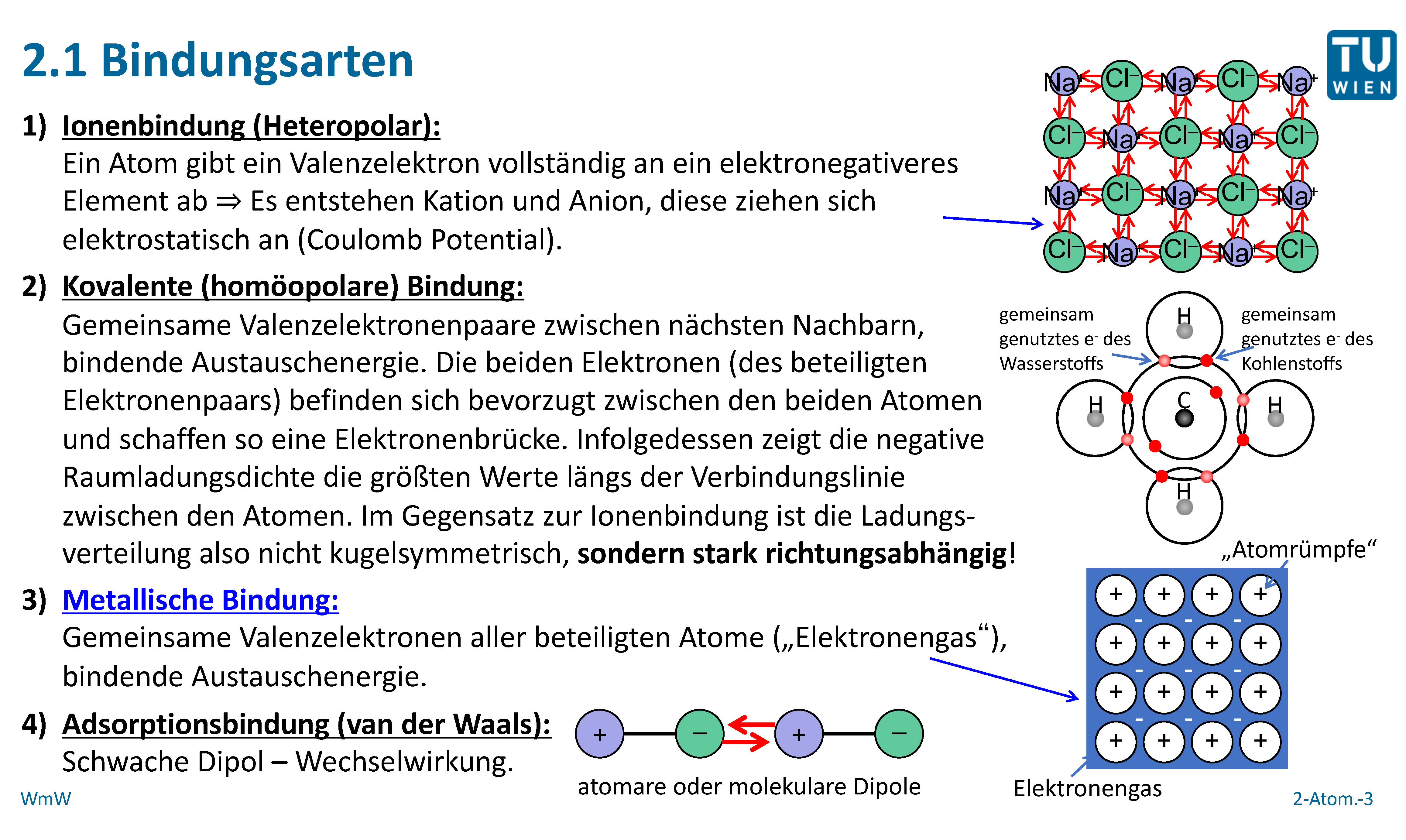
Ionenbindung: Wenn Atome Elektronen tauschen
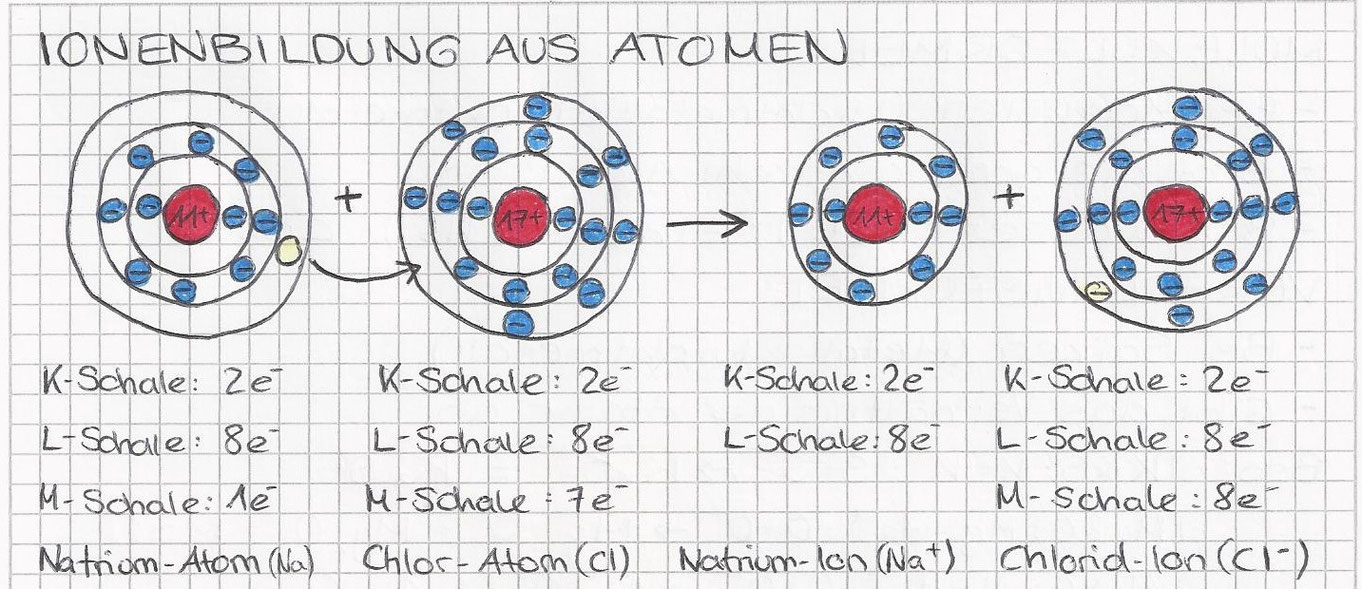
Die Ionenbindung entsteht, wenn ein Atom ein oder mehrere Elektronen an ein anderes Atom abgibt. Das Atom, das Elektronen abgibt, wird zu einem positiv geladenen Ion (Kation), während das Atom, das Elektronen aufnimmt, zu einem negativ geladenen Ion (Anion) wird. Diese entgegengesetzt geladenen Ionen ziehen sich dann gegenseitig an, was zu einer starken elektrostatischen Bindung führt. Denk an Natriumchlorid (Kochsalz): Natrium (Na) gibt ein Elektron an Chlor (Cl) ab. Na wird zu Na+ und Cl wird zu Cl-. Die Anziehungskraft zwischen Na+ und Cl- bildet die Ionenbindung.
Eigenschaften von Stoffen mit Ionenbindung:
- Hohe Schmelz- und Siedepunkte: Die starke elektrostatische Anziehungskraft erfordert viel Energie, um die Ionen voneinander zu trennen.
- Spröde: Wenn man eine mechanische Spannung auf ein Ionenkristall ausübt, können sich die Ionen so verschieben, dass gleichgeladene Ionen nebeneinander liegen. Dies führt zu einer Abstoßung und zum Bruch des Kristalls.
- Leitfähigkeit in geschmolzenem oder gelöstem Zustand: Im festen Zustand sind die Ionen in einem Kristallgitter fixiert und können sich nicht frei bewegen. In geschmolzenem oder gelöstem Zustand sind die Ionen jedoch beweglich und können Ladung transportieren, wodurch der Stoff elektrisch leitfähig wird.
- Oft gut wasserlöslich: Wasser ist ein polares Lösungsmittel, d.h. es hat eine positive und eine negative Seite. Diese polaren Wassermoleküle können die Ionen aus dem Kristallgitter "herauslösen" und umhüllen, wodurch die Ionenbindung geschwächt wird.
Kovalente Bindung: Wenn Atome Elektronen teilen
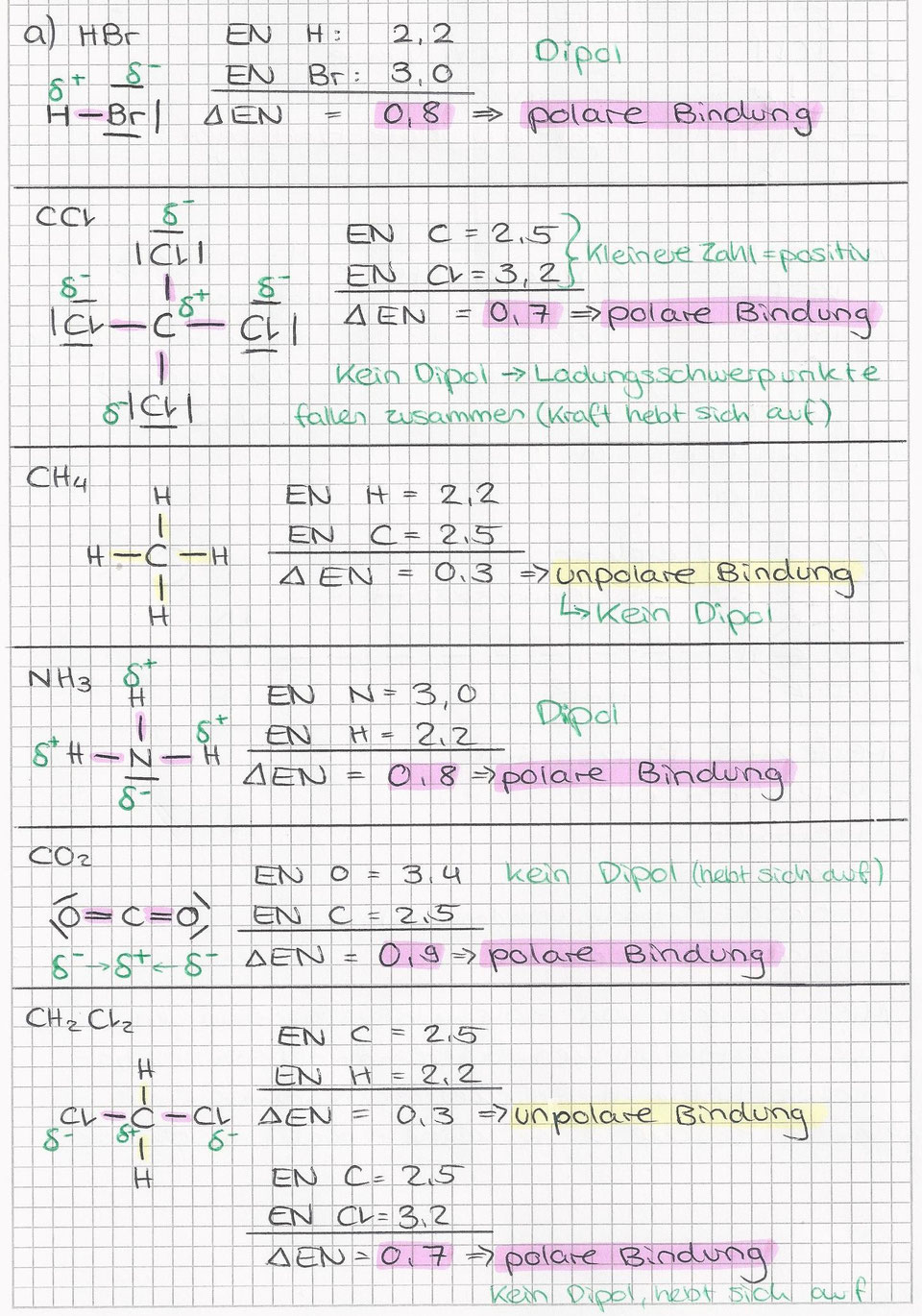
Bei der kovalenten Bindung teilen sich Atome ein oder mehrere Elektronenpaare, um eine stabile Elektronenkonfiguration zu erreichen. Anstatt Elektronen vollständig abzugeben oder aufzunehmen, teilen sie sich die Elektronen, wodurch eine starke Anziehungskraft zwischen den Atomkernen und den gemeinsam genutzten Elektronen entsteht. Es gibt zwei Hauptarten von kovalenten Bindungen: polare und unpolare kovalente Bindungen.
Unpolare kovalente Bindung: Hier teilen sich zwei Atome die Elektronenpaare gleichmäßig. Dies tritt typischerweise auf, wenn die Atome die gleiche Elektronegativität haben (d.h. die gleiche Fähigkeit, Elektronen an sich zu ziehen), wie beispielsweise bei zweiatomigen Molekülen wie H2, O2 oder Cl2.
Polare kovalente Bindung: Hier teilen sich die Atome die Elektronenpaare ungleichmäßig. Dies tritt auf, wenn die Atome unterschiedliche Elektronegativitäten haben. Das Atom mit der höheren Elektronegativität zieht die Elektronen stärker an sich, wodurch eine partielle negative Ladung (δ-) an diesem Atom und eine partielle positive Ladung (δ+) am anderen Atom entsteht. Ein gutes Beispiel ist Wasser (H2O): Sauerstoff ist elektronegativer als Wasserstoff, daher zieht Sauerstoff die Elektronen stärker an sich. Dies führt zu einer partiellen negativen Ladung am Sauerstoffatom und partiellen positiven Ladungen an den Wasserstoffatomen.
Eigenschaften von Stoffen mit kovalenter Bindung:
- Niedrigere Schmelz- und Siedepunkte im Vergleich zu Ionenverbindungen: Die intermolekularen Kräfte (d.h. die Kräfte zwischen den Molekülen) sind in der Regel schwächer als die elektrostatischen Kräfte in Ionenverbindungen.
- Variable Löslichkeit: Ob ein kovalenter Stoff in Wasser löslich ist, hängt von seiner Polarität ab. Polare kovalente Stoffe sind in der Regel gut in polaren Lösungsmitteln wie Wasser löslich, während unpolare kovalente Stoffe in unpolaren Lösungsmitteln wie Benzin löslich sind. ("Gleiches löst Gleiches")
- Schlechte elektrische Leitfähigkeit: Kovalente Stoffe leiten in der Regel keinen elektrischen Strom, da keine frei beweglichen Ladungsträger (Ionen oder Elektronen) vorhanden sind. Es gibt aber Ausnahmen, wie z.B. Graphit, eine Form des Kohlenstoffs.
Metallische Bindung: Ein Meer von Elektronen
Die metallische Bindung tritt in Metallen auf. Hier geben die Atome ihre Valenzelektronen (die Elektronen in der äußeren Schale) ab und bilden ein "Meer" von frei beweglichen Elektronen, das sich über den gesamten Metallkörper erstreckt. Die positiv geladenen Metallionen (Atomrümpfe) sind in diesem Elektronenmeer eingebettet und werden durch die elektrostatische Anziehungskraft zu den frei beweglichen Elektronen zusammengehalten.
Eigenschaften von Stoffen mit metallischer Bindung:
- Gute elektrische und thermische Leitfähigkeit: Die frei beweglichen Elektronen können leicht Ladung und Wärme transportieren.
- Verformbarkeit (Duktilität und Verbiegbarkeit): Metalle lassen sich leicht verformen, da die Metallionen im Elektronenmeer verschoben werden können, ohne die Bindung zu brechen.
- Metallischer Glanz: Die frei beweglichen Elektronen können Licht absorbieren und wieder abgeben, was zu dem typischen metallischen Glanz führt.
- Hohe Schmelz- und Siedepunkte (variabel): Die Stärke der metallischen Bindung hängt von der Anzahl der Valenzelektronen und der Größe der Atomrümpfe ab. Einige Metalle, wie z.B. Wolfram, haben sehr hohe Schmelzpunkte, während andere, wie z.B. Quecksilber, bei Raumtemperatur flüssig sind.
Arbeitsblatt Lösungen: Anwendungen und Beispiele
Um das Ganze noch etwas praktischer zu gestalten, betrachten wir einige Beispiele und Anwendungen, die oft in Arbeitsblättern zu diesem Thema vorkommen:
* Frage: Welche Bindungsart liegt in Kochsalz (NaCl) vor? Antwort: Ionenbindung. Natrium (Na) gibt ein Elektron an Chlor (Cl) ab. * Frage: Warum leitet Kupfer elektrischen Strom so gut? Antwort: Aufgrund der metallischen Bindung und dem "Meer" von frei beweglichen Elektronen. * Frage: Ist Wasser (H2O) polar oder unpolar? Antwort: Polar. Sauerstoff ist elektronegativer als Wasserstoff. * Frage: Warum haben Ionenverbindungen so hohe Schmelzpunkte? Antwort: Weil die elektrostatische Anziehungskraft zwischen den Ionen sehr stark ist.Zusammenfassung
Chemische Bindungen sind die Kräfte, die Atome zusammenhalten und Moleküle bilden. Die drei wichtigsten Arten sind Ionenbindung (Elektronentausch), kovalente Bindung (Elektronenteilung) und metallische Bindung (Elektronenmeer). Jede Bindungsart führt zu unterschiedlichen Eigenschaften der resultierenden Stoffe. Das Verständnis dieser grundlegenden Konzepte hilft uns, die Welt um uns herum besser zu verstehen.
Und das war's! Wir hoffen, diese kleine Einführung in die Welt der chemischen Bindungen war informativ und nicht allzu abschreckend. Denk daran, Chemie ist überall um uns herum, und ein bisschen Wissen kann uns helfen, die Welt mit neuen Augen zu sehen. Bis zum nächsten Mal!
Bonus-Tipp: Wenn du mehr über chemische Bindungen erfahren möchtest, schau dir Online-Ressourcen wie Khan Academy oder ChemSketch an. Dort findest du interaktive Übungen und detailliertere Erklärungen.
Hinweis: Dieses Dokument dient zur allgemeinen Information und ersetzt keine professionelle chemische Beratung. Bei spezifischen Fragen wende dich bitte an einen qualifizierten Chemiker.