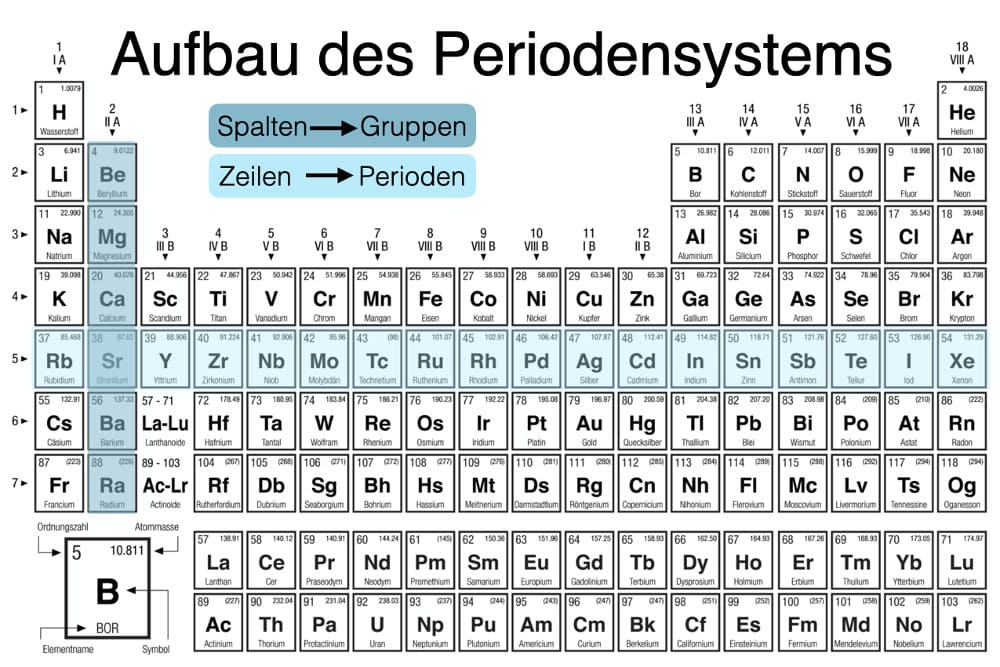
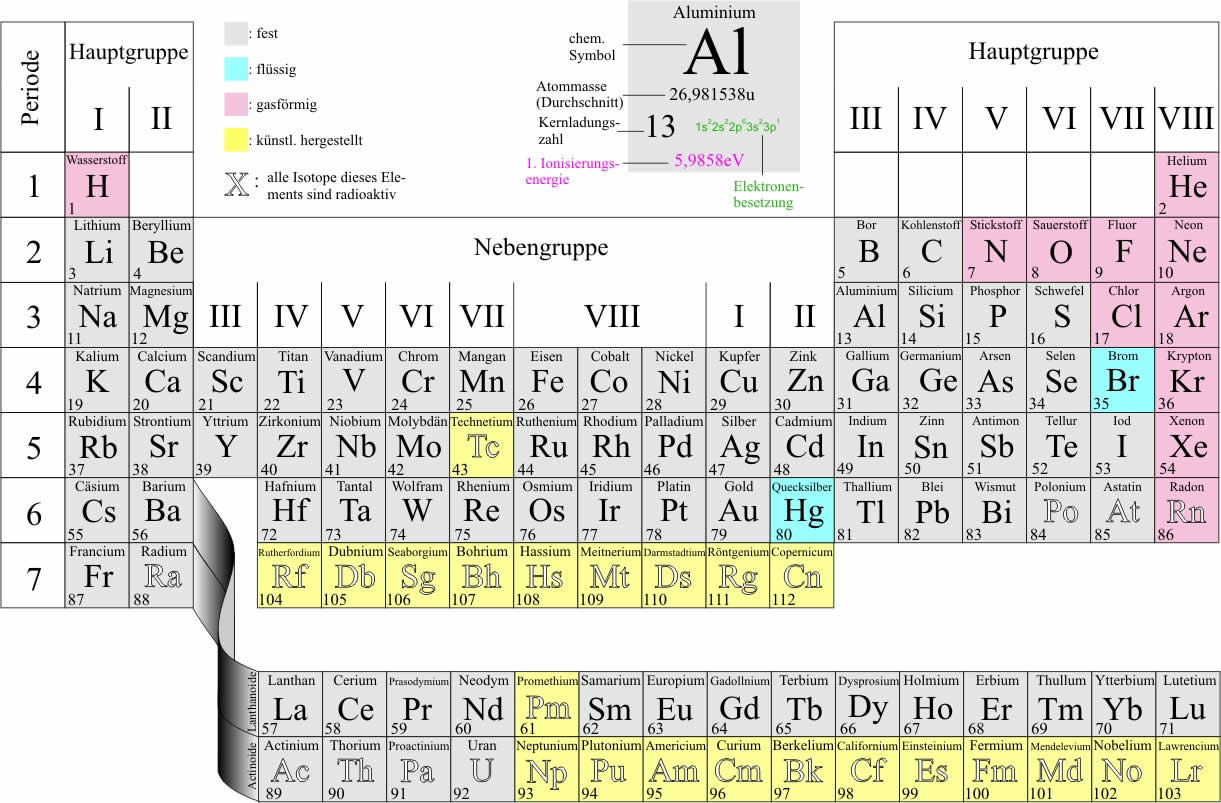
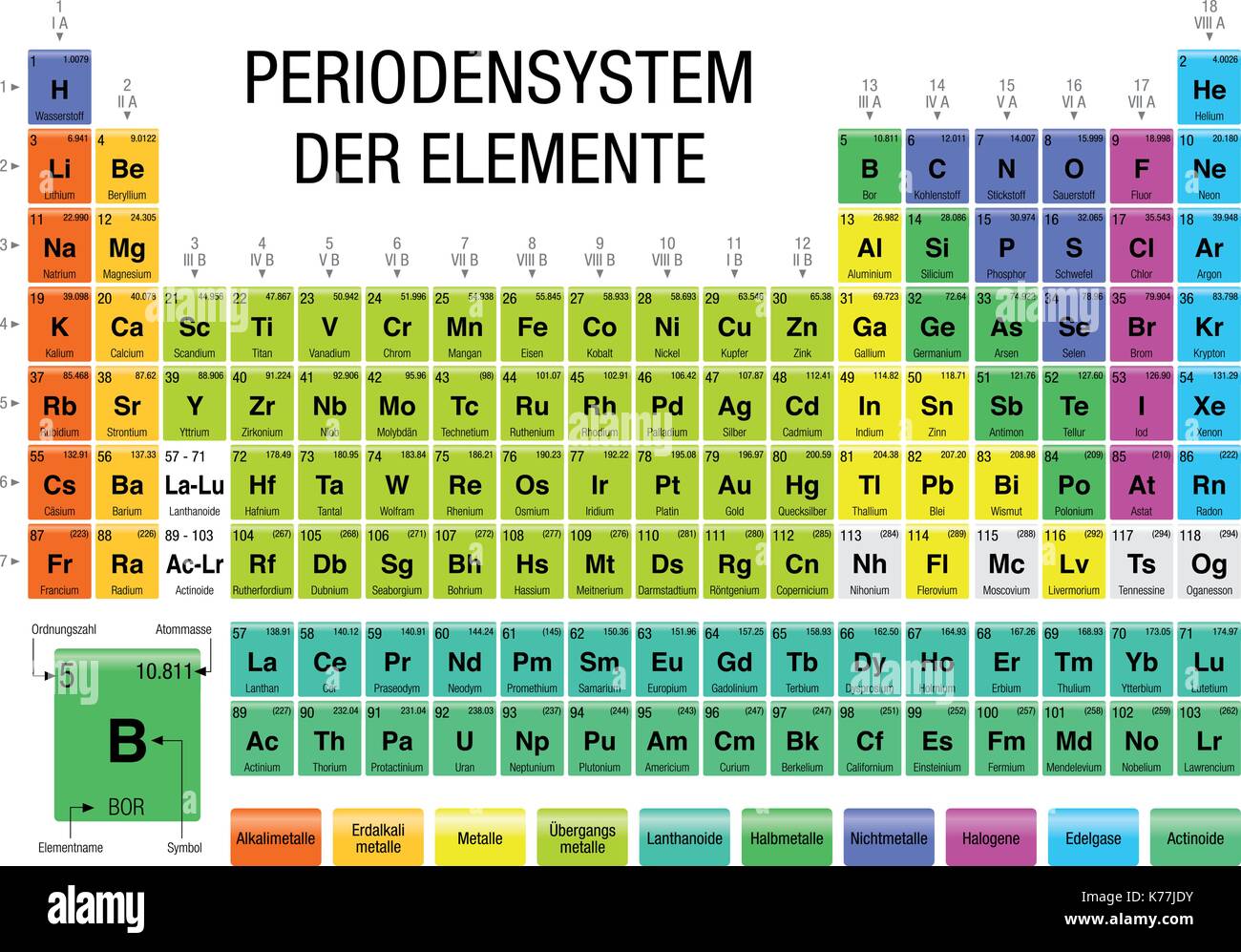
Chemisches Element Der Achten Hauptgruppe
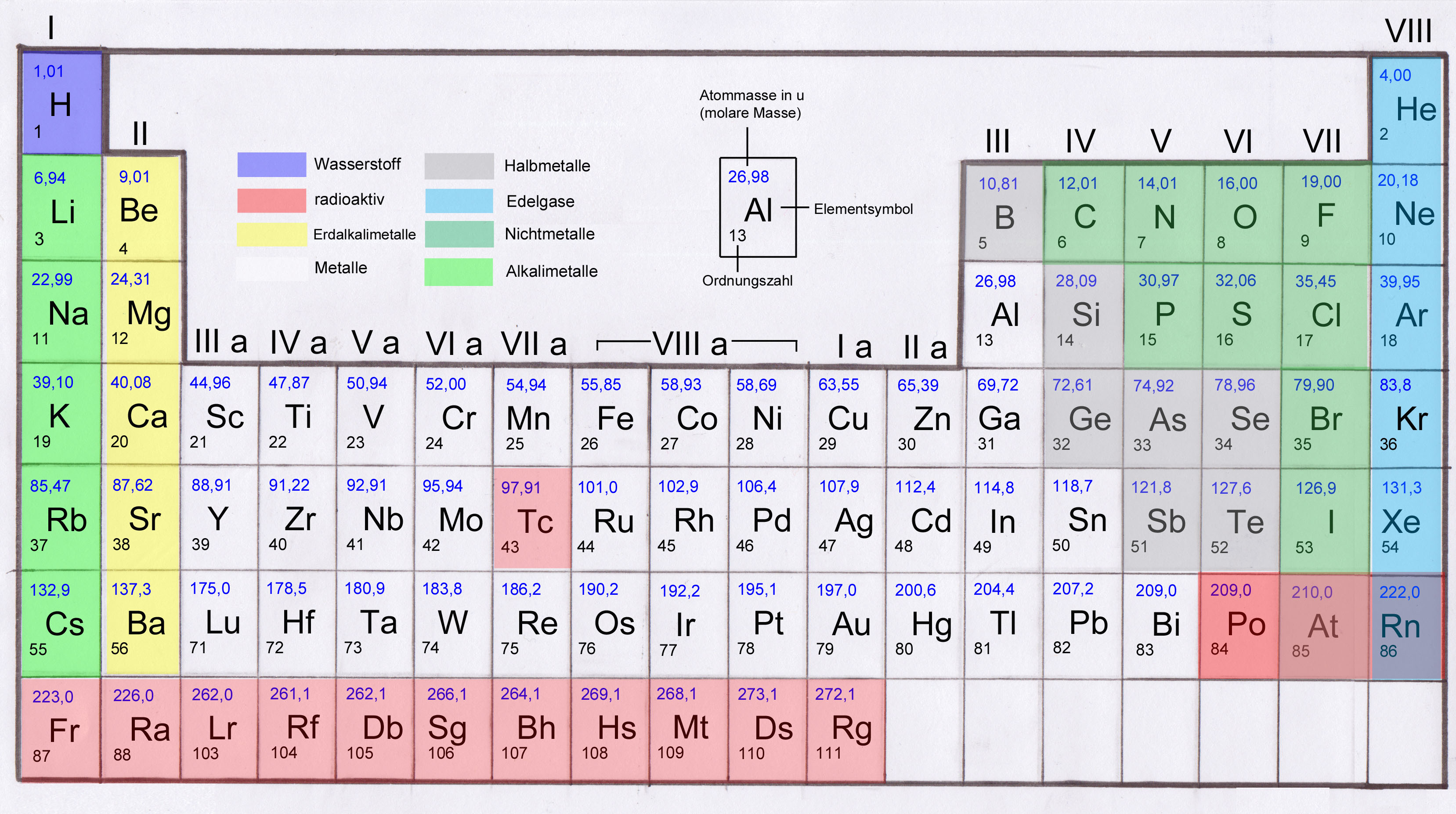
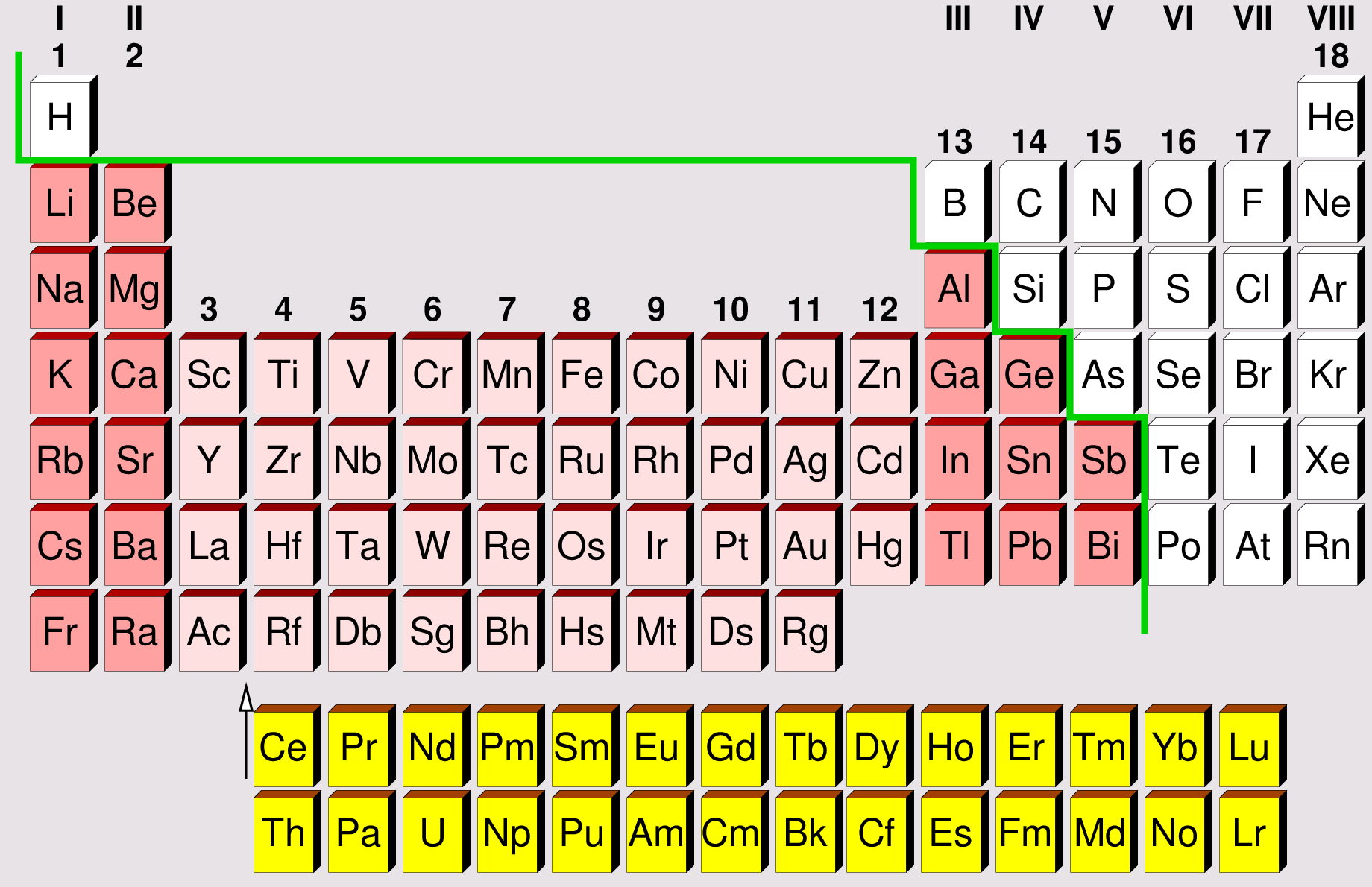
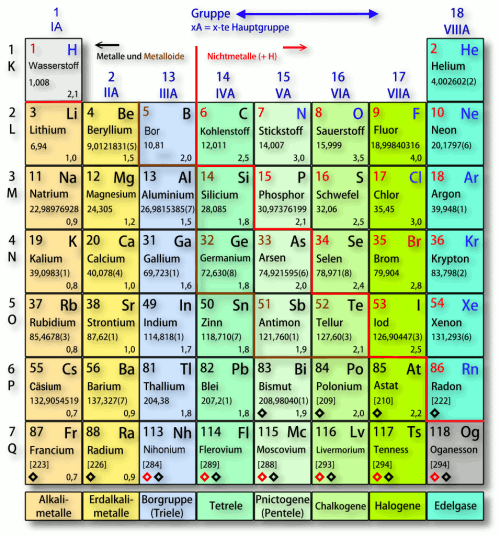
Die 8. Hauptgruppe des Periodensystems, oft auch als Edelgase oder Inertgase bezeichnet, umfasst eine Gruppe von chemischen Elementen mit bemerkenswerten und einzigartigen Eigenschaften. Diese Elemente – Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und Radon (Rn) – teilen sich eine charakteristische chemische Inertheit, was bedeutet, dass sie unter normalen Bedingungen nur sehr ungern chemische Verbindungen eingehen. Diese Stabilität resultiert aus ihrer vollständig gefüllten äußersten Elektronenschale (Valenzschale), die ihnen eine besonders stabile Elektronenkonfiguration verleiht.
Eigenschaften der Edelgase
Die Edelgase weisen eine Reihe von physikalischen und chemischen Eigenschaften auf, die sie von anderen Elementen im Periodensystem unterscheiden. Zu den wichtigsten Eigenschaften gehören:
- Geruchlos, farblos und geschmacklos: Edelgase sind bei Raumtemperatur farb-, geruch- und geschmacklos, was ihre Detektion ohne spezielle Ausrüstung erschwert.
- Extrem niedrige Siedepunkte: Sie haben extrem niedrige Siedepunkte, was bedeutet, dass sie unter normalen Bedingungen gasförmig sind. Helium hat den niedrigsten Siedepunkt aller bekannten Stoffe.
- Geringe Reaktivität: Ihre vollständig gefüllten Valenzschalen führen zu einer sehr geringen Reaktivität. Sie sind extrem stabil und neigen nicht dazu, Elektronen aufzunehmen, abzugeben oder zu teilen.
- Isolatoren: Edelgase sind gute Isolatoren für Elektrizität und Wärme.
- Monoatomar: Sie existieren in der Regel als einzelne Atome (monoatomar) und bilden keine diatomaren Moleküle wie beispielsweise Sauerstoff (O2) oder Stickstoff (N2).
Helium (He)
Helium ist das leichteste Edelgas und das zweithäufigste Element im Universum, hauptsächlich in Sternen zu finden. Auf der Erde ist es relativ selten. Es wird hauptsächlich durch den radioaktiven Zerfall schwererer Elemente in der Erdkruste gebildet und in Erdgasfeldern eingeschlossen. Aufgrund seines extrem niedrigen Siedepunkts (4,2 K oder -268,95 °C) wird es häufig als Kühlmittel in kryogenen Anwendungen verwendet, beispielsweise zur Kühlung von supraleitenden Magneten in MRT-Geräten (Magnetresonanztomographie) oder bei der Forschung mit Supraleitern. Helium wird auch zum Füllen von Ballons und Luftschiffen verwendet, da es leichter als Luft ist und nicht brennbar. Das Einatmen von Helium verändert die Stimme, da es die Schallgeschwindigkeit in der Atemluft erhöht; dies ist jedoch nur ein vorübergehender Effekt.
Neon (Ne)
Neon ist bekannt für seine leuchtend rote Farbe, die es abgibt, wenn elektrischer Strom durch es hindurchgeleitet wird. Diese Eigenschaft macht es ideal für die Verwendung in Leuchtreklamen, wo es in verschiedenen Farben eingesetzt wird, indem es mit anderen Edelgasen oder Farbstoffen gemischt wird. Neon wird durch fraktionierte Destillation von verflüssigter Luft gewonnen. Neben Leuchtreklamen wird Neon auch in Hochspannungsindikatoren und als Kühlmittel verwendet.
Argon (Ar)
Argon ist das häufigste Edelgas in der Erdatmosphäre, wo es etwa 0,93 % ausmacht. Es wird industriell durch fraktionierte Destillation von verflüssigter Luft gewonnen. Argon wird hauptsächlich als Schutzgas beim Schweißen verwendet, um die Oxidation des Metalls an der Schweißstelle zu verhindern. Es findet auch Verwendung in Glühlampen und fluoreszierenden Leuchtstoffröhren, wo es die Lebensdauer des Glühfadens verlängert. Darüber hinaus wird Argon in der Lebensmittelverpackung eingesetzt, um die Oxidation zu verlangsamen und die Haltbarkeit von Lebensmitteln zu verlängern.
Krypton (Kr)
Krypton ist ein seltenes Edelgas, das ebenfalls durch fraktionierte Destillation von verflüssigter Luft gewonnen wird. Es wird in einigen Arten von Glühlampen und Blitzröhren für Hochgeschwindigkeitsfotografie verwendet. Eine frühere Definition des Meters basierte auf der Wellenlänge der von Krypton-86 emittierten orangefarbenen Spektrallinie. Krypton wird auch in einigen Lasern eingesetzt.
Xenon (Xe)
Xenon ist ein noch selteneres Edelgas als Krypton und entsprechend teurer. Es wird ebenfalls durch fraktionierte Destillation von verflüssigter Luft gewonnen. Xenon findet Verwendung in Blitzlampen, die in der Fotografie eingesetzt werden, sowie in einigen Arten von Bogenlampen. Es wird auch in einigen Anästhetika verwendet, da es eine narkotische Wirkung hat. In der Raumfahrt wird Xenon als Treibmittel für Ionentriebwerke eingesetzt, da es ein hohes Atomgewicht hat und somit eine effiziente Beschleunigung ermöglicht.
Radon (Rn)
Radon ist ein radioaktives Edelgas, das beim Zerfall von Radium entsteht, welches wiederum ein Zerfallsprodukt von Uran ist. Es ist farblos, geruchlos und geschmacklos, was seine Detektion schwierig macht. Radon kann sich in Kellern und anderen schlecht belüfteten Bereichen ansammeln und stellt ein Gesundheitsrisiko dar, da es beim Einatmen Lungenkrebs verursachen kann. Radon-Tests sind in vielen Ländern vorgeschrieben, um die Radonkonzentration in Gebäuden zu überwachen und gegebenenfalls Maßnahmen zur Reduzierung zu ergreifen. Aufgrund seiner Radioaktivität wird es in der Strahlentherapie zur Behandlung bestimmter Krebsarten eingesetzt.
Verbindungen der Edelgase
Lange Zeit galten Edelgase als vollständig inert und unfähig, chemische Verbindungen einzugehen. Dies änderte sich jedoch 1962, als Neil Bartlett die erste chemische Verbindung eines Edelgases, Xenonhexafluoroplatinat (XePtF6), synthetisierte. Diese Entdeckung revolutionierte das Verständnis der Edelgaschemie und führte zur Synthese einer Reihe weiterer Verbindungen, insbesondere von Xenon und Krypton mit Fluor und Sauerstoff. Verbindungen von Helium und Neon sind bis heute nicht bekannt, was ihre extreme Inertheit unterstreicht. Argonverbindungen sind extrem selten und instabil. Die Bildung von Edelgasverbindungen ist oft durch extreme Bedingungen wie niedrige Temperaturen und hohe Drücke erforderlich.
Die Fluoride von Xenon (XeF2, XeF4, XeF6) sind die am besten untersuchten Xenonverbindungen. Sie sind starke Oxidationsmittel und können zur Synthese anderer Xenonverbindungen verwendet werden. Xenontrioxid (XeO3) ist eine weitere bekannte Xenonverbindung, die jedoch extrem explosiv ist. Kryptondifluorid (KrF2) ist die bekannteste Kryptonverbindung, die ebenfalls ein starkes Oxidationsmittel ist. Die Chemie der Edelgasverbindungen ist ein aktives Forschungsgebiet, das ständig neue Erkenntnisse liefert.
Anwendungen der Edelgase
Die Edelgase finden aufgrund ihrer einzigartigen Eigenschaften vielfältige Anwendungen in verschiedenen Bereichen:
- Kryotechnik: Helium wird als Kühlmittel in kryogenen Anwendungen eingesetzt, z.B. in MRT-Geräten und bei der Forschung mit Supraleitern.
- Beleuchtung: Neon wird in Leuchtreklamen verwendet. Argon wird in Glühlampen und Leuchtstoffröhren eingesetzt. Xenon wird in Blitzlampen und Bogenlampen eingesetzt.
- Schutzgase: Argon wird als Schutzgas beim Schweißen verwendet, um die Oxidation von Metallen zu verhindern.
- Raumfahrt: Xenon wird als Treibmittel für Ionentriebwerke eingesetzt.
- Medizin: Helium wird in der Atemgastherapie eingesetzt. Xenon wird als Anästhetikum verwendet. Radon wird in der Strahlentherapie eingesetzt.
- Lebensmittelindustrie: Argon wird in der Lebensmittelverpackung eingesetzt, um die Haltbarkeit von Lebensmitteln zu verlängern.
- Radonschutz: Radon-Tests sind in vielen Ländern vorgeschrieben, um die Radonkonzentration in Gebäuden zu überwachen.
Fazit
Die Edelgase, die Elemente der 8. Hauptgruppe des Periodensystems, sind eine faszinierende Gruppe von Elementen mit einzigartigen Eigenschaften. Ihre Inertheit, ihre niedrigen Siedepunkte und ihre spezifischen spektralen Eigenschaften machen sie zu wertvollen Werkzeugen in einer Vielzahl von Anwendungen, von der Kryotechnik bis zur Medizin. Obwohl sie traditionell als unreaktiv galten, hat die Entdeckung von Edelgasverbindungen unser Verständnis der Chemie erweitert und neue Forschungsbereiche eröffnet. Das Wissen über die Eigenschaften und Anwendungen der Edelgase ist nicht nur für Wissenschaftler und Ingenieure von Bedeutung, sondern auch für jeden, der sich für die Welt der Chemie und die Rolle dieser Elemente in unserem täglichen Leben interessiert. Insbesondere für Expatriates und Neubürger ist es wichtig, über die potenziellen Gefahren von Radon informiert zu sein und entsprechende Vorsichtsmaßnahmen zu treffen. Radonmessungen sind in vielen Regionen Deutschlands Standard und sollten in Betracht gezogen werden, um die Gesundheit zu schützen.
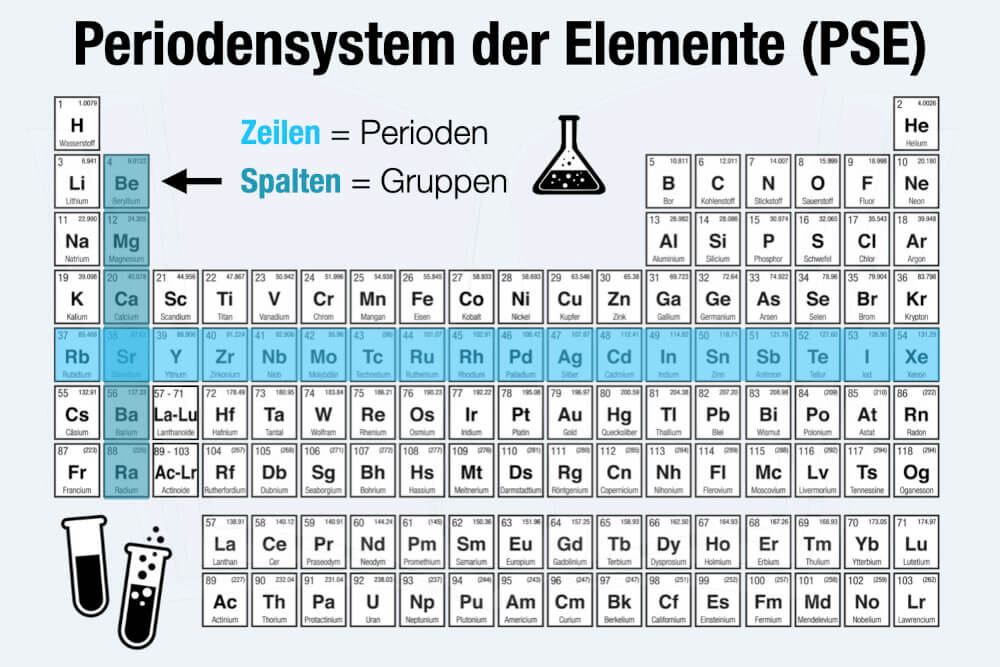


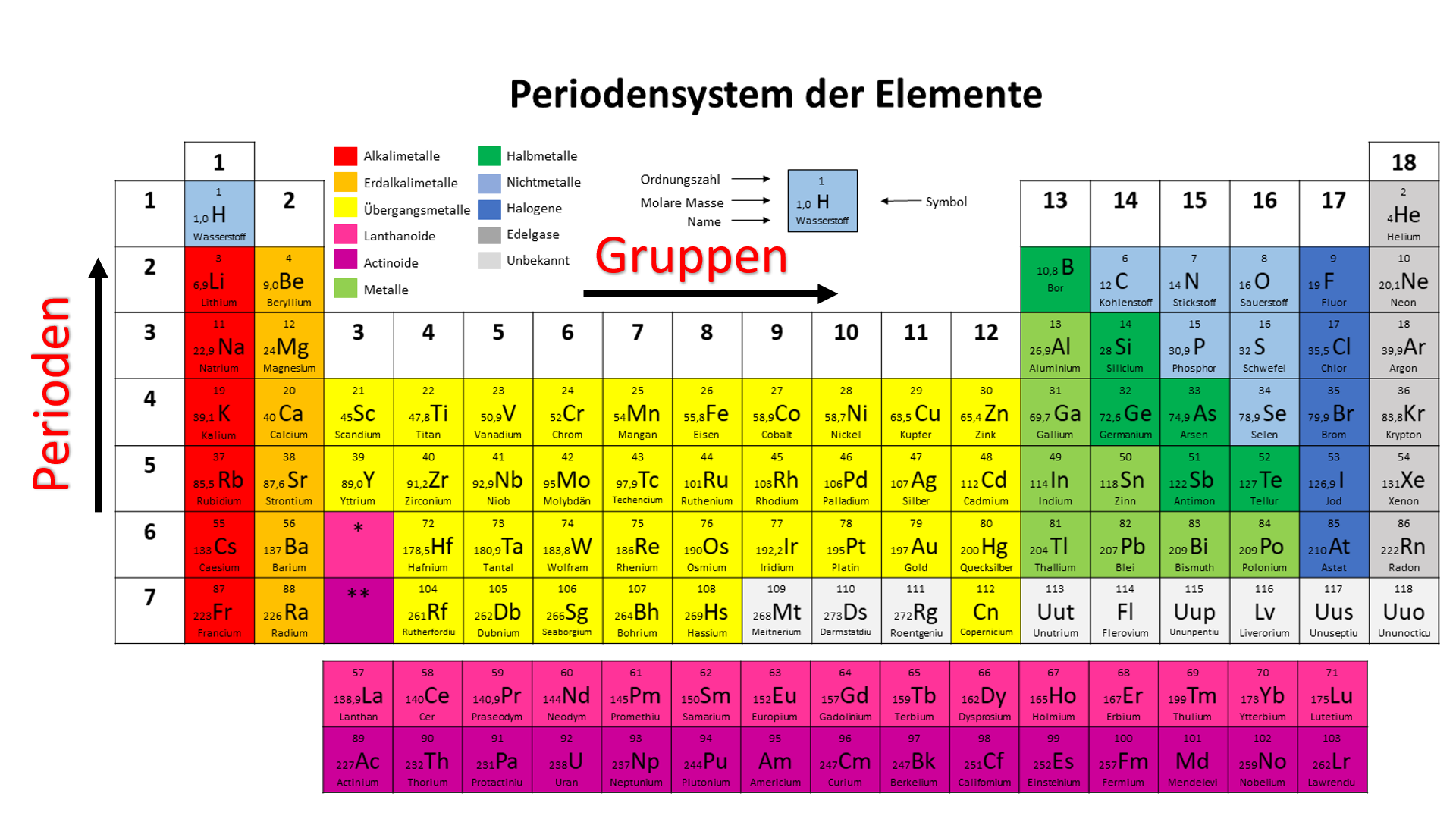
![Chemisches Element Der Achten Hauptgruppe Periodensystem • Übersicht der chemischen Elemente · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/WP-Bild_Gruppen-1-1024x576.jpg)