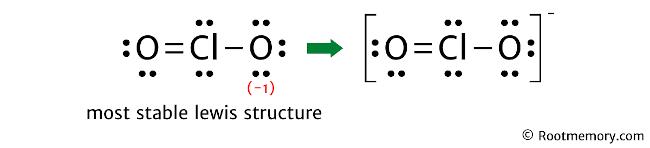
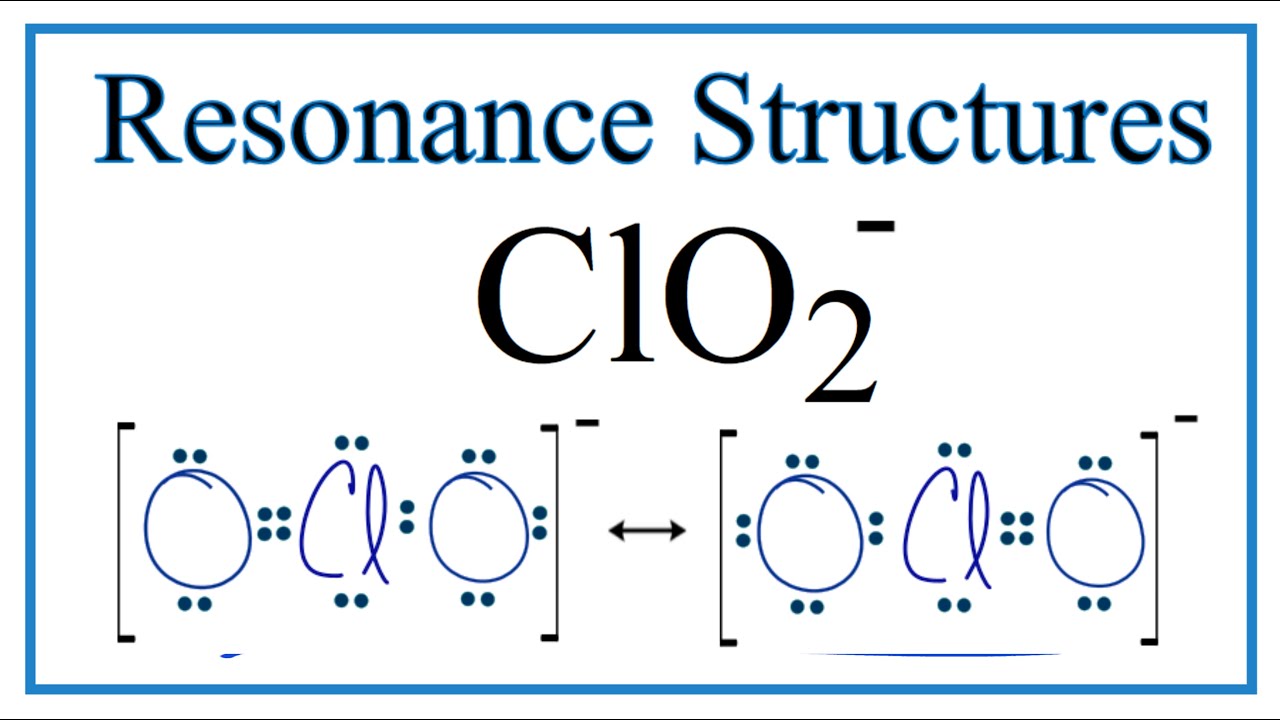
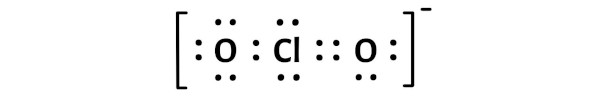
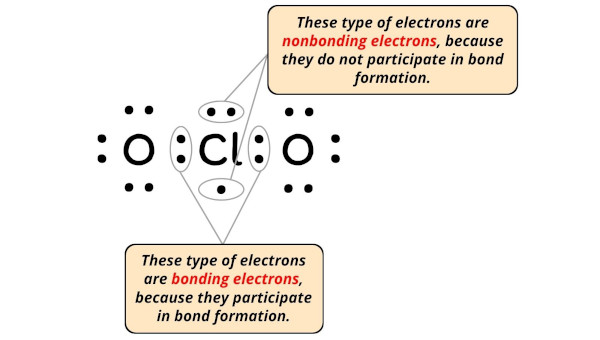
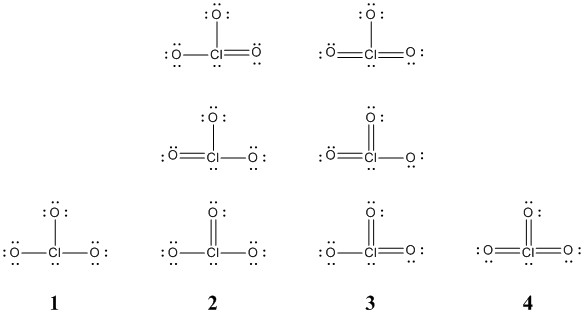
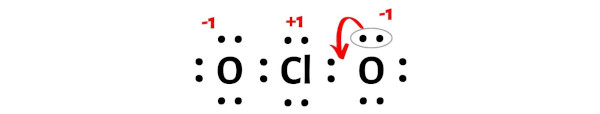
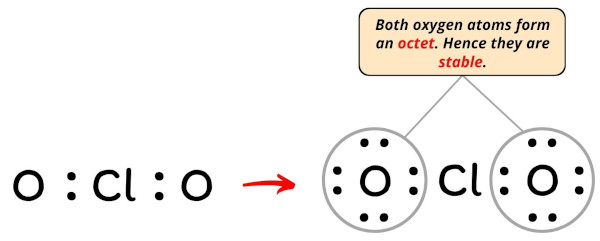
Clo2 Ion Lewis Structure

Hey, hast du jemals von der Lewis-Struktur des ClO2-Ions gehört? Klingt vielleicht erst mal nach einem komplizierten Chemie-Ding, aber glaub mir, es ist faszinierender als es aussieht! Stell dir vor, du spielst mit Legosteinen, aber die Legosteine sind Atome und du versuchst, sie so zusammenzusetzen, dass alles stabil und glücklich ist.
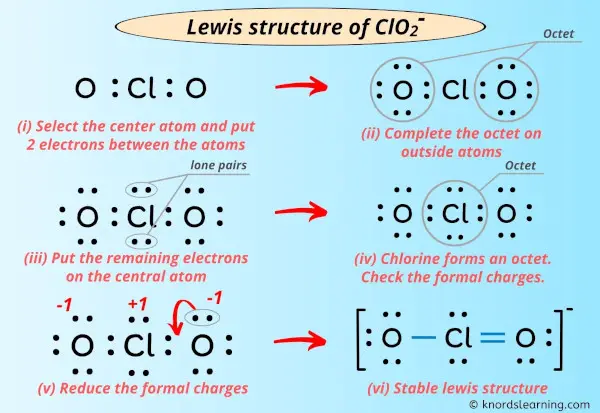
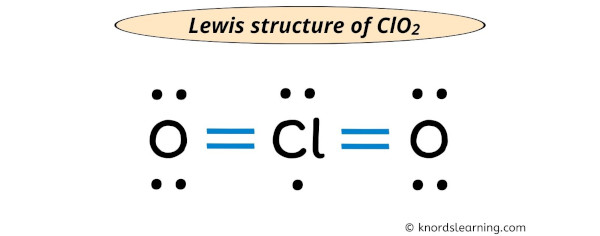
Die Lewis-Struktur ist im Grunde eine Art Bauplan. Sie zeigt, wie die Elektronen – die winzigen Teilchen, die um die Atome herumschwirren – zwischen den Atomen in einem Molekül oder Ion aufgeteilt sind. Und das ClO2-Ion, das ist unser Star heute!
Was macht das ClO2-Ion so besonders? Nun, es ist ein bisschen wie ein chemischer Rebell. Es hält sich nicht immer an die Regeln, und genau das macht es so spannend. Normalerweise streben Atome danach, eine volle "Aussenschale" mit Elektronen zu haben, so wie ein Achterbahnwagen, der alle Sitze besetzt hat. Aber das Chloratom im ClO2-Ion ist ein bisschen... anders.
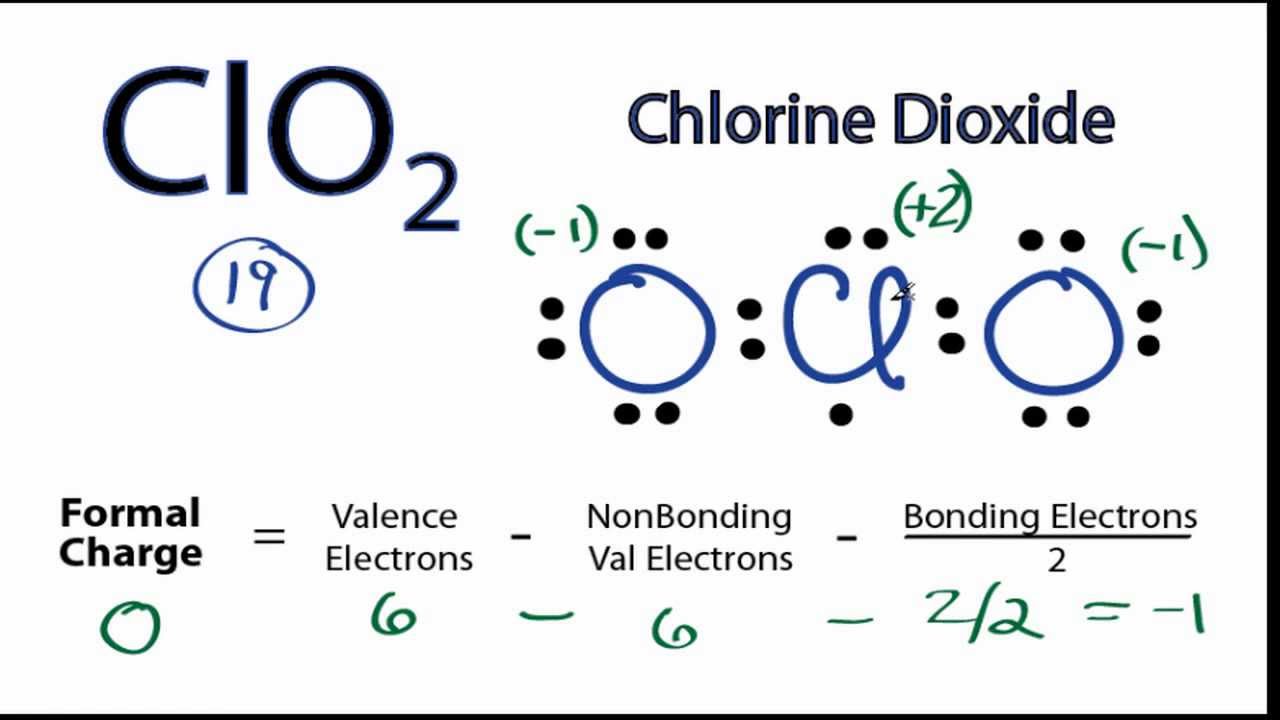
Denk mal drüber nach: Chlor hat sieben Elektronen in seiner Aussenschale. Sauerstoff hat sechs. Und weil es ein Ion ist, hat es noch ein Elektron extra eingesammelt. Das bedeutet, wir haben insgesamt 20 Elektronen, die wir verteilen müssen. Und hier fängt der Spass an!
Die Herausforderung
Die Herausforderung besteht darin, diese 20 Elektronen so um das Chloratom und die beiden Sauerstoffatome anzuordnen, dass alle so stabil wie möglich sind. Aber Achtung! Das Chloratom ist ein bisschen eigenwillig. Es ist okay damit, nicht die volle "Aussenschale" zu haben. Es ist ein bisschen wie der coole Einzelgänger, der nicht unbedingt zur Party dazugehören muss.
Also, wie sieht die Struktur aus?
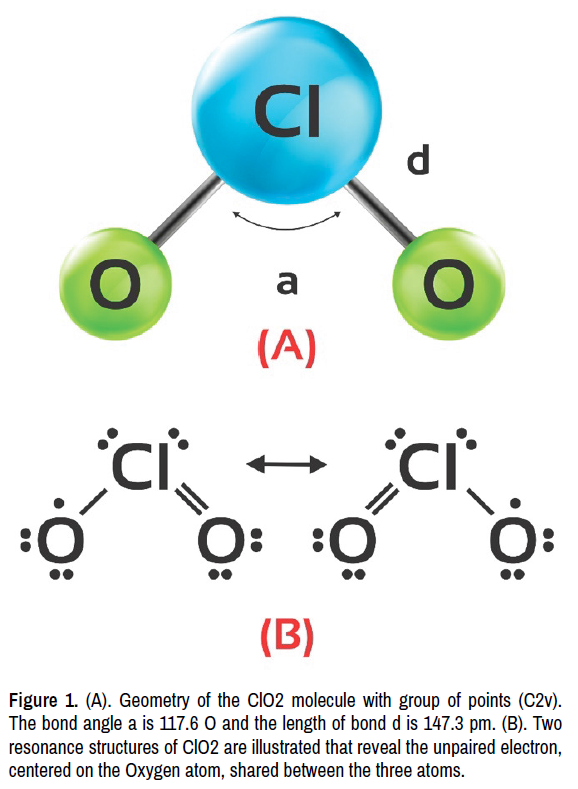
Du könntest denken, dass es einfach ist. Chlor in der Mitte, Sauerstoff auf beiden Seiten, und dann verteilen wir die Elektronen, oder? Aber da gibt es ein kleines Problem: Das Chloratom hat ein ungepaartes Elektron. Das bedeutet, es gibt ein einzelnes Elektron, das keinen Partner hat. Es ist wie ein einsamer Socke in der Wäsche. Und das macht das ClO2-Ion zu einem Radikal.
Was bedeutet das? Nun, Radikale sind in der Regel reaktionsfreudiger. Sie suchen nach anderen Atomen oder Molekülen, mit denen sie reagieren können, um ihr ungepaartes Elektron loszuwerden. Stell dir vor, es ist wie ein einzelner Puzzleteil, das verzweifelt nach seinem passenden Gegenstück sucht.
"Das ClO2-Ion ist ein faszinierendes Beispiel dafür, wie die Natur manchmal die Regeln bricht."
Das ungepaarte Elektron macht das ClO2-Ion auch zu einem starken Oxidationsmittel. Das bedeutet, es kann andere Substanzen dazu bringen, Elektronen zu verlieren. In der Praxis wird es oft als Bleichmittel oder Desinfektionsmittel eingesetzt. Es ist wie der Superheld der Chemie, der Bakterien und Viren bekämpft!
Warum ist das so unterhaltsam?
Weil es uns zeigt, dass die Chemie nicht immer so perfekt und vorhersehbar ist, wie wir denken. Es gibt immer Ausnahmen und Überraschungen. Das ClO2-Ion ist wie ein kleines Rätsel, das uns herausfordert, über den Tellerrand hinauszudenken und die Regeln neu zu interpretieren.
Es ist auch unterhaltsam, weil es uns daran erinnert, dass selbst die kleinsten Dinge – wie die Anordnung von Elektronen – grosse Auswirkungen haben können. Ein einziges ungepaartes Elektron kann den Unterschied zwischen einer stabilen Verbindung und einem reaktionsfreudigen Radikal ausmachen.
Noch ein paar Gedanken
Die Lewis-Struktur des ClO2-Ions ist nicht die einzige Möglichkeit, es darzustellen. Es gibt auch andere Modelle, die die Bindungen und die Elektronenverteilung beschreiben. Aber die Lewis-Struktur ist ein guter Ausgangspunkt, um die Grundlagen zu verstehen. Sie ist wie die Skizze eines Architekten, bevor er mit dem Bau eines Hauses beginnt.
Wenn du dich für Chemie interessierst, lohnt es sich auf jeden Fall, sich näher mit dem ClO2-Ion zu beschäftigen. Es ist ein faszinierendes Beispiel dafür, wie die Natur manchmal die Regeln bricht. Und wer weiss, vielleicht entdeckst du ja selbst noch etwas Neues und Aufregendes daran!
Also, das nächste Mal, wenn du von einem Bleichmittel hörst, denk an das kleine, rebellische ClO2-Ion und seine faszinierende Lewis-Struktur. Es ist mehr als nur eine chemische Formel. Es ist eine Geschichte von Elektronen, Bindungen und einem Atom, das seinen eigenen Weg geht.
Und wer weiss, vielleicht inspiriert dich diese kleine chemische Geschichte ja dazu, selbst ein paar Regeln zu brechen und deinen eigenen Weg zu gehen!