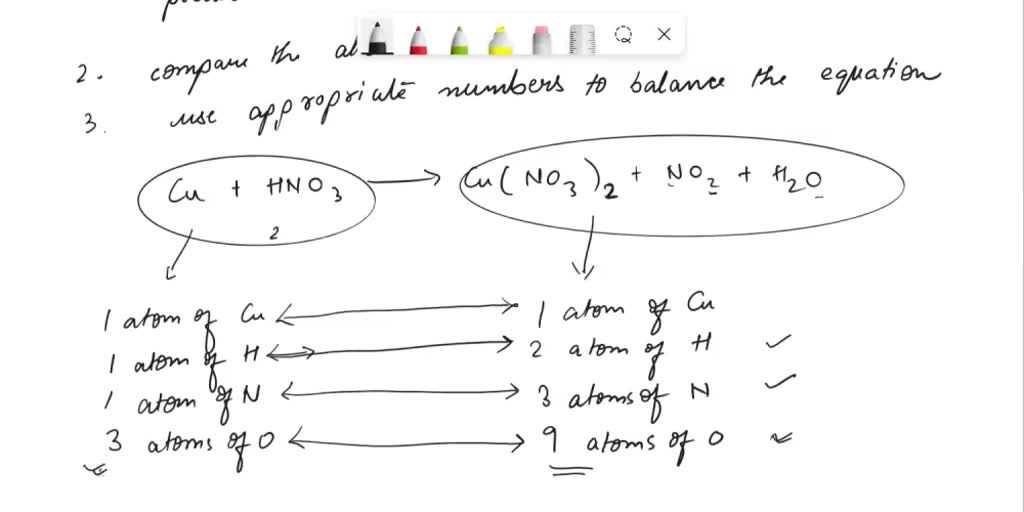
Cu Hno3 Cu No3 2 No H2o

Habt ihr euch jemals gefragt, was passiert, wenn man Kupfer – ja, das Zeug in alten Münzen und manchen Kochtöpfen – mit Salpetersäure zusammenbringt? Keine Sorge, wir werden hier keine Chemie-Show veranstalten, die in einer Katastrophe endet. Stattdessen nehmen wir euch mit auf eine kleine, unterhaltsame Reise in die Welt der chemischen Reaktionen. Es ist ein bisschen wie Kochen, nur mit anderen Zutaten und noch weniger Appetit am Ende… zumindest für die meisten!
Die Zutaten: Kupfer und Salpetersäure
Stellt euch Kupfer vor, vielleicht eine glänzende Kupfermünze oder ein Stück Draht. Robust, rotbräunlich und irgendwie beruhigend. Jetzt kommt Salpetersäure ins Spiel. Das ist kein harmloses Hausmittelchen. Sie ist stark, ätzend und hat eine ganz klare Mission: mit anderen Stoffen reagieren!
Der große Knall… äh, die Reaktion
Wenn diese beiden aufeinandertreffen, passiert etwas! Es ist nicht unbedingt ein lauter Knall, aber es ist definitiv eine Veränderung. Das Kupfer, das eben noch so solide und unbeeindruckt dastand, beginnt sich aufzulösen. Ja, richtig gelesen, es verschwindet! Und was entsteht? Ein grüner oder bläulicher Sud namens Kupfernitrat. Stell dir vor, du mischst blaue und gelbe Farbe – das Ergebnis ist oft ein schönes Grün. So ähnlich ist das hier, nur eben mit Molekülen.
Und das ist noch nicht alles! Bei dieser ganzen Aktion entstehen auch noch Gase. Vor allem Stickstoffmonoxid (NO). Dieses Gas ist farblos, aber wenn es mit der Luft in Berührung kommt, verwandelt es sich in braunes Stickstoffdioxid. Es sieht aus, als würde die Luft um den Versuchsaufbau herum plötzlich husten!
Die unerwarteten Nebeneffekte: Mehr als nur Chemie
Diese Reaktion ist aber mehr als nur eine trockene Formel (Cu + HNO3 -> Cu(NO3)2 + NO + H2O). Sie ist ein kleines Drama, eine Geschichte von Veränderung und Transformation. Das Kupfer gibt seine Form auf, um etwas Neues zu werden. Die Salpetersäure hilft dabei, wie ein Katalysator in einem komplizierten Beziehungsdrama.
Denkt mal darüber nach: Alles um uns herum ist Chemie! Das Essen, das wir essen, die Luft, die wir atmen, die Farben in einem Sonnenuntergang. Alles besteht aus winzigen Teilchen, die sich ständig verbinden, trennen und neu arrangieren. Die Reaktion von Kupfer und Salpetersäure ist nur ein winziger Ausschnitt dieser riesigen, faszinierenden Welt.
Warum ist das überhaupt wichtig?
Vielleicht fragt ihr euch jetzt: „Okay, cool, Kupfer löst sich auf. Aber was bringt mir das im Alltag?“ Nun, die Reaktion von Kupfer mit Salpetersäure wird in vielen Bereichen genutzt. Zum Beispiel in der Herstellung von Düngemitteln. Kupfernitrat ist eine wichtige Komponente, die Pflanzen hilft, gesund und stark zu wachsen. Außerdem wird die Reaktion in Laboren für Experimente und Forschung verwendet. Wissenschaftler können die Reaktion nutzen, um mehr über die Eigenschaften von Kupfer und Salpetersäure zu erfahren, und um neue Materialien und Technologien zu entwickeln.
Es ist ein bisschen wie beim Kochen. Manchmal macht man etwas nur zum Spaß, um neue Geschmacksrichtungen zu entdecken. Und manchmal entdeckt man dabei etwas, das man in einem wichtigen Gericht verwenden kann. So ist es auch in der Chemie!
Die Moral von der Geschicht
Die Geschichte von Kupfer und Salpetersäure zeigt uns, dass selbst scheinbar einfache Dinge voller Überraschungen stecken können. Dass Veränderung unausweichlich ist und dass selbst aus einer vermeintlich „ätzenden“ Begegnung etwas Neues und Nützliches entstehen kann. Und vielleicht, nur vielleicht, dass Chemie doch gar nicht so langweilig ist, wie man immer dachte.
Also, das nächste Mal, wenn ihr eine alte Kupfermünze in die Hand nehmt, denkt daran, was passieren könnte, wenn sie auf die richtige Säure trifft. Und wer weiß, vielleicht inspiriert euch das ja zu einem neuen Hobby: Chemie-Experimente in der heimischen Küche (aber bitte nur mit professioneller Aufsicht!).
Und zum Schluss: Vergesst nie die Sicherheit! Salpetersäure ist kein Spielzeug und sollte niemals ohne Schutzkleidung und unter Aufsicht verwendet werden. Sonst wird aus dem spannenden Experiment schnell ein unangenehmer Krankenhausaufenthalt.
In diesem Sinne: Frohes Experimentieren (aber bitte sicher!) und bis zum nächsten Mal, wenn wir uns in die faszinierende Welt der Chemie stürzen!







2+%2B+NO2+%2B+H2O+Assign+Oxidation+Numbers.jpg)


2+%2B+NO+%2B+H2O+Oxida.jpg)