Definition Van Der Waals Kräfte
Wenn Sie neu in Deutschland sind oder sich mit Naturwissenschaften beschäftigen, stoßen Sie möglicherweise auf den Begriff "Van-der-Waals-Kräfte". Diese Kräfte sind allgegenwärtig und spielen eine entscheidende Rolle in vielen physikalischen, chemischen und biologischen Prozessen. Dieser Artikel soll Ihnen eine klare und verständliche Erklärung dieser Kräfte geben.
Was sind Van-der-Waals-Kräfte?
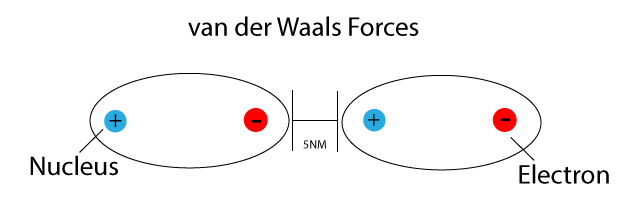
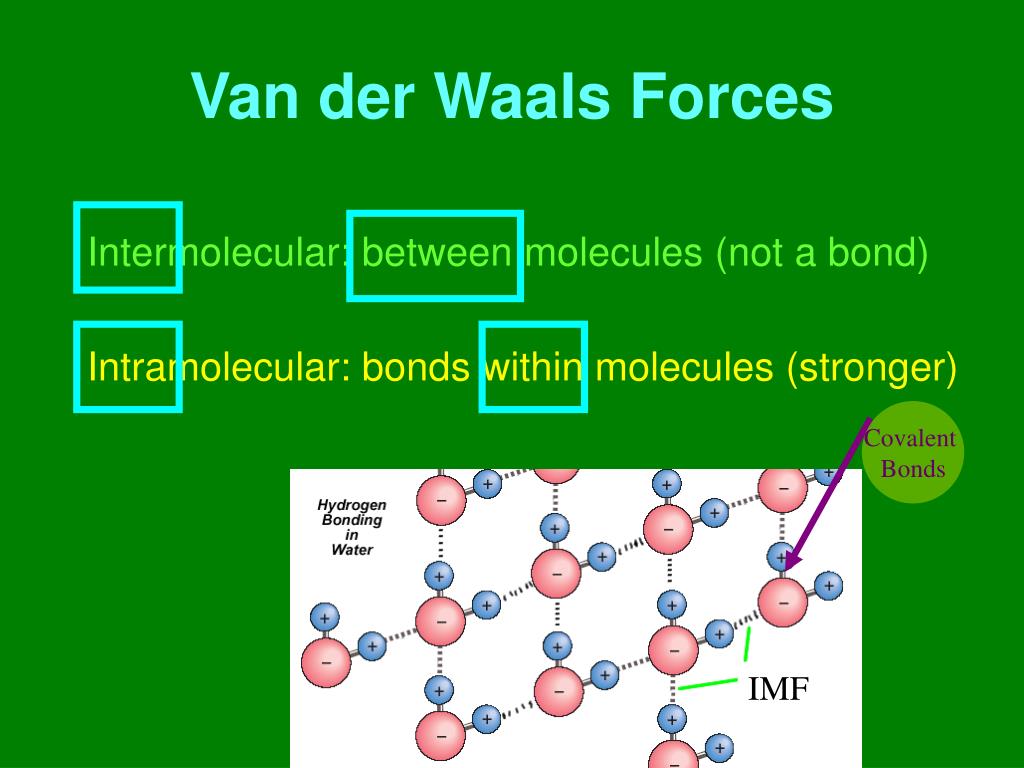
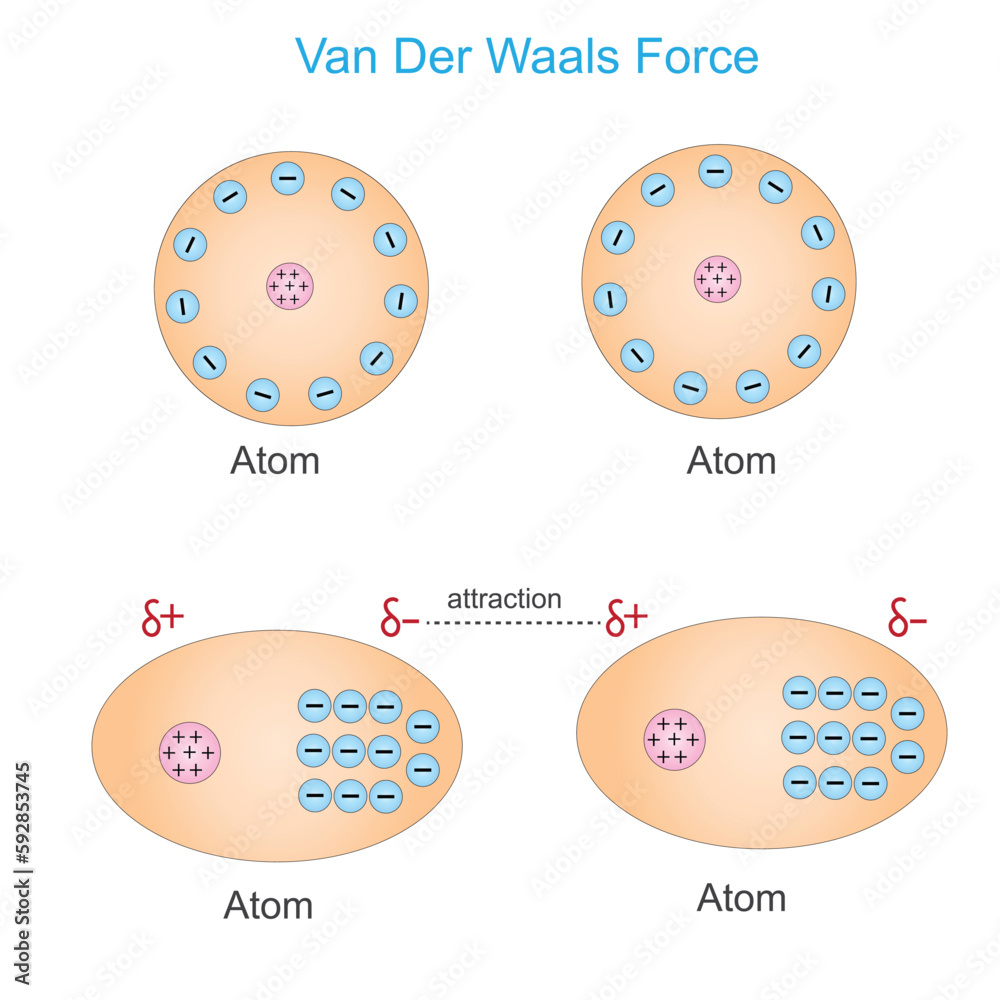
Van-der-Waals-Kräfte sind schwache, intermolekulare Kräfte, die zwischen Atomen oder Molekülen wirken. Im Gegensatz zu starken chemischen Bindungen wie kovalenten oder ionischen Bindungen, die Atome innerhalb eines Moleküls zusammenhalten, wirken Van-der-Waals-Kräfte zwischen verschiedenen Molekülen oder zwischen verschiedenen Teilen desselben großen Moleküls. Sie sind nach dem niederländischen Physiker Johannes Diderik van der Waals benannt, der sie im späten 19. Jahrhundert beschrieb.
Es ist wichtig zu verstehen, dass diese Kräfte immer vorhanden sind, selbst zwischen unpolaren Molekülen. Ihre Stärke variiert jedoch stark, abhängig von der Größe und Form der Moleküle sowie der Art der Wechselwirkung.
Die verschiedenen Arten von Van-der-Waals-Kräften
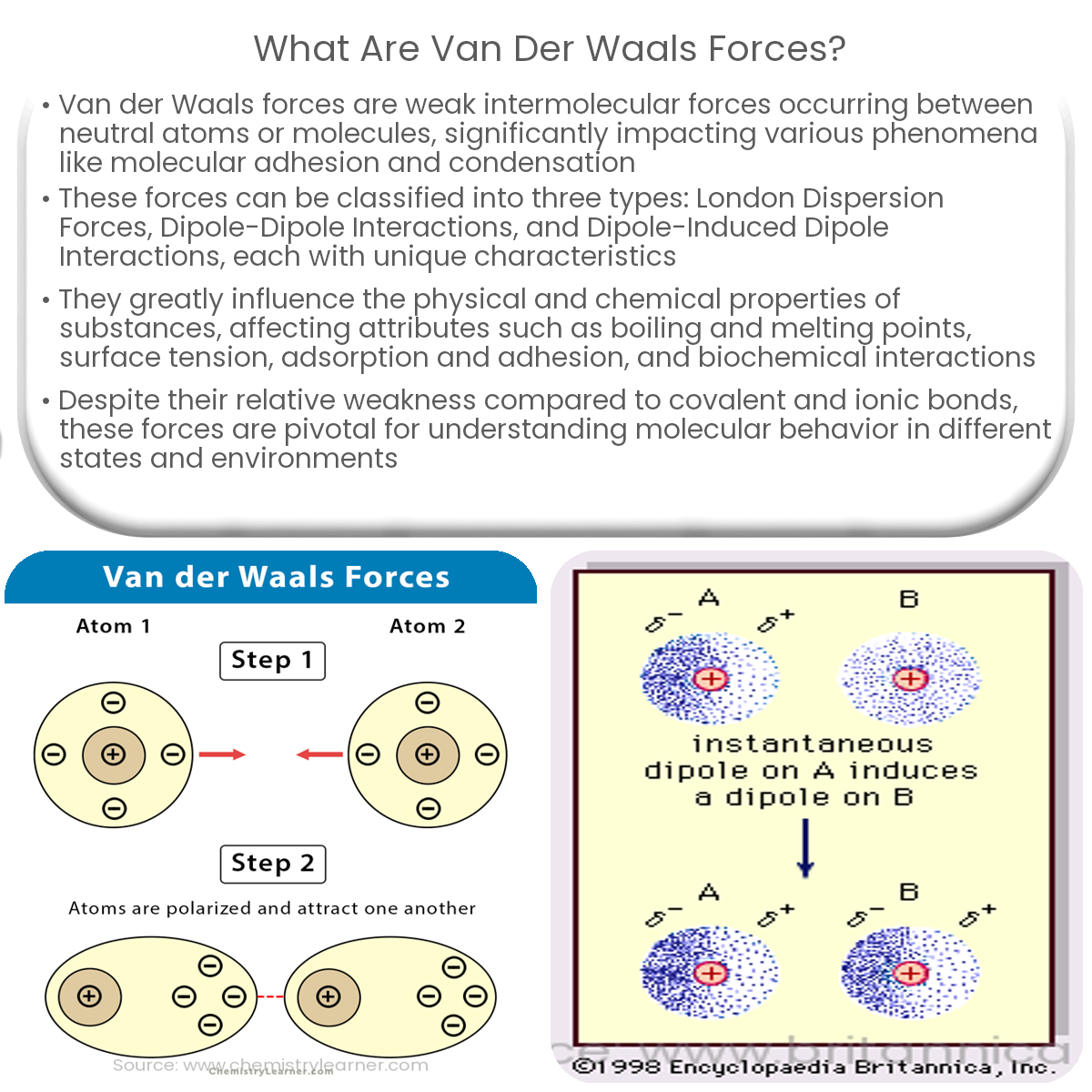
Es gibt drei Haupttypen von Van-der-Waals-Kräften, die sich in ihrem Ursprung und ihrer Stärke unterscheiden:
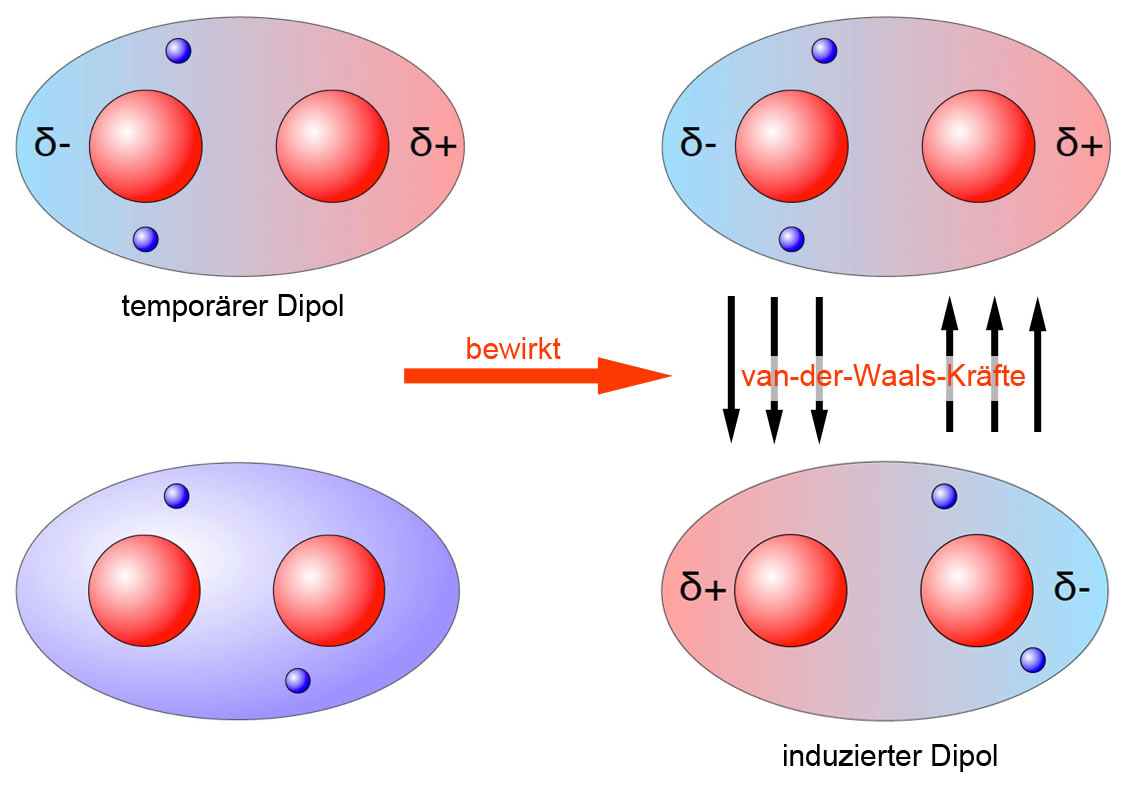
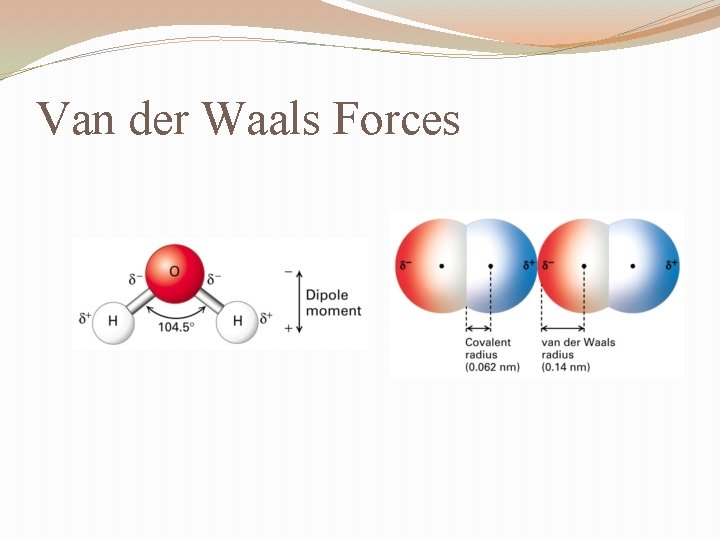
- Dipol-Dipol-Wechselwirkungen: Diese Kräfte treten zwischen polaren Molekülen auf. Ein polares Molekül hat eine ungleichmäßige Verteilung der elektronischen Ladung, was zu einem positiven (δ+) und einem negativen (δ-) Ende führt. Diese partiellen Ladungen ziehen sich zwischen benachbarten Molekülen an – das positive Ende des einen Moleküls wird vom negativen Ende des anderen Moleküls angezogen. Die Stärke dieser Wechselwirkung hängt von der Größe der Dipolmomente ab.
- Dipol-induzierte Dipol-Wechselwirkungen: Diese Wechselwirkungen treten auf, wenn ein polares Molekül ein temporäres Dipolmoment in einem unpolaren Molekül induziert. Das polare Molekül verzerrt die Elektronenwolke des unpolaren Moleküls, wodurch eine temporäre, schwache Ladungstrennung entsteht. Diese induzierte Ladung erzeugt dann eine Anziehung zwischen den beiden Molekülen. Diese Art der Wechselwirkung ist in der Regel schwächer als die Dipol-Dipol-Wechselwirkung.
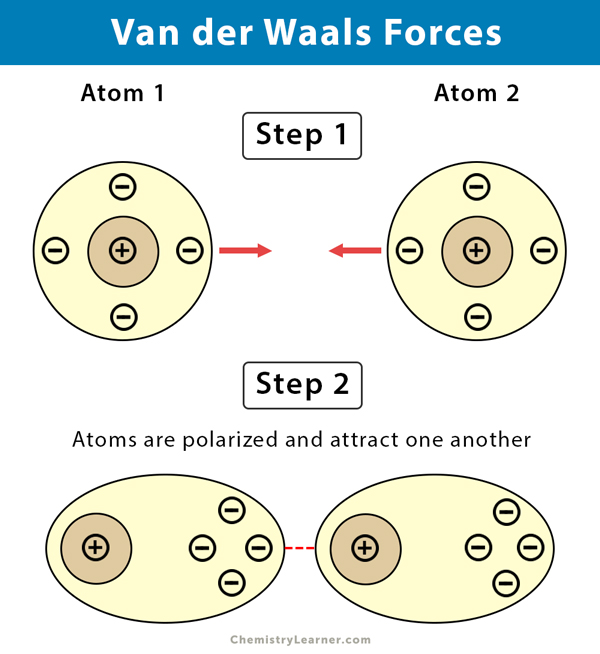
- London-Dispersionskräfte (auch als induzierte Dipol-induzierte Dipol-Wechselwirkungen oder kurz Dispersionskräfte bezeichnet): Dies sind die allgegenwärtigsten und schwächsten aller Van-der-Waals-Kräfte. Sie treten zwischen allen Atomen und Molekülen auf, sowohl polaren als auch unpolaren. Auch in unpolaren Molekülen können durch zufällige Fluktuationen der Elektronenverteilung momentane, temporäre Dipole entstehen. Diese momentanen Dipole induzieren dann Dipole in benachbarten Molekülen, was zu einer schwachen Anziehung führt. Die Stärke der London-Dispersionskräfte hängt von der Polarisierbarkeit des Moleküls ab, d.h. wie leicht sich seine Elektronenwolke verzerren lässt. Größere Moleküle mit mehr Elektronen sind in der Regel besser polarisierbar und weisen daher stärkere London-Dispersionskräfte auf.
Wie beeinflussen Van-der-Waals-Kräfte Stoffeigenschaften?
Obwohl Van-der-Waals-Kräfte relativ schwach sind, haben sie einen signifikanten Einfluss auf die physikalischen Eigenschaften von Stoffen, insbesondere auf:
- Siedepunkte und Schmelzpunkte: Je stärker die intermolekularen Kräfte, desto mehr Energie wird benötigt, um die Moleküle voneinander zu trennen und einen Phasenübergang (z.B. vom flüssigen zum gasförmigen Zustand) zu erreichen. Stoffe mit starken Van-der-Waals-Kräften haben daher tendenziell höhere Siedepunkte und Schmelzpunkte. Beispielsweise haben Alkane mit längeren Kohlenstoffketten höhere Siedepunkte als Alkane mit kürzeren Ketten, da die London-Dispersionskräfte mit zunehmender Kettenlänge zunehmen.
- Viskosität: Die Viskosität einer Flüssigkeit wird durch die Stärke der intermolekularen Kräfte beeinflusst. Flüssigkeiten mit starken Van-der-Waals-Kräften sind viskoser, da die Moleküle stärker aneinander haften und sich schwerer bewegen lassen.
- Oberflächenspannung: Die Oberflächenspannung einer Flüssigkeit wird ebenfalls durch intermolekulare Kräfte bestimmt. Moleküle an der Oberfläche einer Flüssigkeit erfahren eine Nettoanziehung ins Innere der Flüssigkeit, was zu einer Spannung an der Oberfläche führt. Flüssigkeiten mit starken Van-der-Waals-Kräften haben eine höhere Oberflächenspannung.
- Adhäsion und Kohäsion: Adhäsion bezieht sich auf die Anziehung zwischen ungleichen Molekülen (z.B. zwischen Wasser und Glas), während Kohäsion sich auf die Anziehung zwischen gleichen Molekülen bezieht (z.B. zwischen Wassermolekülen). Van-der-Waals-Kräfte tragen sowohl zur Adhäsion als auch zur Kohäsion bei. Die Fähigkeit von Gecko-Füßen, an glatten Oberflächen zu haften, ist beispielsweise auf Van-der-Waals-Kräfte zwischen den winzigen Härchen an ihren Füßen und der Oberfläche zurückzuführen.
- Löslichkeit: "Ähnliches löst Ähnliches" ist ein Grundprinzip der Löslichkeit. Polare Stoffe lösen sich in der Regel gut in polaren Lösungsmitteln, während unpolare Stoffe sich gut in unpolaren Lösungsmitteln lösen. Dies liegt daran, dass die intermolekularen Kräfte zwischen den Stoffen und dem Lösungsmittel ähnlich sein müssen, damit eine effektive Mischung stattfinden kann.
Bedeutung in Biologie und Chemie
Van-der-Waals-Kräfte sind in vielen biologischen und chemischen Prozessen von entscheidender Bedeutung. Einige Beispiele sind:
- Proteinfaltung: Die komplexe dreidimensionale Struktur von Proteinen wird maßgeblich durch Van-der-Waals-Kräfte zwischen verschiedenen Aminosäureresten bestimmt. Diese Kräfte tragen dazu bei, dass das Protein in seine funktionelle Form gefaltet wird.
- DNA-Struktur: Van-der-Waals-Kräfte spielen eine Rolle bei der Stabilisierung der Doppelhelixstruktur der DNA. Die Basenpaare Adenin-Thymin und Guanin-Cytosin werden durch Wasserstoffbrückenbindungen verbunden, aber Van-der-Waals-Kräfte zwischen den gestapelten Basen tragen ebenfalls zur Stabilität der Struktur bei.
- Enzym-Substrat-Wechselwirkungen: Enzyme binden an ihre Substrate durch eine Kombination von Kräften, einschließlich Van-der-Waals-Kräften. Diese Kräfte tragen dazu bei, dass das Substrat in die aktive Stelle des Enzyms passt und die Reaktion katalysiert wird.
- Membranbildung: Die Lipiddoppelschicht, die die Zellmembran bildet, wird durch hydrophobe Wechselwirkungen und Van-der-Waals-Kräfte zwischen den Lipidmolekülen zusammengehalten.
- Medikamentenentwicklung: Bei der Entwicklung neuer Medikamente werden die Van-der-Waals-Kräfte zwischen dem Medikament und seinem Zielmolekül (z.B. ein Enzym oder ein Rezeptor) berücksichtigt. Ein Medikament muss in der Lage sein, stark genug an sein Zielmolekül zu binden, um eine therapeutische Wirkung zu erzielen.
Zusammenfassung
Van-der-Waals-Kräfte sind schwache, aber allgegenwärtige intermolekulare Kräfte, die einen wesentlichen Einfluss auf die physikalischen Eigenschaften von Stoffen und die Funktionalität biologischer Systeme haben. Sie lassen sich in Dipol-Dipol-Wechselwirkungen, Dipol-induzierte Dipol-Wechselwirkungen und London-Dispersionskräfte unterteilen. Das Verständnis dieser Kräfte ist entscheidend für viele Bereiche der Wissenschaft, von der Materialwissenschaft bis zur Biologie. Obwohl sie auf atomarer Ebene subtil sind, sind ihre Auswirkungen in der makroskopischen Welt deutlich sichtbar.
Kurz gesagt: Van-der-Waals-Kräfte sind die "Klebstoffe" zwischen Molekülen, die bestimmen, ob etwas fest, flüssig oder gasförmig ist und wie es sich verhält.
Denken Sie daran: Auch wenn die Kräfte schwach erscheinen, ihre kumulative Wirkung ist enorm wichtig!


![Definition Van Der Waals Kräfte Van-der-Waals-Kräfte · Entstehung & Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/08/Van-der-Waals-Kräfte_1-1-1024x576.jpg)