Energie Bei Chemischen Reaktionen Arbeitsblatt Lösungen
Willkommen, liebe Entdecker und Wissensdurstige! Vielleicht bist du gerade in Deutschland, planst einen Besuch oder interessierst dich einfach für die faszinierende Welt der Chemie. Keine Sorge, du musst kein Chemiker sein, um zu verstehen, worum es bei "Energie bei chemischen Reaktionen" geht. Stell dir vor, du bist ein Koch, der Zutaten mischt, um ein köstliches Gericht zuzubereiten. Genau wie beim Kochen spielt Energie eine entscheidende Rolle bei chemischen Reaktionen. Und genau wie beim Kochen kann man mit dem richtigen "Rezept" (in diesem Fall: dem Verständnis der Grundlagen) ein großartiges Ergebnis erzielen.
Was sind chemische Reaktionen überhaupt?
Denk an alltägliche Dinge: Das Rosten von Eisen, das Verbrennen von Holz im Kamin, das Backen eines Kuchens – all das sind chemische Reaktionen. Im Grunde genommen sind es Prozesse, bei denen sich Atome und Moleküle neu anordnen. Einige Verbindungen werden aufgebrochen, andere entstehen neu. Dabei wird Energie entweder freigesetzt oder benötigt.
Die Hauptdarsteller: Edukte und Produkte
Jede chemische Reaktion hat zwei Hauptakteure: die Edukte (auch Reaktanten genannt) und die Produkte. Die Edukte sind die Ausgangsstoffe, die du "zusammenmischt". Die Produkte sind das, was am Ende der Reaktion herauskommt. Stell dir vor, du mischst Mehl, Eier und Zucker (Edukte), um einen Kuchen zu backen (Produkt).
Energie: Der Treibstoff chemischer Reaktionen
Hier wird es interessant! Energie ist der Schlüssel zu jeder chemischen Reaktion. Sie bestimmt, ob eine Reaktion überhaupt stattfindet und wie schnell sie abläuft. Es gibt zwei Hauptarten von Reaktionen in Bezug auf Energie:
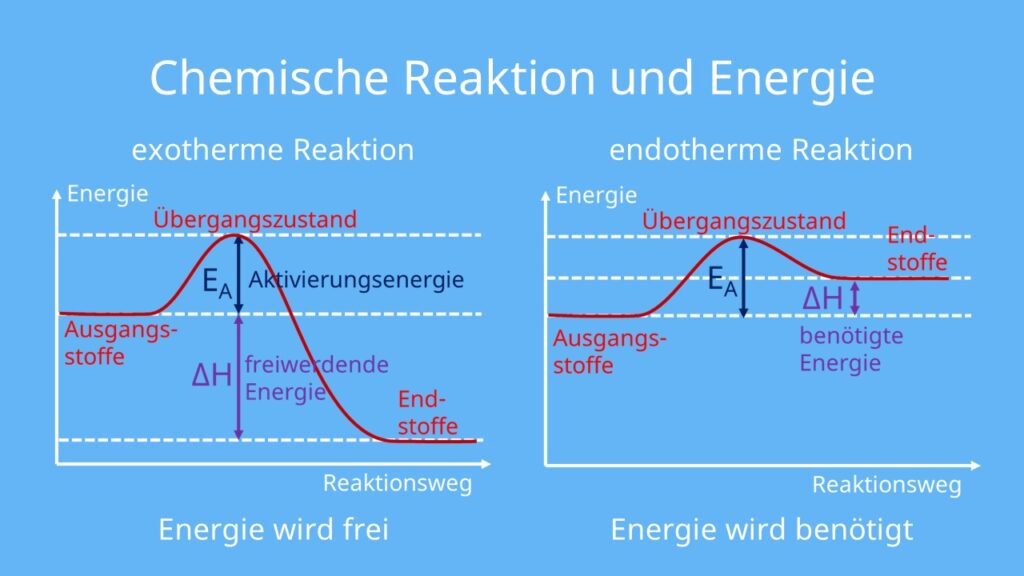
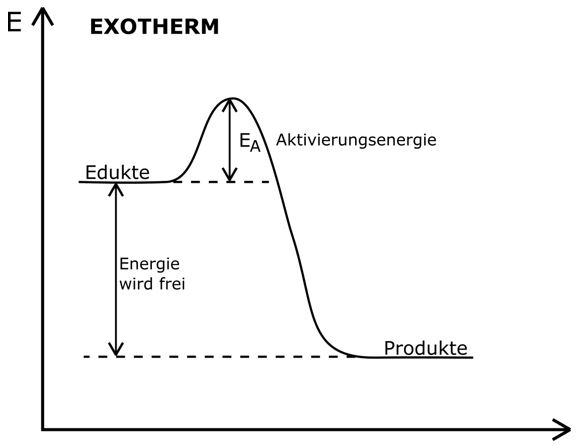
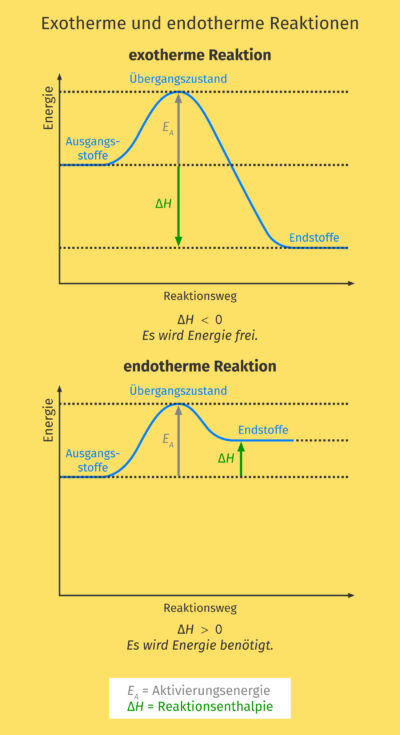
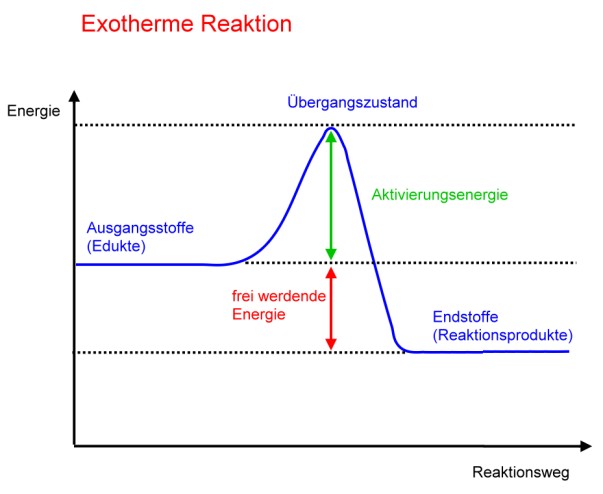
Exotherme Reaktionen: Energie frei!
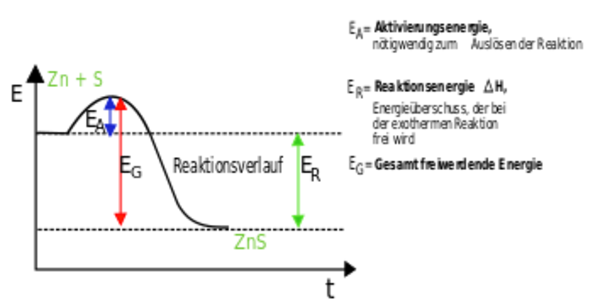
Exotherme Reaktionen sind wie kleine Kraftwerke. Sie setzen Energie in Form von Wärme oder Licht frei. Denk an das Verbrennen von Holz. Du zündest das Holz an (gibst also etwas Startenergie), und dann verbrennt es von selbst und gibt Wärme und Licht ab. Die Energie der Produkte ist geringer als die Energie der Edukte. Die "überschüssige" Energie wird freigesetzt.
Ein klassisches Beispiel für eine exotherme Reaktion ist die Verbrennung von Methan (Erdgas): CH4 + 2O2 → CO2 + 2H2O + Energie
Endotherme Reaktionen: Energie rein!
Endotherme Reaktionen sind das Gegenteil. Sie benötigen ständig Energie, um abzulaufen. Denk an das Schmelzen von Eis. Du musst ständig Wärme zuführen, damit das Eis schmilzt. Wenn du die Wärmezufuhr stoppst, stoppt auch das Schmelzen. Die Energie der Produkte ist höher als die Energie der Edukte. Die "fehlende" Energie muss zugeführt werden.
Ein Beispiel für eine endotherme Reaktion ist die Photosynthese: 6CO2 + 6H2O + Energie → C6H12O6 + 6O2 Pflanzen benötigen Sonnenenergie, um Kohlendioxid und Wasser in Zucker und Sauerstoff umzuwandeln.
Aktivierungsenergie: Der Zündfunke
Selbst exotherme Reaktionen, die eigentlich von selbst ablaufen sollten, benötigen oft einen kleinen "Schubs", die sogenannte Aktivierungsenergie. Stell dir vor, du stehst vor einem Hügel. Du musst zuerst ein Stück hochgehen (Aktivierungsenergie), bevor du dann mühelos herunterrollen kannst (die eigentliche Reaktion). Der Zündfunke, der ein Feuer entfacht, ist ein gutes Beispiel für Aktivierungsenergie.
Wie beeinflusst die Energie chemische Reaktionen?
Die Energiemenge, die bei einer Reaktion freigesetzt oder benötigt wird, beeinflusst verschiedene Aspekte der Reaktion:
- Reaktionsgeschwindigkeit: Im Allgemeinen laufen Reaktionen bei höheren Temperaturen schneller ab. Eine höhere Temperatur bedeutet, dass die Moleküle mehr Energie haben und sich häufiger und heftiger zusammenstoßen, was die Wahrscheinlichkeit erhöht, dass sie reagieren.
- Gleichgewichtslage: Bei reversiblen Reaktionen (Reaktionen, die in beide Richtungen ablaufen können) bestimmt die Energie, in welche Richtung das Gleichgewicht verschoben wird. Exotherme Reaktionen werden durch niedrige Temperaturen begünstigt, während endotherme Reaktionen durch hohe Temperaturen begünstigt werden.
- Reaktionsausbeute: Die Energie kann beeinflussen, wie viel Produkt am Ende einer Reaktion entsteht. Unter bestimmten Bedingungen kann die Bildung bestimmter Nebenprodukte begünstigt werden, was die Ausbeute des gewünschten Produkts verringert.
Chemisches Gleichgewicht: Ein Tanz der Reaktionen
Viele chemische Reaktionen sind reversibel, das heißt, sie können in beide Richtungen ablaufen. Das bedeutet, dass die Edukte nicht vollständig in Produkte umgewandelt werden, sondern ein chemisches Gleichgewicht entsteht. Stell dir vor, du spielst Tauziehen. Wenn beide Seiten gleich stark ziehen, bewegt sich das Seil nicht. Genauso ist es beim chemischen Gleichgewicht: Die Hin- und Rückreaktion laufen gleich schnell ab.
Das Gleichgewicht kann jedoch durch verschiedene Faktoren beeinflusst werden, darunter:
- Temperatur: Wie bereits erwähnt, begünstigen höhere Temperaturen endotherme Reaktionen, während niedrigere Temperaturen exotherme Reaktionen begünstigen.
- Druck: Bei Reaktionen, bei denen sich die Anzahl der Gasteilchen ändert, kann der Druck das Gleichgewicht beeinflussen.
- Konzentration: Die Erhöhung der Konzentration der Edukte verschiebt das Gleichgewicht auf die Seite der Produkte, und umgekehrt.
Beispiele aus dem Alltag: Energie überall!
Energie bei chemischen Reaktionen begegnet uns überall im Alltag:
- Kochen: Das Erhitzen von Speisen ist eine endotherme Reaktion, die notwendig ist, um die Moleküle in den Lebensmitteln zu verändern und sie genießbar zu machen.
- Verbrennungsmotoren: In Verbrennungsmotoren wird Kraftstoff verbrannt (eine exotherme Reaktion), um Energie freizusetzen, die das Auto antreibt.
- Batterien: Batterien nutzen chemische Reaktionen, um elektrische Energie zu erzeugen.
- Atmung: Unsere Zellen nutzen die Verbrennung von Glukose (eine exotherme Reaktion), um Energie für unsere Lebensfunktionen zu gewinnen.
- Rosten: Das Rosten von Eisen ist eine exotherme Reaktion, die jedoch sehr langsam abläuft.
Arbeitsblatt Lösungen: Übung macht den Meister
Nach all der Theorie möchtest du vielleicht dein Wissen testen. Es gibt viele Online-Ressourcen und Arbeitsblätter, die dir dabei helfen können, das Konzept der Energie bei chemischen Reaktionen zu verstehen. Oft findest du auch Lösungen zu diesen Arbeitsblättern. Diese Lösungen sind wertvoll, um deine Antworten zu überprüfen und zu verstehen, wo du möglicherweise Fehler gemacht hast. Suche einfach nach "Energie bei chemischen Reaktionen Arbeitsblatt Lösungen" in deiner bevorzugten Suchmaschine.
Einige häufige Aufgaben in solchen Arbeitsblättern sind:
- Die Bestimmung, ob eine Reaktion exotherm oder endotherm ist (basierend auf der Energiebilanz).
- Das Zeichnen von Energiediagrammen für Reaktionen.
- Die Berechnung der Aktivierungsenergie.
- Die Vorhersage, wie sich Änderungen der Temperatur, des Drucks oder der Konzentration auf das chemische Gleichgewicht auswirken.
Fazit: Chemie ist überall!
Die Welt der Chemie ist faszinierend und allgegenwärtig. Egal, ob du ein Tourist bist, der Deutschland erkundet, ein Expat, der sich hier niedergelassen hat, oder einfach nur jemand, der sein Wissen erweitern möchte, das Verständnis der Grundlagen der Energie bei chemischen Reaktionen kann dir helfen, die Welt um dich herum besser zu verstehen. Also, wage dich in die Welt der Moleküle und Atome und entdecke die Energie, die alles antreibt!
Wir hoffen, dieser kleine Ausflug in die Welt der Chemie war informativ und unterhaltsam. Viel Spaß beim Entdecken!







![Energie Bei Chemischen Reaktionen Arbeitsblatt Lösungen Exotherme Reaktion • Merkmale, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/04/WP_Exotherme-Reaktion_Energiediagramm-exotherme-Reaktion-3-1024x576.jpg)



