Erkläre Den Schalenaufbau Der Atomhülle An Einem Beispiel
Stell dir vor, du stehst vor dem Kölner Dom. Ein beeindruckendes Bauwerk, oder? Aber was, wenn ich dir sage, dass auch die winzigsten Dinge, die wir nicht mit bloßem Auge sehen können – Atome – eine ähnlich faszinierende Struktur haben? Heute nehmen wir dich mit auf eine Reise in die Welt der Atome, genauer gesagt, zur Atomhülle. Und keine Angst, das wird keine staubtrockene Chemie-Vorlesung, sondern eher eine spannende Entdeckungstour!
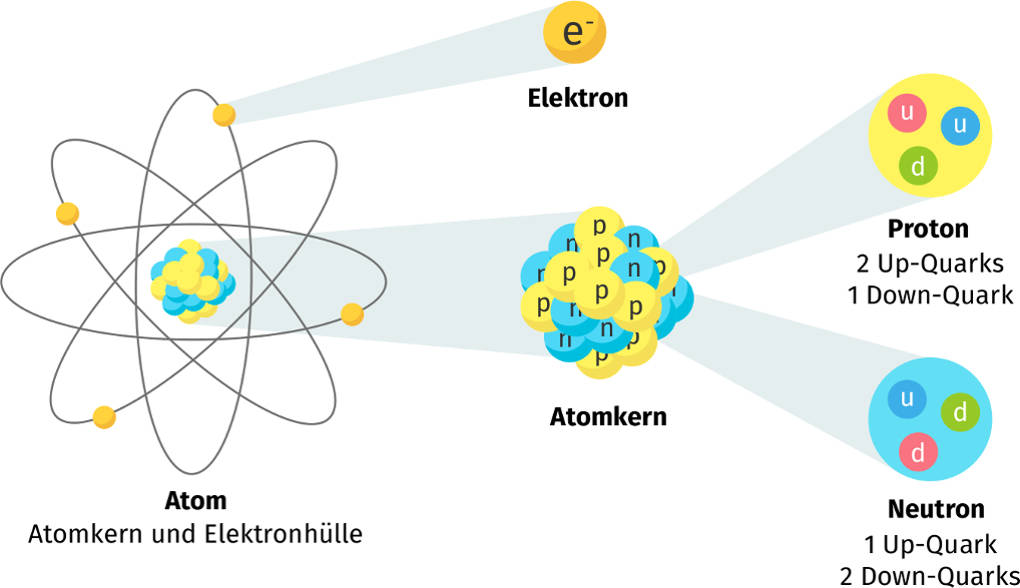
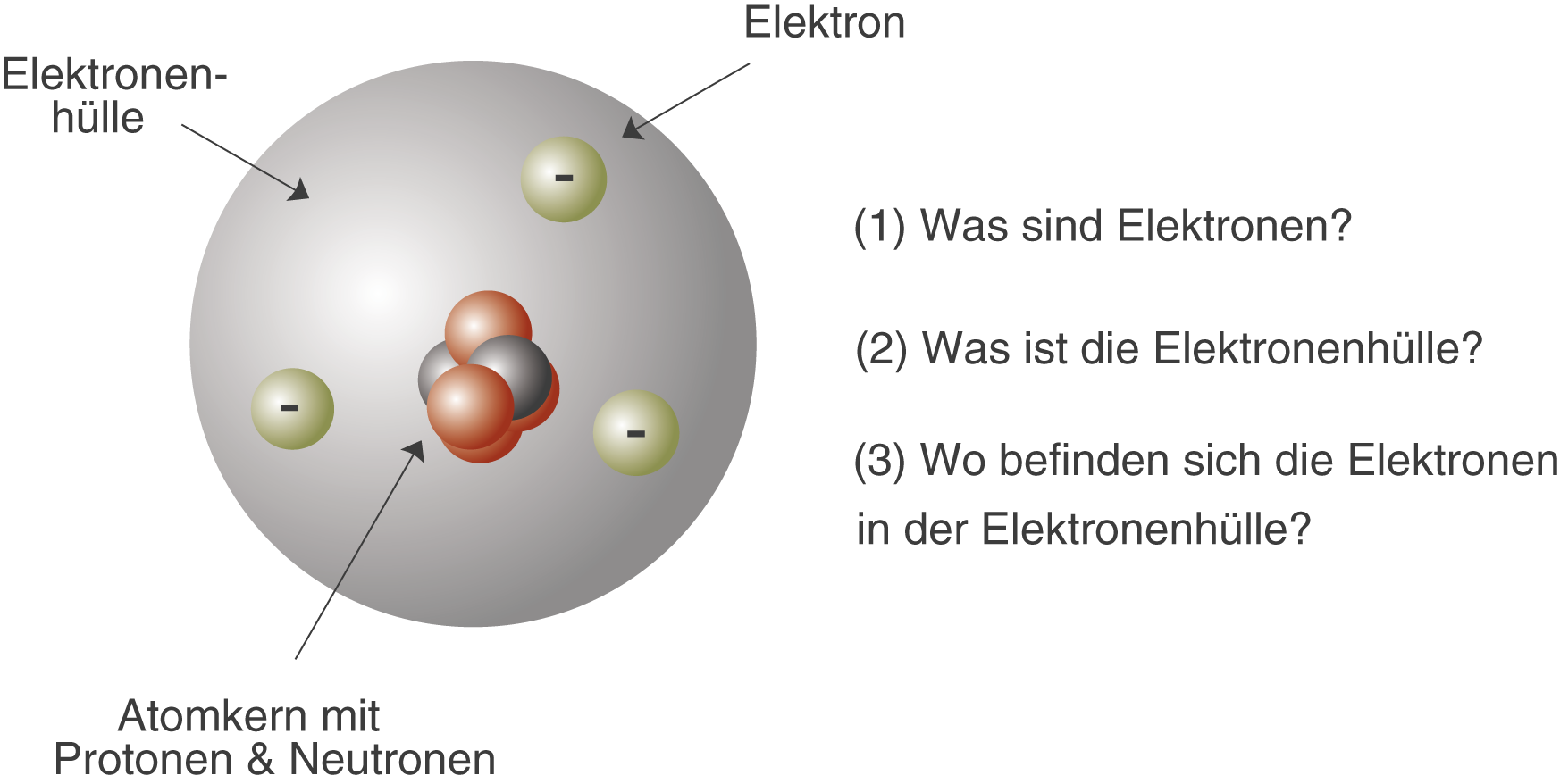
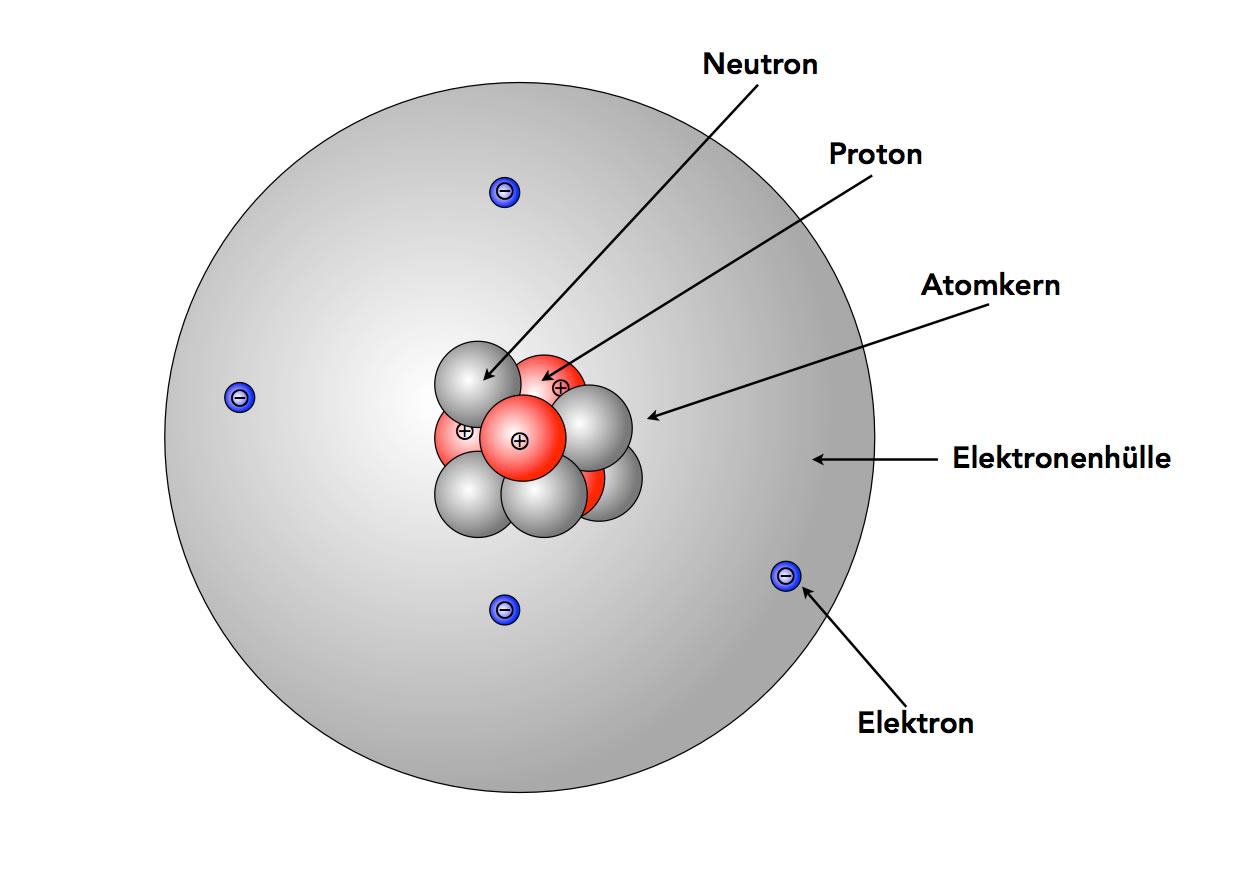
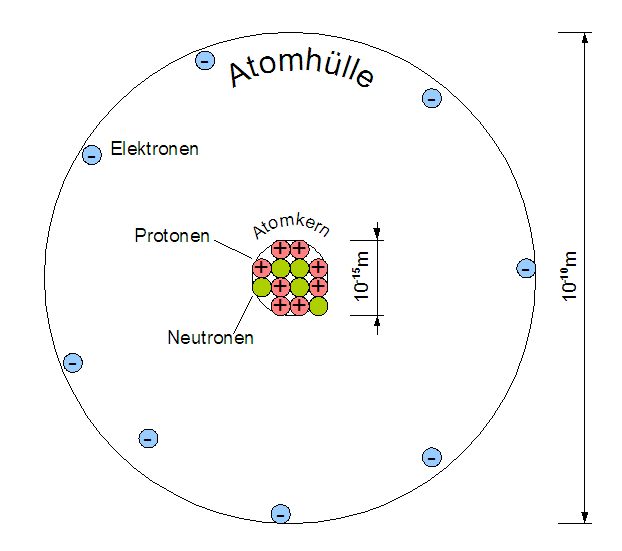
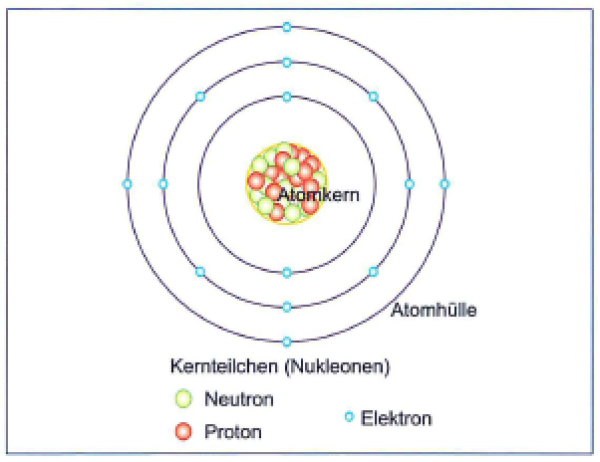
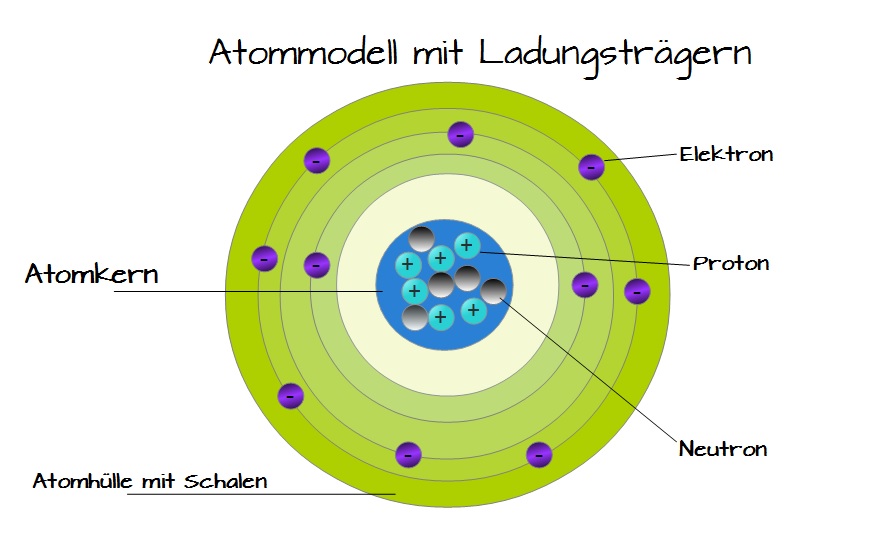
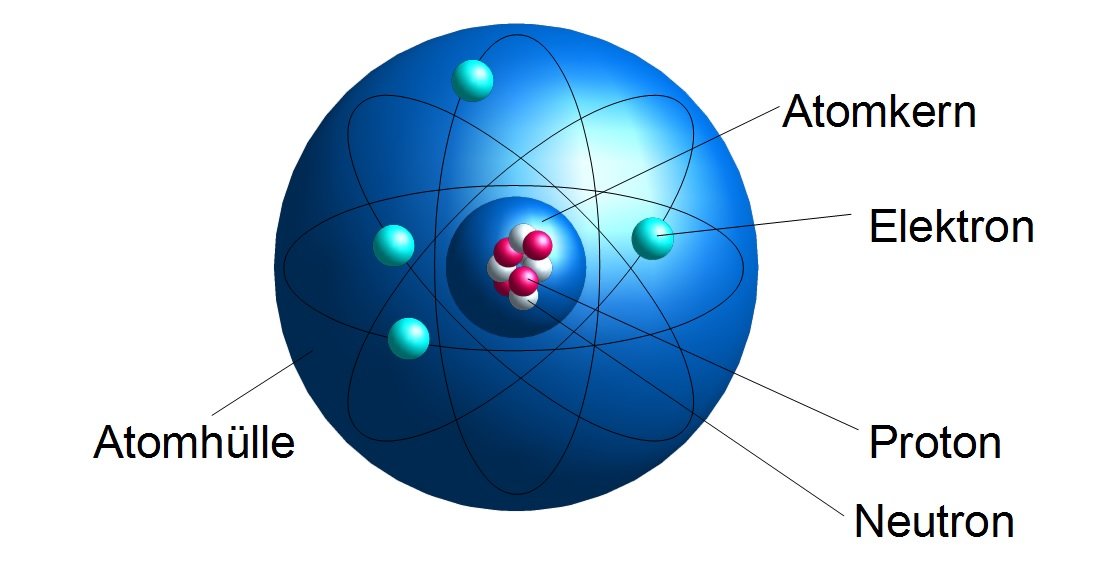
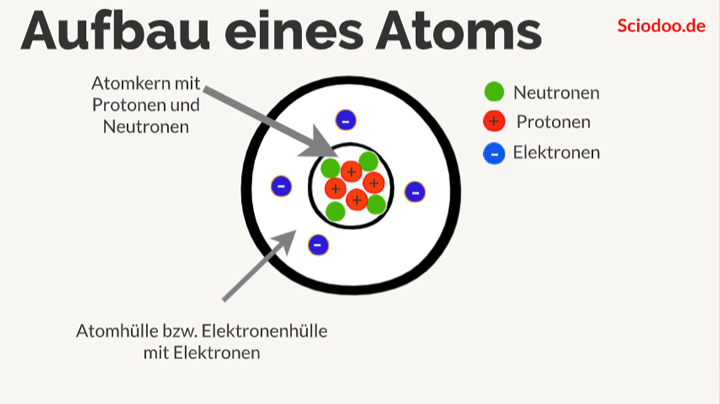
Du erinnerst dich vielleicht noch aus der Schule: Atome sind die Bausteine aller Materie. Aber wie sind diese Bausteine selbst aufgebaut? Im Zentrum steht der Atomkern, der aus Protonen und Neutronen besteht. Um diesen Kern herum befindet sich die Atomhülle, ein Bereich, in dem sich die Elektronen aufhalten. Stell dir den Atomkern als das Zentrum von Köln vor, und die Atomhülle als die verschiedenen Stadtteile drumherum. Jedes Elektron hat eine negative Ladung, während Protonen positiv geladen sind. Neutronen sind neutral. Und wie in einer gut funktionierenden Stadt muss auch in einem Atom alles im Gleichgewicht sein: Die Anzahl der Protonen im Kern entspricht der Anzahl der Elektronen in der Hülle, sodass das Atom insgesamt neutral ist.
Die Schalen – Wie Apartments in einem Hochhaus
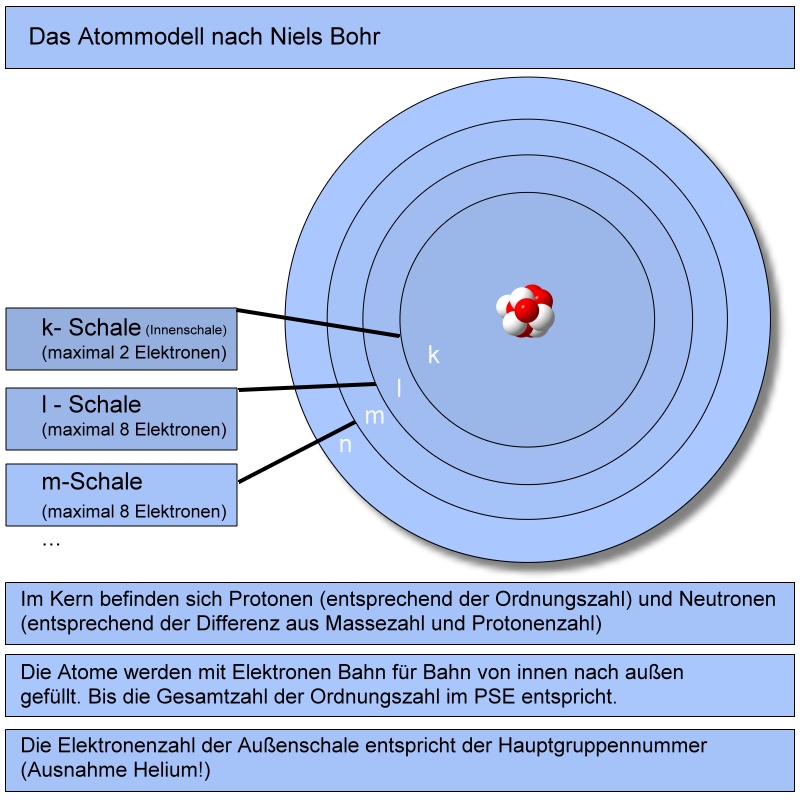
Jetzt kommt der Clou: Die Elektronen in der Atomhülle befinden sich nicht einfach wahllos um den Kern herum. Sie sind in fest definierten Bereichen angeordnet, die wir Schalen nennen. Denk an ein riesiges Apartmenthaus: Jede Etage ist eine Schale, und jede Schale kann nur eine bestimmte Anzahl von Elektronen aufnehmen. Die Schalen werden nummeriert, beginnend mit der innersten Schale, die dem Atomkern am nächsten ist. Diese erste Schale nennen wir K-Schale (n=1), die nächste ist die L-Schale (n=2), dann folgt die M-Schale (n=3) und so weiter (N, O, P, Q). Die K-Schale ist wie eine kleine Einzimmerwohnung und kann maximal zwei Elektronen aufnehmen. Die L-Schale ist schon etwas geräumiger und bietet Platz für bis zu acht Elektronen. Und die M-Schale kann sogar bis zu 18 Elektronen beherbergen.
Diese Verteilung der Elektronen auf die Schalen ist kein Zufall. Sie folgt einer bestimmten Regel, die wir Auffüllungsregel nennen. Die Elektronen besetzen immer zuerst die innerste Schale (also die K-Schale), bevor sie die nächste Schale füllen. Erst wenn die K-Schale voll ist, ziehen die Elektronen in die L-Schale um. Und erst wenn auch die L-Schale voll ist, geht es weiter zur M-Schale. Denk daran wie beim Anstehen vor einem Konzert: Die Leute drängen sich zuerst ganz vorne, bevor sie sich weiter nach hinten stellen.
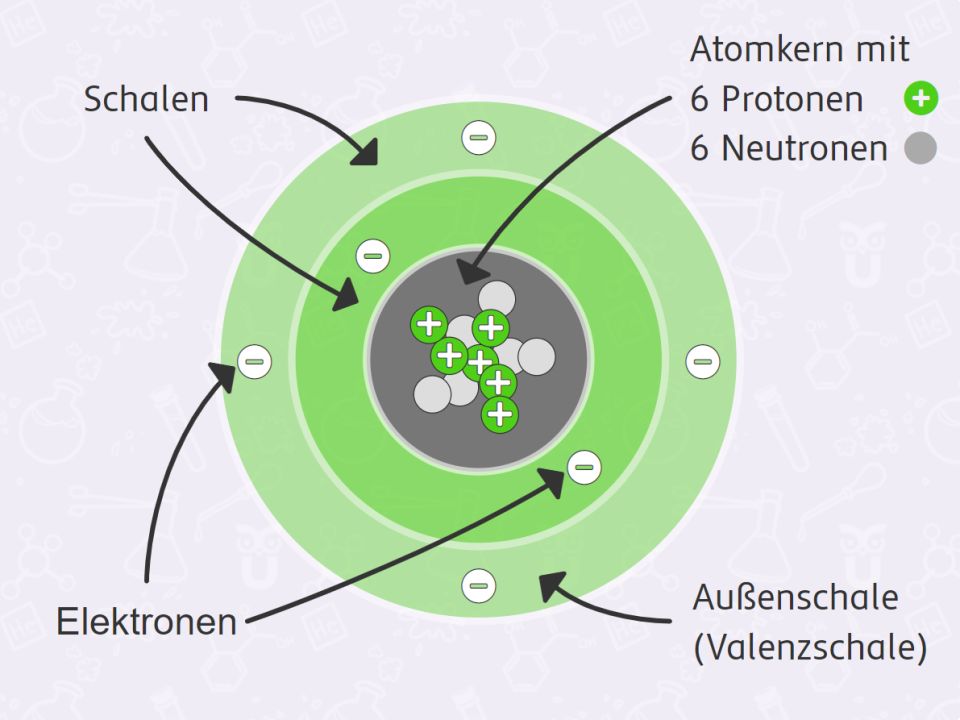
Ein Beispiel: Sauerstoff (O)
Um das Ganze etwas greifbarer zu machen, schauen wir uns mal ein konkretes Beispiel an: Sauerstoff (O). Sauerstoff ist essentiell für unser Leben, denn wir brauchen ihn zum Atmen. Aber wie sieht die Atomhülle eines Sauerstoffatoms aus?
Sauerstoff hat die Ordnungszahl 8 im Periodensystem. Das bedeutet, dass sich im Kern eines Sauerstoffatoms acht Protonen befinden. Da ein Atom neutral sein muss, hat ein Sauerstoffatom auch acht Elektronen in seiner Hülle. Wie sind diese acht Elektronen nun auf die Schalen verteilt?
- K-Schale (n=1): Diese Schale ist dem Kern am nächsten und kann maximal zwei Elektronen aufnehmen. Also befinden sich zwei der acht Elektronen des Sauerstoffs in der K-Schale.
- L-Schale (n=2): Nach der K-Schale kommt die L-Schale. Da wir bereits zwei Elektronen in der K-Schale untergebracht haben, bleiben noch sechs Elektronen übrig. Diese sechs Elektronen finden ihren Platz in der L-Schale.
Damit ist die Atomhülle des Sauerstoffatoms vollständig gefüllt. Die K-Schale ist mit zwei Elektronen voll, und die L-Schale hat sechs Elektronen. Man sagt auch, dass die Elektronenkonfiguration des Sauerstoffs 1s² 2s² 2p⁴ ist. Keine Panik, das sieht komplizierter aus, als es ist. Die "1s²" steht für die zwei Elektronen in der K-Schale (n=1). Die "2s² 2p⁴" stehen für die sechs Elektronen in der L-Schale (n=2), wobei die L-Schale noch in s- und p-Orbitale unterteilt ist (das ist aber ein Thema für eine andere Reise!).
Die Verteilung der Elektronen auf die Schalen bestimmt die chemischen Eigenschaften eines Elements. Sauerstoff hat in seiner äußersten Schale (der L-Schale) sechs Elektronen. Da die L-Schale eigentlich Platz für acht Elektronen hätte, ist Sauerstoff bestrebt, noch zwei weitere Elektronen aufzunehmen, um eine vollständige äußere Schale zu haben. Diese Tendenz, Elektronen aufzunehmen oder abzugeben, macht Sauerstoff zu einem sehr reaktionsfreudigen Element. Das ist auch der Grund, warum Sauerstoff so wichtig für Verbrennungsprozesse ist: Er reagiert gerne mit anderen Stoffen, um seine äußere Schale zu füllen.
Warum ist das wichtig?
Du fragst dich vielleicht: "Warum sollte mich das als Reisenden interessieren? Was hat die Atomhülle mit meinen Urlaubsplänen zu tun?" Nun, die Antwort ist: indirekt sehr viel! Die Eigenschaften aller Materialien um uns herum, von den Steinen der Pyramiden bis hin zum Stahl des Eiffelturms, werden durch die Atome bestimmt, aus denen sie bestehen. Und die Art und Weise, wie diese Atome miteinander reagieren, hängt direkt von der Elektronenkonfiguration ihrer Atomhüllen ab.
Denk an die Korrosion von Metallen. Wenn du ein altes Schloss in einem Feuchtgebiet besichtigst, siehst du vielleicht Rost. Rost ist das Ergebnis einer chemischen Reaktion, bei der Eisen mit Sauerstoff und Wasser reagiert. Diese Reaktion wird durch die Elektronenkonfiguration der beteiligten Atome ermöglicht. Oder denk an die Farben, die du in einem bunten Souk in Marrakesch siehst. Die Farben entstehen, weil bestimmte Materialien bestimmte Wellenlängen des Lichts absorbieren und andere reflektieren. Auch dieser Prozess hängt mit der Elektronenhülle der Atome zusammen.
Verstehst du? Die Atomhülle ist nicht nur ein abstraktes Konzept, sondern ein Grundbaustein unserer Welt. Indem wir die Struktur der Atomhülle verstehen, können wir die Eigenschaften von Materialien besser verstehen und erklären, warum bestimmte Dinge so sind, wie sie sind. Und das kann unsere Reiseerlebnisse bereichern, indem wir die Welt um uns herum mit neuen Augen sehen.
Fazit: Mehr als nur eine Hülle
Die Atomhülle ist mehr als nur eine Hülle um den Atomkern. Sie ist ein komplexes System, das die chemischen Eigenschaften eines Elements bestimmt. Die Verteilung der Elektronen auf die Schalen folgt bestimmten Regeln und führt dazu, dass Atome miteinander reagieren und Verbindungen eingehen. Indem wir die Grundlagen der Atomhülle verstehen, können wir die Welt um uns herum besser verstehen – von der Korrosion von Metallen bis hin zu den leuchtenden Farben in einem tropischen Korallenriff.
"Die Wissenschaft kann uns zwar nicht die ultimative Antwort auf das 'Warum' geben, aber sie kann uns helfen, das 'Wie' besser zu verstehen." - Richard Feynman
Also, das nächste Mal, wenn du auf Reisen bist und ein neues Material entdeckst, denk daran: Es ist die Atomhülle, die ihm seine einzigartigen Eigenschaften verleiht. Und wer weiß, vielleicht inspiriert dich dieses Wissen ja sogar zu einer neuen Reise – einer Reise in die faszinierende Welt der Chemie!
Ich hoffe, diese kleine Reise in die Welt der Atomhülle hat dir gefallen. Und denk daran: Selbst die kleinsten Dinge können unglaublich komplex und faszinierend sein. Gute Reise!

![Erkläre Den Schalenaufbau Der Atomhülle An Einem Beispiel Atome einfach erklärt • Was ist ein Atom? · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/Was-ist-ein-Atom-1024x576.jpg)



![Erkläre Den Schalenaufbau Der Atomhülle An Einem Beispiel Atome • Atombaustein, Elektronenhülle Atome · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/10/WordPress_Bilder_Aufbau-eines-Atoms-1-1024x576.png)