Kompetitive Und Nicht Kompetitive Hemmung

Stellt euch vor, ihr seid in einer verwinkelten Gasse in Marrakesch, auf der Suche nach dem perfekten Gewürzstand. Die Luft ist erfüllt von exotischen Düften, und ihr wollt unbedingt dieses seltene Safran-Gewürz finden, von dem euch ein Freund vorgeschwärmt hat. Aber oh weh, die Gasse ist vollgestopft mit anderen Ständen, die alle ähnliche, wenn auch nicht identische, Gewürze anbieten. Das ist im Grunde die Welt der Enzyme und ihrer Hemmer, und heute nehme ich euch mit auf eine kulinarische (nun ja, biochemische) Reise, um die kompetitive und nicht-kompetitive Hemmung zu erkunden. Es ist faszinierender, als es klingt, versprochen!
Die Bühne: Enzyme – Unsere fleißigen kleinen Helfer
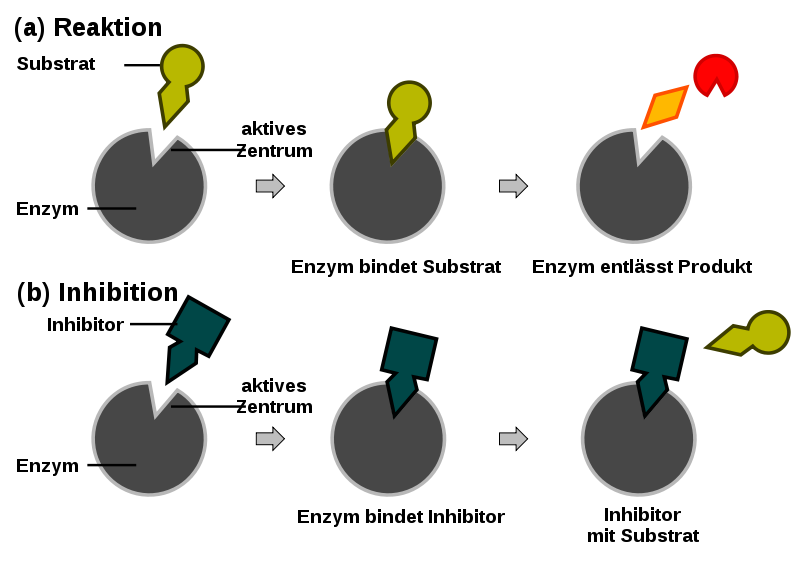
Bevor wir uns ins Getümmel stürzen, lasst uns kurz über Enzyme sprechen. Stellt sie euch als die kleinen Köche in unseren Zellen vor. Sie beschleunigen chemische Reaktionen, die sonst viel zu lange dauern würden, um unser Leben aufrechtzuerhalten. Jedes Enzym hat eine spezielle Form, die perfekt zu einem bestimmten Molekül, dem Substrat, passt. Diese perfekte Passform ermöglicht es dem Enzym, das Substrat zu binden und es in ein Produkt umzuwandeln. Das ist wie der Schlüssel, der perfekt in ein Schloss passt, oder eben das Safran-Gewürz, das genau in eure Tajine gehört.
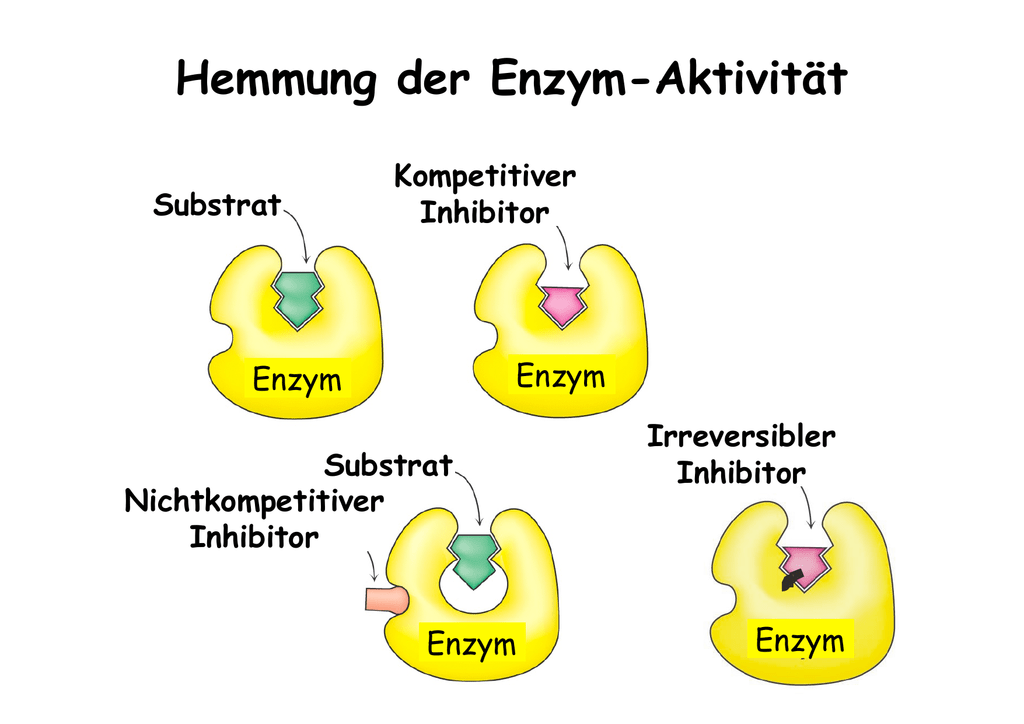
Akt 1: Kompetitive Hemmung – Der Kampf um den besten Stand
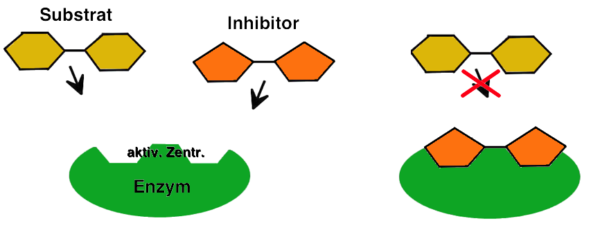
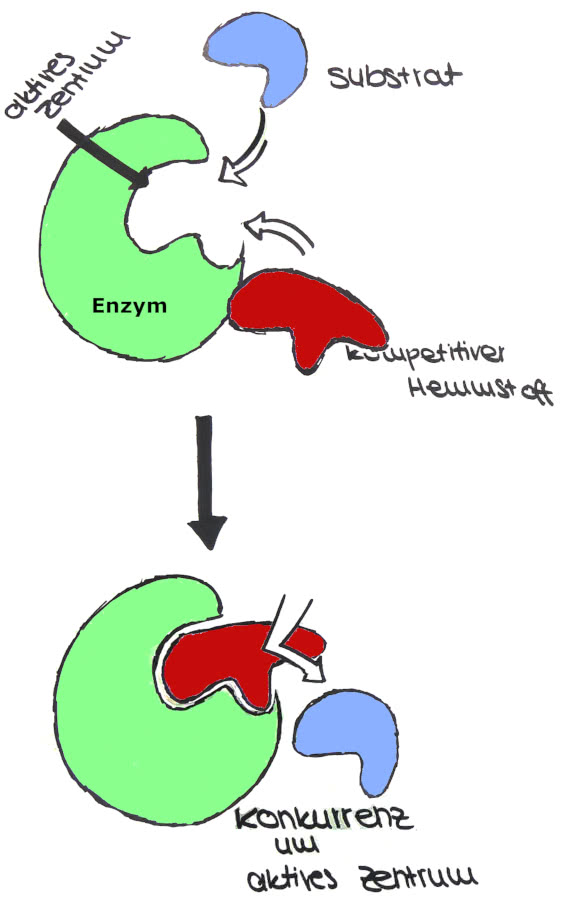
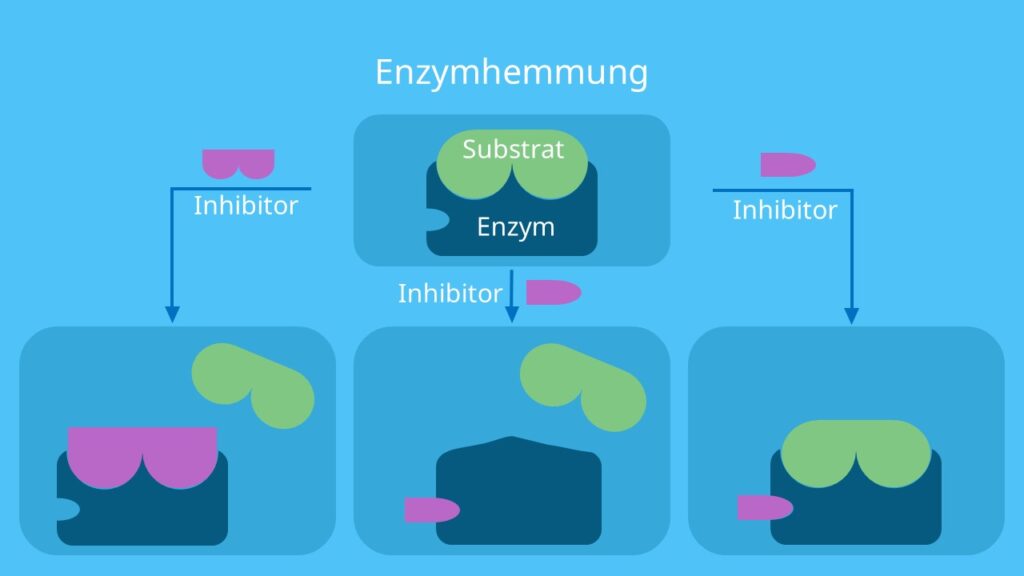
Jetzt kommt die kompetitive Hemmung ins Spiel. Stellt euch vor, ein anderer Händler hat ein Gewürz, das dem Safran sehr ähnlich ist. Es sieht fast identisch aus und riecht auch fast so. Dieses Gewürz ist der kompetitive Hemmer. Er versucht, euren Platz am Safran-Stand einzunehmen. Er konkurriert direkt mit dem Safran (dem Substrat) um die Bindungsstelle am Enzym (dem Händler).
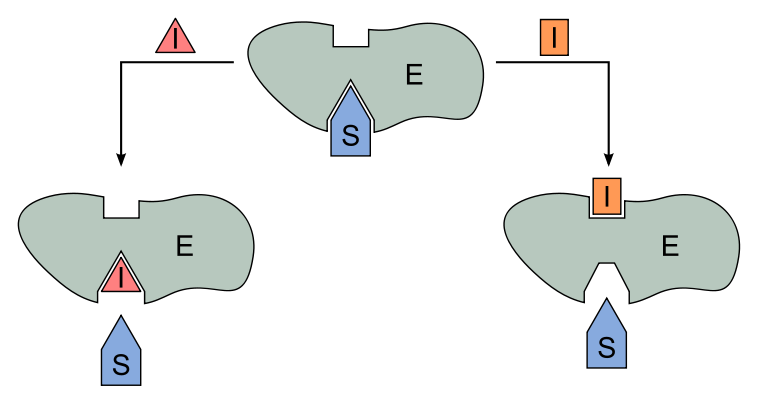
Wie funktioniert das genau? Der Hemmer bindet an die aktive Stelle des Enzyms, also den Ort, an dem normalerweise das Substrat andockt. Da der Hemmer und das Substrat um denselben Platz kämpfen, kann der Hemmer die Bildung von Enzym-Substrat-Komplexen verhindern. Das bedeutet, dass die Reaktion verlangsamt oder sogar ganz gestoppt werden kann.
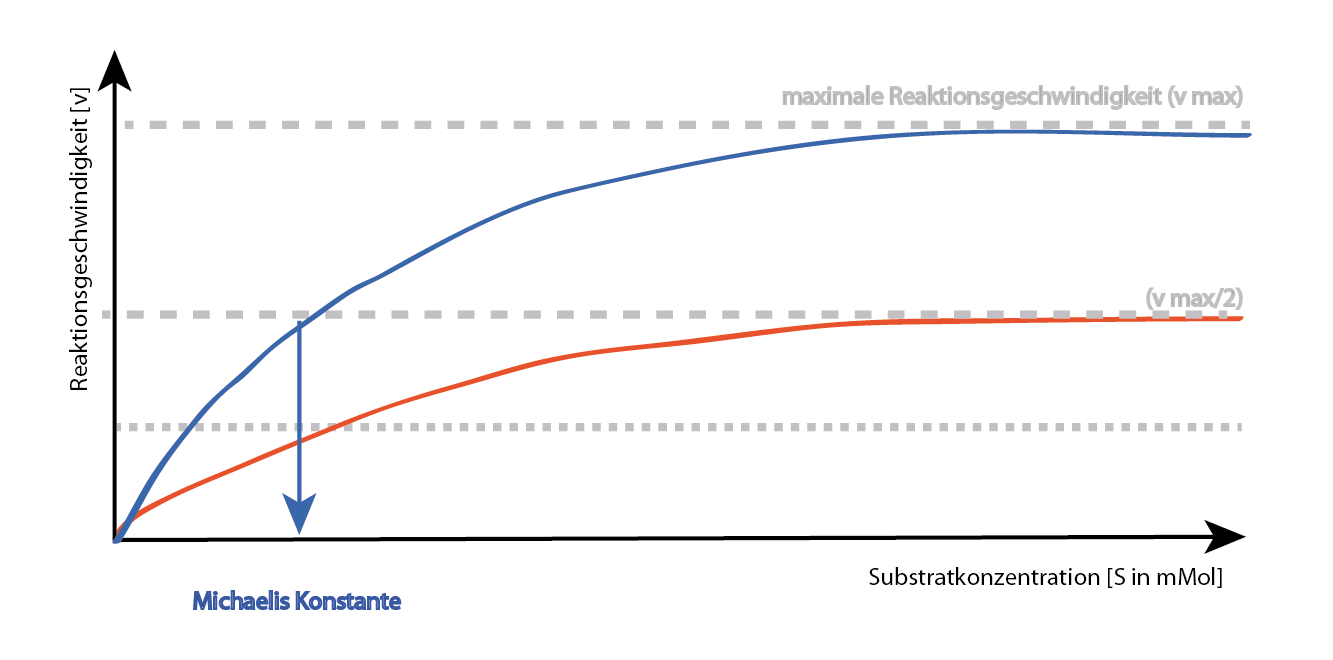
Was passiert, wenn man mehr Substrat hinzufügt? Hier kommt der Clou: Wenn ihr eine riesige Menge Safran auftreibt, übertrumpft ihr den Hemmer einfach! Je mehr Substrat vorhanden ist, desto wahrscheinlicher ist es, dass es sich an das Enzym bindet und die Reaktion ablaufen kann. Das ist so, als ob ihr einfach mit mehr Geld winkt, um das beste Gewürz zu bekommen – der Händler kann euch nicht widerstehen. Mit genügend Substrat kann die Wirkung des kompetitiven Hemmers also überwunden werden.
Ein praktisches Beispiel: Methanol-Vergiftung. Methanol wird von einem Enzym namens Alkoholdehydrogenase abgebaut, aber dabei entsteht Formaldehyd, das extrem giftig ist. Ethanol (normaler Alkohol, den wir in Getränken finden) ist ein kompetitiver Hemmer dieses Enzyms. Wenn jemand Methanol getrunken hat, gibt man ihm Ethanol, damit dieses sich an die Alkoholdehydrogenase bindet und die Umwandlung von Methanol in Formaldehyd verlangsamt. Dem Körper bleibt so mehr Zeit, das Methanol auf sicherere Weise auszuscheiden.
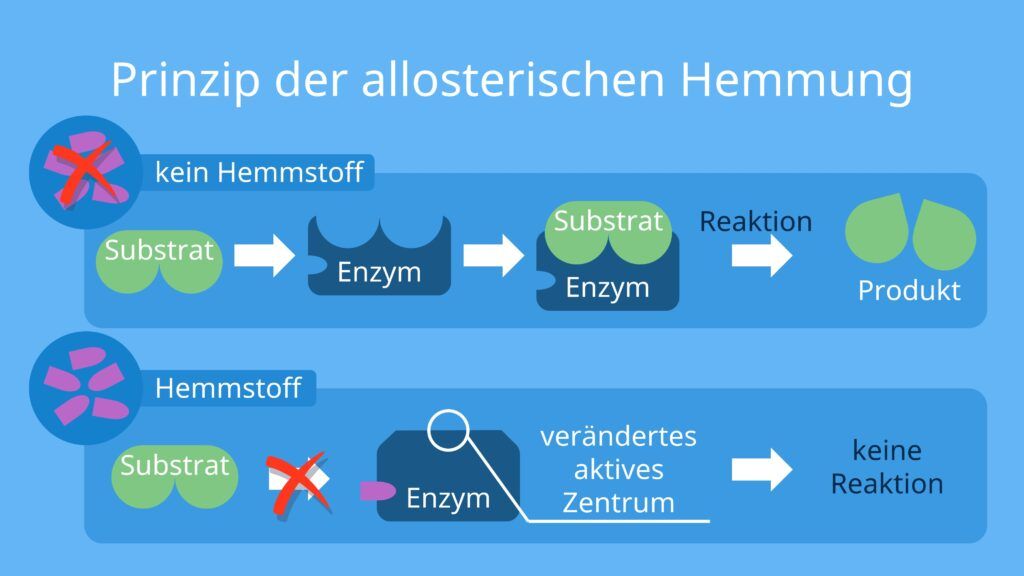
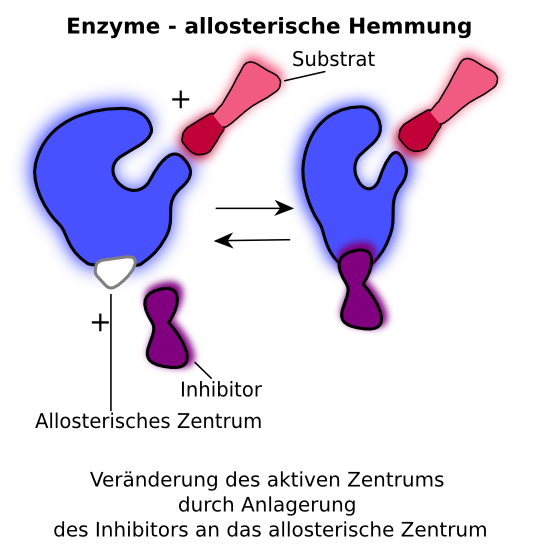
Akt 2: Nicht-kompetitive Hemmung – Der Saboteur im Hintergrund
Die nicht-kompetitive Hemmung ist etwas heimtückischer. Stellt euch vor, jemand sabotiert den Safran-Stand selbst. Er verstopft die Waage oder versteckt das Messer, mit dem die Gewürze abgewogen werden. Er konkurriert nicht direkt um das Gewürz selbst, sondern erschwert dem Händler die Arbeit. Der nicht-kompetitive Hemmer bindet nicht an die aktive Stelle des Enzyms, sondern an eine andere Stelle, die als allosterische Stelle bezeichnet wird.
Was passiert, wenn der Hemmer an die allosterische Stelle bindet? Dadurch ändert sich die Form des Enzyms, einschließlich der aktiven Stelle. Die aktive Stelle ist dann entweder nicht mehr so gut geeignet für das Substrat, oder das Enzym kann die Reaktion nach der Bindung des Substrats nicht mehr richtig durchführen. Es ist, als ob der sabotierte Stand zwar noch Safran anbieten kann, aber der Händler es einfach nicht mehr richtig abwiegen oder verpacken kann.
Kann man die nicht-kompetitive Hemmung überwinden, indem man mehr Substrat hinzufügt? Nein! Das ist der entscheidende Unterschied zur kompetitiven Hemmung. Egal wie viel Safran ihr bringt, die Waage ist immer noch verstopft. Die maximale Reaktionsgeschwindigkeit des Enzyms wird immer reduziert, da ein Teil der Enzymmoleküle durch den Hemmer inaktiviert wurde. Die Bindung des Substrats an das Enzym wird beeinträchtigt, unabhängig davon, wie viel Substrat vorhanden ist.
Ein praktisches Beispiel: Viele Medikamente wirken als nicht-kompetitive Hemmer. Sie binden an Enzyme, die an bestimmten Stoffwechselwegen beteiligt sind, und verlangsamen oder stoppen diese Wege, um Krankheiten zu behandeln. Zum Beispiel hemmen einige Krebsmedikamente Enzyme, die für das Zellwachstum unerlässlich sind, und verhindern so, dass sich die Krebszellen weiter vermehren.
Der Unterschied im Überblick: Ein kleiner Spickzettel
Um das Ganze noch einmal zusammenzufassen, hier eine kleine Tabelle, die euch hoffentlich hilft, die Unterschiede zu verstehen:
Kompetitive Hemmung:Nicht-kompetitive Hemmung:
- Hemmer bindet an die aktive Stelle.
- Substrat und Hemmer konkurrieren um die Bindungsstelle.
- Erhöhung der Substratkonzentration kann die Hemmung überwinden.
- Die maximale Reaktionsgeschwindigkeit des Enzyms (Vmax) bleibt gleich, aber die Michaelis-Menten-Konstante (Km) erhöht sich. (Keine Sorge, wenn euch das nichts sagt, es bedeutet einfach, dass mehr Substrat benötigt wird, um die halbe maximale Geschwindigkeit zu erreichen)
- Hemmer bindet an eine allosterische Stelle.
- Substrat und Hemmer konkurrieren nicht um die Bindungsstelle.
- Erhöhung der Substratkonzentration kann die Hemmung nicht überwinden.
- Die maximale Reaktionsgeschwindigkeit des Enzyms (Vmax) wird verringert, während die Michaelis-Menten-Konstante (Km) gleich bleibt.
Fazit: Die Welt der Enzyme ist wie eine Reise
Wie ihr seht, ist die Welt der Enzyme und ihrer Hemmer eine faszinierende Reise. Es ist wie das Erkunden eines neuen Ortes mit all seinen verborgenen Ecken und Wendungen. Ob ihr nun in einer belebten Gasse nach dem perfekten Gewürz sucht oder versucht, die komplexen Mechanismen des Lebens zu verstehen, es gibt immer etwas Neues zu entdecken. Und wer weiß, vielleicht habt ihr ja beim nächsten Mal, wenn ihr kocht, einen ganz anderen Blick auf die chemischen Reaktionen, die im Hintergrund ablaufen. Bon appétit!