Kupfer 2 Sulfat Pentahydrat Molare Masse
Hallo liebe Entdecker und Wissensdurstige! Heute nehme ich euch mit auf eine kleine, aber feine Reise in die Welt der Chemie. Keine Angst, wir werden keine komplizierten Formeln pauken, sondern uns einem ganz besonderen Molekül widmen: dem Kupfer(II)-sulfat-Pentahydrat. Vielleicht denkt ihr jetzt: "Chemie? Was hat das mit Reisen zu tun?" Mehr, als ihr vielleicht ahnt! Denn gerade das Verständnis für die kleinen Dinge, die uns umgeben, kann unsere Reiseerlebnisse bereichern und uns die Augen für die Schönheit der Natur öffnen.
Stellt euch vor, ihr wandert durch eine karge, fast schon unwirklich wirkende Landschaft. Vielleicht seid ihr in einer alten Minenregion unterwegs, oder in einem vulkanisch aktiven Gebiet. Plötzlich entdeckt ihr etwas, das eure Aufmerksamkeit fesselt: leuchtend blaue Kristalle, die in der Sonne glitzern. Diese Kristalle könnten Kupfer(II)-sulfat-Pentahydrat sein, auch bekannt als Chalkanthit.
Was ist Kupfer(II)-sulfat-Pentahydrat überhaupt?
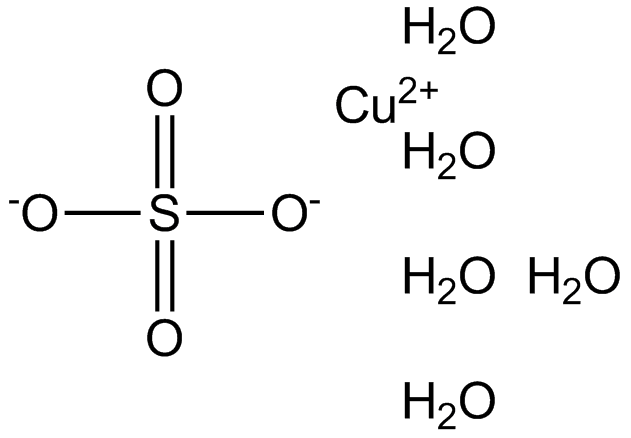
Okay, genug der Vorrede. Lasst uns etwas konkreter werden. Kupfer(II)-sulfat-Pentahydrat ist ein Salz, das aus Kupfer, Schwefel, Sauerstoff und Wasser besteht. Das "Penta" im Namen bedeutet, dass jedes Molekül Kupfer(II)-sulfat fünf Wassermoleküle gebunden hat. Diese Wassermoleküle sind entscheidend für die charakteristische blaue Farbe der Kristalle. Ohne das Wasser wäre das Kupfer(II)-sulfat farblos.
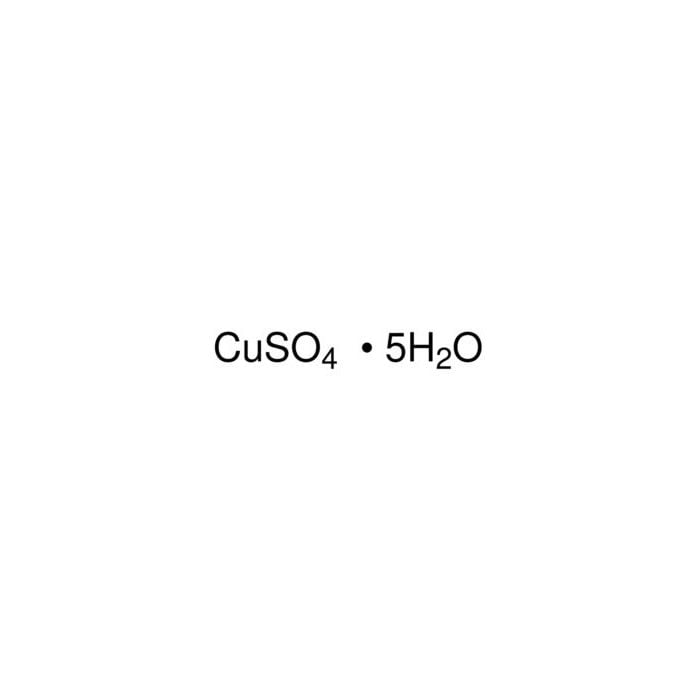
Chemisch gesehen ist die Formel für Kupfer(II)-sulfat-Pentahydrat CuSO₄ · 5H₂O. Das kleine Häkchen (·) zeigt an, dass das Wasser in das Kristallgitter eingelagert ist.
Die molare Masse: Ein Schlüssel zum Verständnis
Nun kommen wir zu einem Begriff, der vielleicht etwas abschreckend klingt, aber eigentlich ganz einfach ist: die molare Masse. Die molare Masse ist die Masse eines Mols einer Substanz, angegeben in Gramm pro Mol (g/mol). Ein Mol ist eine bestimmte Anzahl von Teilchen (Atome, Moleküle, Ionen), nämlich 6,022 × 10²³. Diese Zahl nennt man Avogadro-Konstante.
Warum ist die molare Masse so wichtig? Weil sie uns hilft, die Mengenverhältnisse bei chemischen Reaktionen zu verstehen. Stell dir vor, du backst einen Kuchen. Du brauchst eine bestimmte Menge Mehl, Zucker und Eier, um ein perfektes Ergebnis zu erzielen. In der Chemie ist es genauso: Die molare Masse hilft uns, die richtigen Mengen der verschiedenen Stoffe zu bestimmen, die wir für eine Reaktion benötigen.
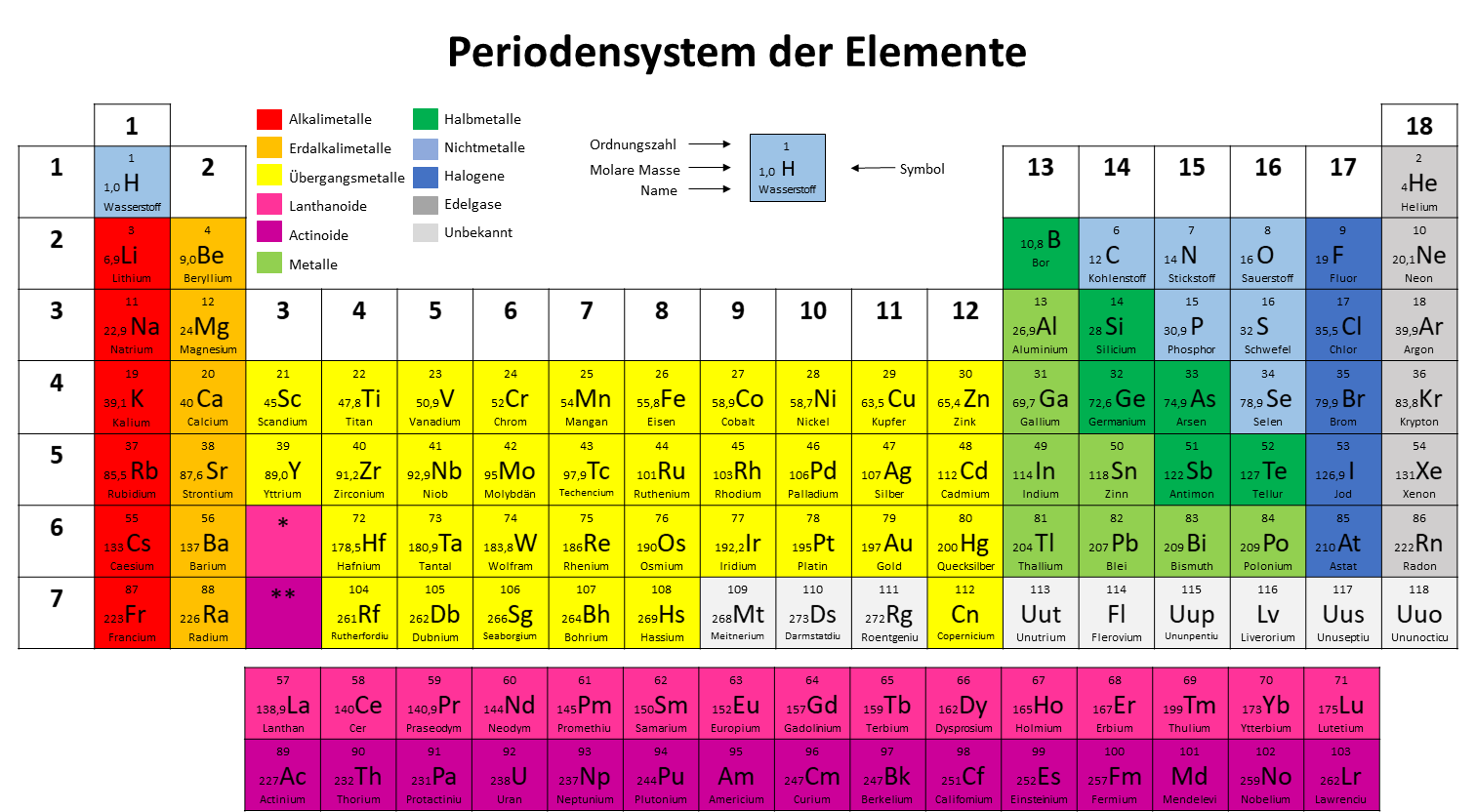
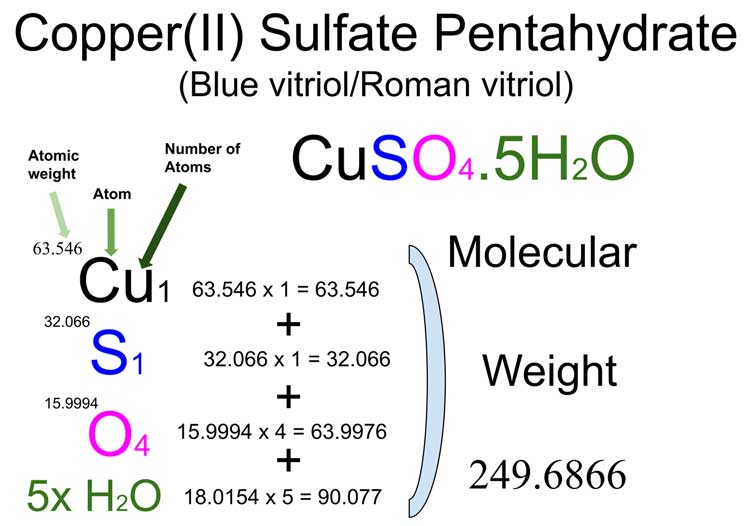
Wie berechnet man nun die molare Masse von Kupfer(II)-sulfat-Pentahydrat? Ganz einfach: Wir addieren die Atommassen aller Atome in der Formel. Die Atommassen finden wir im Periodensystem der Elemente.
Hier die einzelnen Schritte:
- Kupfer (Cu): Die Atommasse von Kupfer beträgt etwa 63,55 g/mol.
- Schwefel (S): Die Atommasse von Schwefel beträgt etwa 32,07 g/mol.
- Sauerstoff (O): Die Atommasse von Sauerstoff beträgt etwa 16,00 g/mol. Da wir vier Sauerstoffatome haben, ergibt das 4 × 16,00 g/mol = 64,00 g/mol.
- Wasser (H₂O): Die molare Masse von Wasser beträgt (2 × 1,01 g/mol) + 16,00 g/mol = 18,02 g/mol. Da wir fünf Wassermoleküle haben, ergibt das 5 × 18,02 g/mol = 90,10 g/mol.
Jetzt addieren wir alles zusammen:
63,55 g/mol (Cu) + 32,07 g/mol (S) + 64,00 g/mol (O₄) + 90,10 g/mol (5H₂O) = 249,72 g/mol
Die molare Masse von Kupfer(II)-sulfat-Pentahydrat beträgt also ungefähr 249,72 g/mol. Das bedeutet, dass ein Mol dieser Substanz 249,72 Gramm wiegt.
Wo findet man Kupfer(II)-sulfat-Pentahydrat in der Natur?
Wie schon erwähnt, kann man Kupfer(II)-sulfat-Pentahydrat in Minenregionen oder vulkanisch aktiven Gebieten finden. Es entsteht durch die Oxidation von Kupfererzen wie Chalkopyrit (CuFeS₂) in Gegenwart von Wasser und Sauerstoff.
Aber Achtung: Kupfer(II)-sulfat-Pentahydrat ist giftig und sollte nicht berührt oder gar gegessen werden! Genießt die Schönheit der Kristalle aus der Ferne und lasst sie dort, wo ihr sie gefunden habt. Es ist wichtig, die Natur zu respektieren und zu schützen.
Anwendungen von Kupfer(II)-sulfat-Pentahydrat
Kupfer(II)-sulfat-Pentahydrat hat viele verschiedene Anwendungen. In der Landwirtschaft wird es als Fungizid eingesetzt, um Pflanzen vor Pilzbefall zu schützen. Im Labor dient es als Reagenz in verschiedenen chemischen Reaktionen. Auch in der Galvanotechnik, zum Beispiel zum Verkupfern von Metallen, findet es Verwendung. Und wer hätte gedacht, dass es sogar in manchen Algenbekämpfungsmitteln für Schwimmbäder enthalten ist?
Für uns Reisende ist vielleicht am interessantesten, dass Kupfer(II)-sulfat-Pentahydrat früher auch zur Herstellung von Pigmenten für Farben verwendet wurde. So könnten die leuchtend blauen Farben in alten Fresken oder Gemälden mitunter auf dieses Salz zurückzuführen sein.
Meine persönliche Erfahrung mit Kupfer(II)-sulfat-Pentahydrat
Ich erinnere mich noch gut an meinen Besuch in einer alten Kupfermine in Chile. Die Landschaft war atemberaubend, fast schon surreal. Überall lagen verwitterte Gesteinsbrocken und verlassene Werkzeuge herum. Und dann entdeckte ich sie: kleine, leuchtend blaue Kristalle, die wie Juwelen in der staubigen Umgebung funkelten. Es war ein magischer Moment, der mir die Verbindung zwischen Chemie und Natur auf eine ganz besondere Weise verdeutlicht hat. Ich habe die Kristalle natürlich nicht angefasst, aber ich habe sie ausgiebig fotografiert und ihre Schönheit in mich aufgesogen. Dieser Moment hat meine Reise unvergesslich gemacht.
Ich hoffe, ich konnte euch mit diesem kleinen Ausflug in die Welt der Chemie ein wenig inspirieren. Vielleicht werdet ihr bei euren nächsten Reisen ja auch die Augen offen halten und die kleinen Wunder der Natur entdecken. Und wer weiß, vielleicht begegnet ihr ja auch mal dem leuchtend blauen Kupfer(II)-sulfat-Pentahydrat.
Denkt daran: Das Verständnis für die Welt um uns herum kann unsere Reiseerlebnisse bereichern und uns die Augen für die Schönheit der Natur öffnen. Also, bleibt neugierig und entdeckt die Welt!
Und vergesst nicht: Reisen bildet! Und ein bisschen Chemie kann dabei auch nicht schaden.
Bis zum nächsten Abenteuer!
+sulfate+pentahydrate+is+completely+dehydrated%2C+how+many+grams+of+anhydrous+copper+sulfate+will+remain.jpg)



+sulfate+pentahydrate+will+be+needed+to+make+75+mL+of+a+M+solution..jpg)
![Kupfer 2 Sulfat Pentahydrat Molare Masse Molare Masse berechnen • Formel & Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/10/WP_Molare-Masse_pse-1-1024x576.jpg)