Lewis Dot Structure For No3
Okay, stell dir vor, wir sind auf einer Cocktailparty. Keine steife Angelegenheit, sondern eher so eine, wo man Flip-Flops trägt und sich heimlich über die albernen Hütchen der anderen amüsiert. Und auf dieser Party gibt’s ein Molekül, das unbedingt auffallen will: das Nitrat-Ion, oder NO3-, wie es sich vorstellt. Ein bisschen eingebildet, aber hey, wer ist das auf Partys nicht?
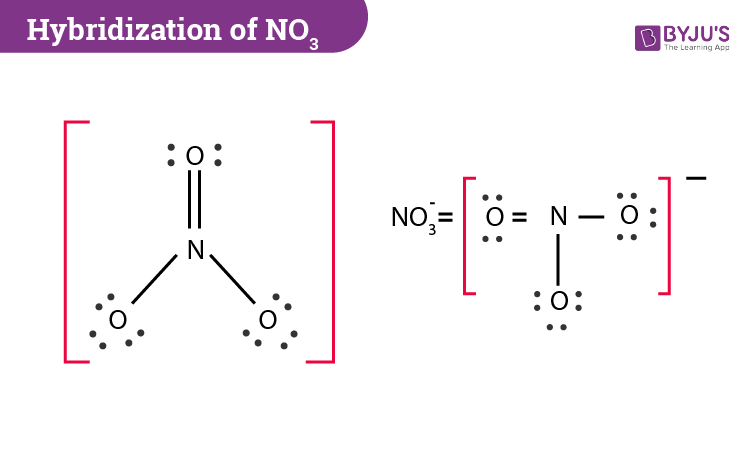
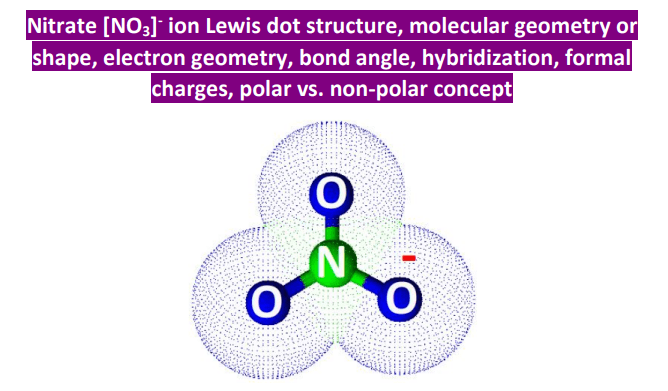
Unser NO3-, der kleine Angeber, besteht aus einem Stickstoffatom (N) und drei Sauerstoffatomen (O). Stell dir Stickstoff als den Gastgeber vor – ein bisschen schüchtern, aber er versucht, alle zusammenzuhalten. Und die drei Sauerstoffatome? Die sind wie diese drei Freundinnen, die immer im Dreierpack auftauchen und die ganze Aufmerksamkeit auf sich ziehen.
Was unser NO3- jetzt so besonders macht, ist, dass es zeigen will, wie seine Atome miteinander "befreundet" sind. Und wie macht man das in der Welt der Moleküle? Mit etwas, das sich Lewis-Punktstruktur nennt! Klingt kompliziert, ist aber eigentlich nur eine Art Strichmännchen-Zeichnung für Moleküle.
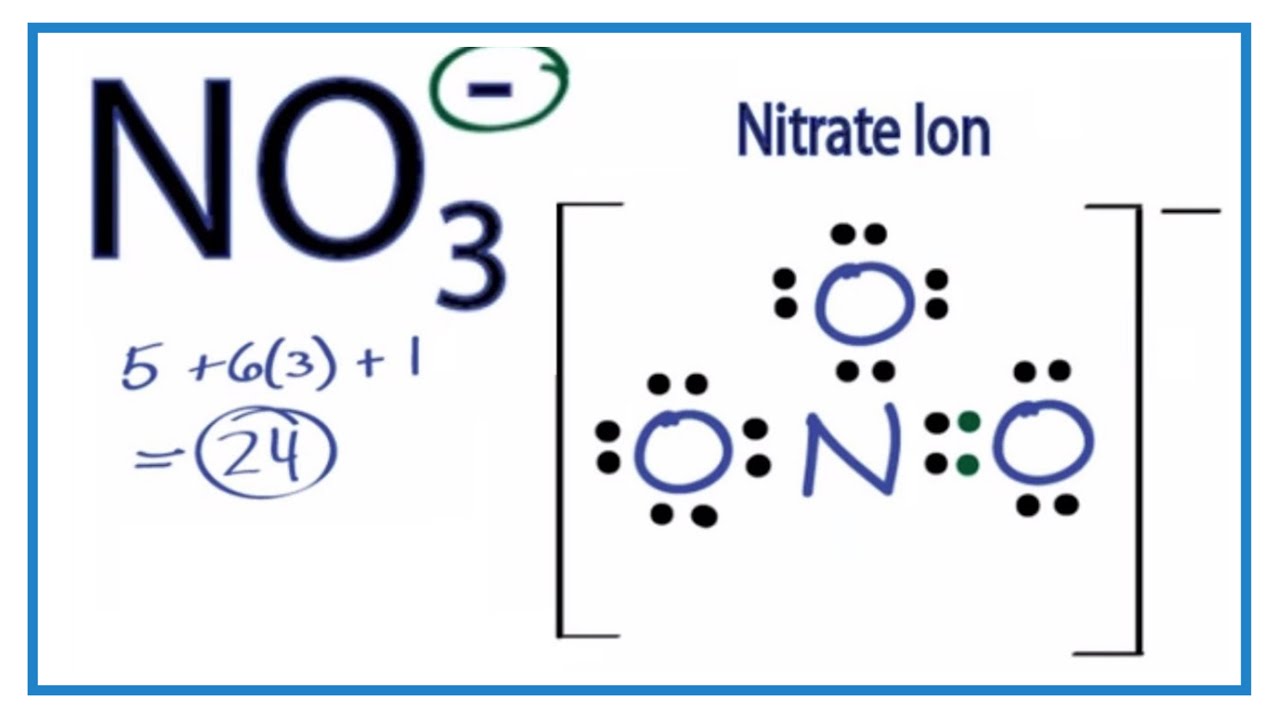
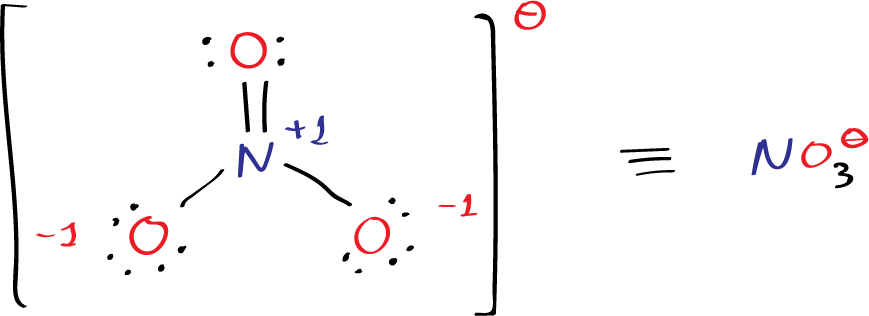
Also, der Gastgeber (Stickstoff) hat 5 "Freunde" (Valenzelektronen), die er auf der Party vorstellen will. Jede der Sauerstoff-Damen hat 6. Macht insgesamt 5 + 3*6 = 23 Freunde. Aber HALT! Da war ja noch das kleine Minuszeichen beim NO3-! Das bedeutet, dass noch ein ungebetener Gast dazugekommen ist, ein zusätzlicher Freund. Macht also insgesamt 24 Freunde, die wir irgendwie verteilen müssen.
Jetzt kommt der knifflige Teil. Stickstoff, als Gastgeber, will natürlich, dass alle zufrieden sind. Er versucht, die Sauerstoff-Damen um sich zu scharen. Jede Sauerstoff-Dame braucht 8 Freunde, um so richtig glücklich zu sein (die berühmte Oktettregel!). Stickstoff will aber auch selbst 8 haben.
Die erste Konstellation: Das Drama beginnt
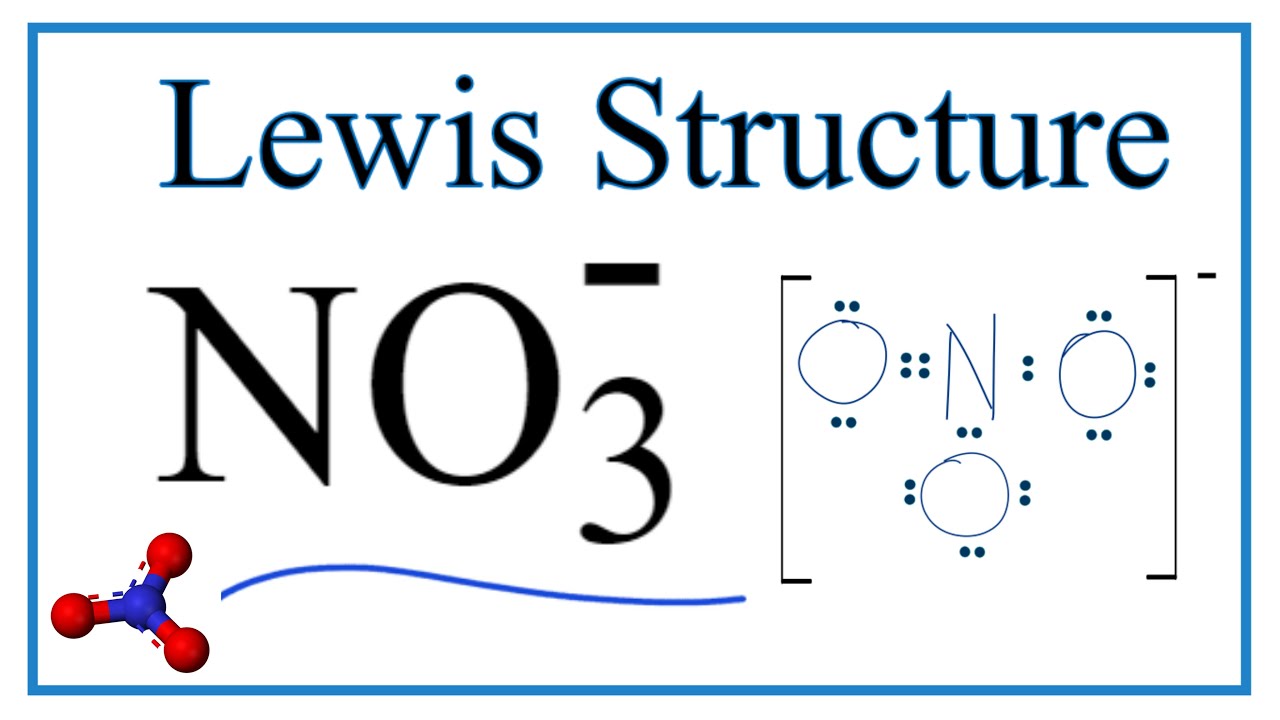
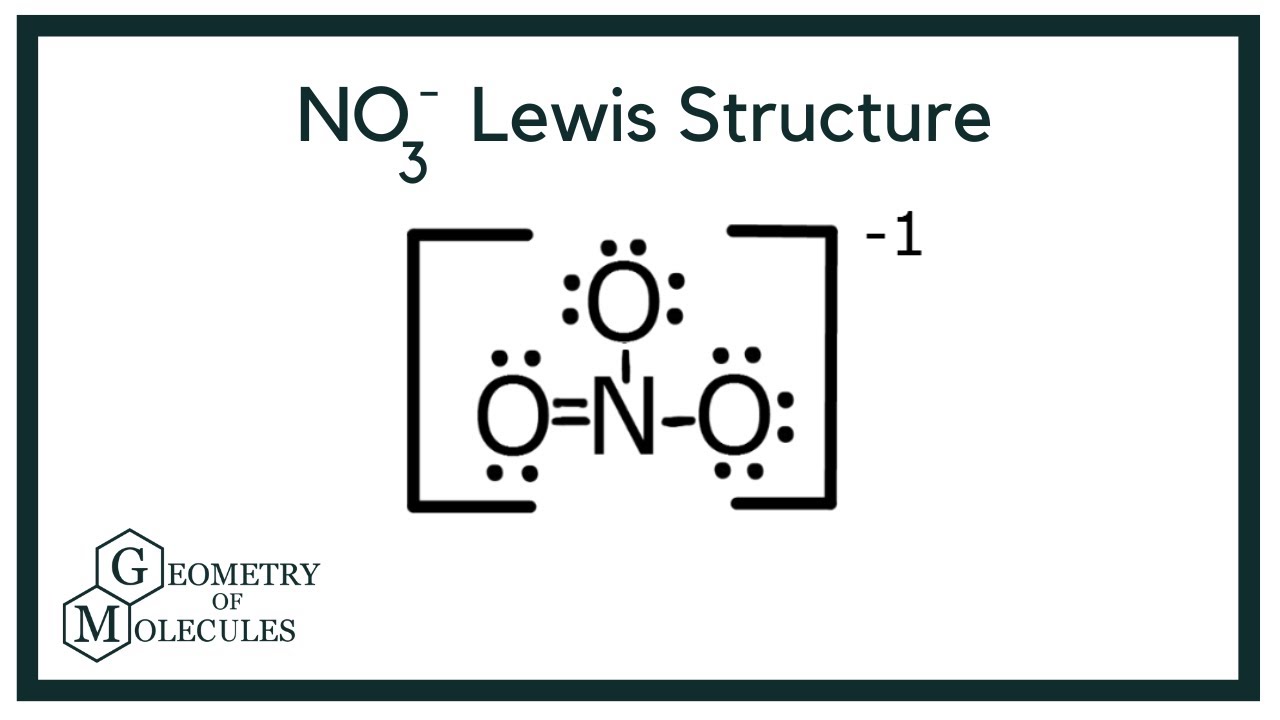
Am Anfang denkt man vielleicht: "Kein Problem! Stickstoff teilt einfach zwei Freunde mit jeder Sauerstoff-Dame, und alle sind glücklich!" Das würde bedeuten, dass Stickstoff eine Doppelbindung zu einer Sauerstoff-Dame eingeht und Einfachbindungen zu den anderen beiden. Und tatsächlich, das sieht auf dem Papier ganz gut aus. Eine Sauerstoff-Dame jubelt über ihre 8 Freunde, Stickstoff strahlt, weil er auch 8 hat, und die anderen beiden Sauerstoff-Damen… naja, die haben nur 7.
Hier kommt die Tragödie ins Spiel. Diese beiden unglücklichen Sauerstoff-Damen sind sauer (Wortwitz beabsichtigt!). Sie haben nicht genug Freunde! Was tun?
Die Lösung: Formale Ladungen und andere Komplikationen
In der Molekülwelt gibt es eine Art "Anstandsdame", die sogenannte formale Ladung. Sie geht herum und schaut, ob sich alle fair behandelt fühlen. Und was sie entdeckt, ist nicht schön: Die glückliche Sauerstoff-Dame hat eine formale Ladung von 0 (alles super!), Stickstoff hat +1 (ein bisschen gierig), und die beiden unglücklichen Sauerstoff-Damen haben jeweils -1 (total benachteiligt!). Das ist wie auf einer Party, auf der jemand den doppelten Kuchen bekommt und andere leer ausgehen. Das gibt Ärger!
Es gibt noch eine andere Möglichkeit: Stickstoff könnte sich entscheiden, nur eine Bindung mit jeder Sauerstoff-Dame einzugehen. Aber dann hätten alle ein Problem! Niemand wäre wirklich glücklich.
Die Rettung: Resonanz
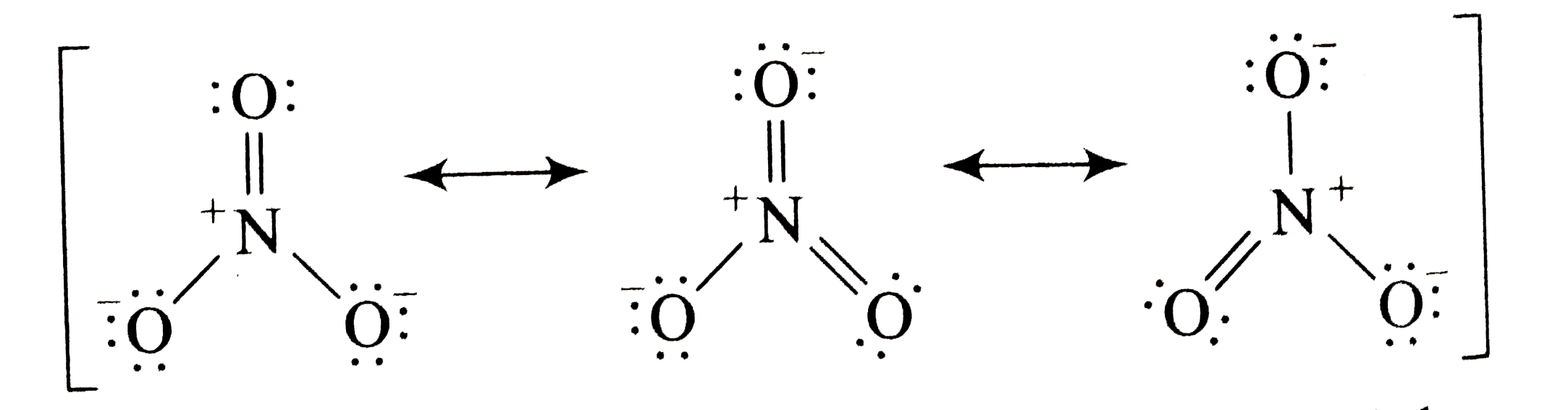
Hier kommt die Rettung in Form eines magischen Konzepts namens Resonanz! Stell dir vor, die Sauerstoff-Damen beschließen, sich abzuwechseln. Jede von ihnen bekommt mal die Chance, die glückliche mit der Doppelbindung zu sein. Und die anderen beiden nehmen das einfach hin, weil sie wissen, dass sie auch mal an der Reihe sind.
Das bedeutet, dass die Doppelbindung zwischen Stickstoff und Sauerstoff nicht an einer bestimmten Stelle "festklebt", sondern sich stattdessen über alle drei Sauerstoff-Atome "verteilt". Es ist, als ob die drei Freundinnen sich den coolen neuen Hut immer mal wieder gegenseitig aufsetzen, so dass keine sich benachteiligt fühlt.
Wir zeichnen also drei verschiedene Lewis-Punktstrukturen, die alle gleichwertig sind. Jede zeigt eine andere Sauerstoff-Dame mit der Doppelbindung. Und um zu zeigen, dass diese Strukturen ineinander übergehen, zeichnen wir einen Resonanzpfeil zwischen ihnen. Das ist wie ein kleiner Zauberstab, der die Strukturen ineinander verwandelt.
Das Ergebnis ist, dass jede Sauerstoff-Bindung in Wirklichkeit eine Mischung aus einer Einfach- und einer Doppelbindung ist. Sie ist nicht ganz einfach und nicht ganz doppelt – sondern irgendwas dazwischen. Das ist wie auf einer Cocktailparty, wo die Getränke auch oft Mischungen sind und nie ganz das, was sie zu sein scheinen.
Das Fazit: NO3- ist ein Teamplayer
Die Moral von der Geschichte? Das Nitrat-Ion ist eigentlich ein ganz cooler Typ. Es zeigt uns, dass man manchmal Kompromisse eingehen muss, um alle glücklich zu machen. Die Lewis-Punktstruktur für NO3- ist also nicht nur eine alberne Zeichnung mit Punkten und Strichen, sondern ein kleines Drama über Freundschaft, Fairness und die Kunst, auf einer Cocktailparty zu überleben. Und ganz nebenbei beweist sie, dass selbst Moleküle manchmal ein bisschen Resonanz brauchen, um wirklich zu glänzen.
Und denk daran, wenn du das nächste Mal ein Glas Wasser trinkst (das vielleicht sogar Nitrat-Ionen enthält!), dass da eine ganze Welt voller kleiner Molekül-Partys im Gange ist. Und das NO3-, der kleine Angeber, versucht immer noch, die coolste Lewis-Punktstruktur der ganzen Party zu haben.



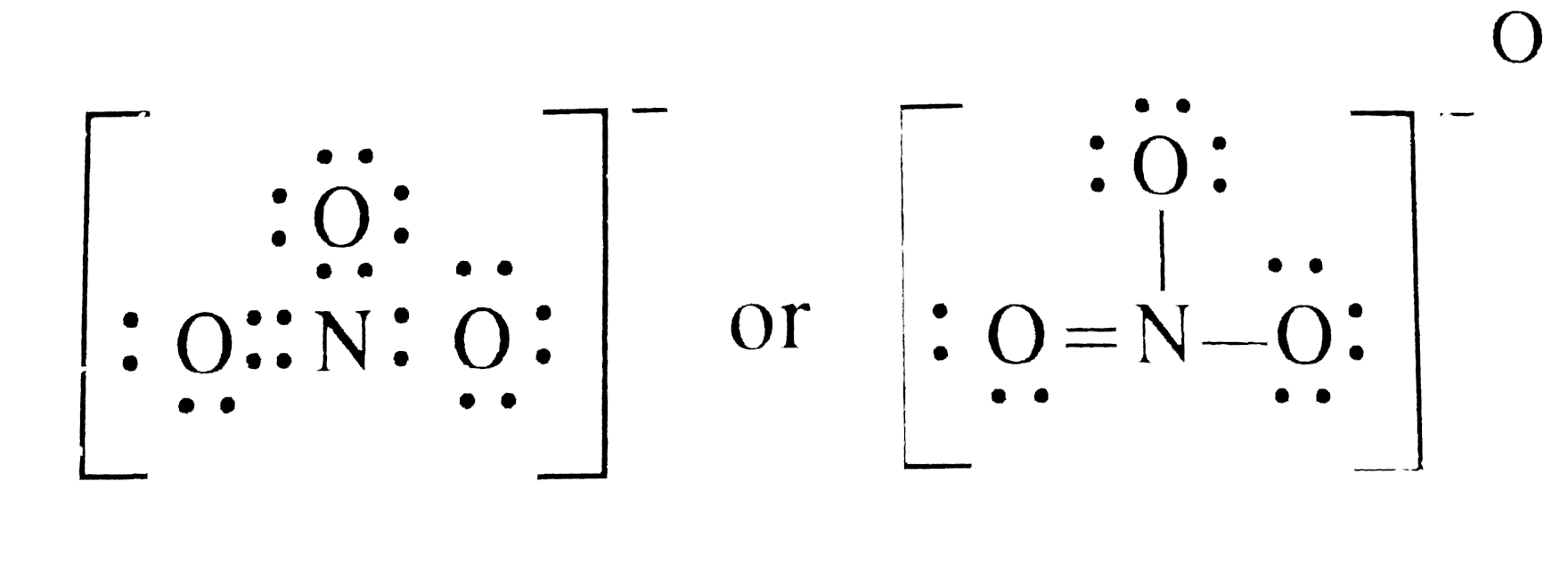





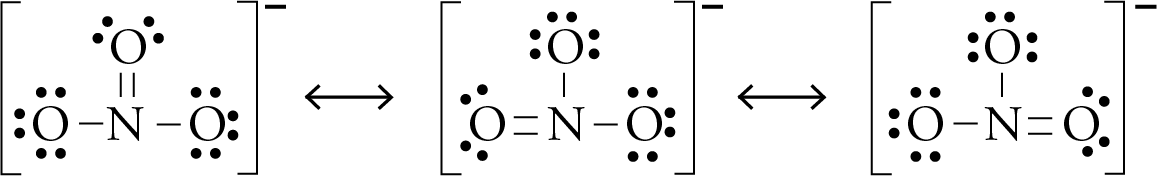

![Lewis Dot Structure For No3 No3 Lewis Structure How To Draw The Lewis Structure For Solved]](https://eightfoldlearning.com/wp-content/uploads/2020/10/NO3-final-lewis-1022x1024.png)
