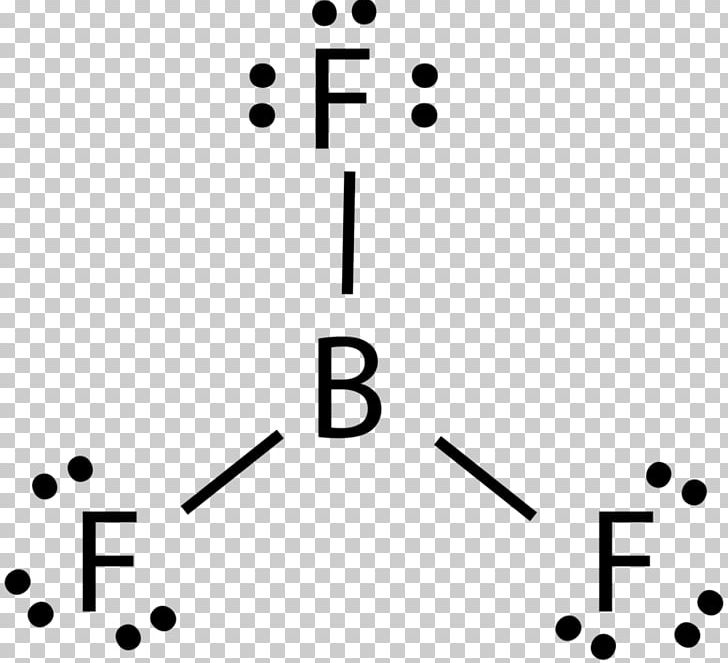
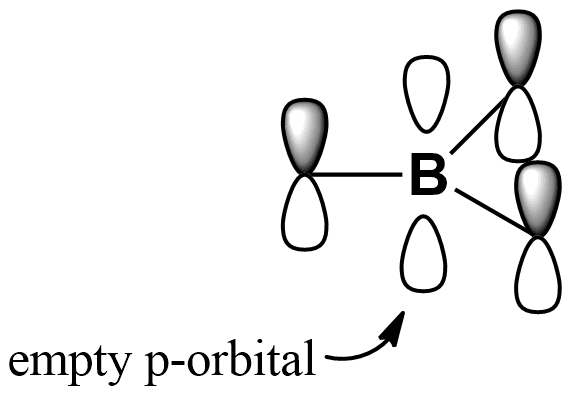
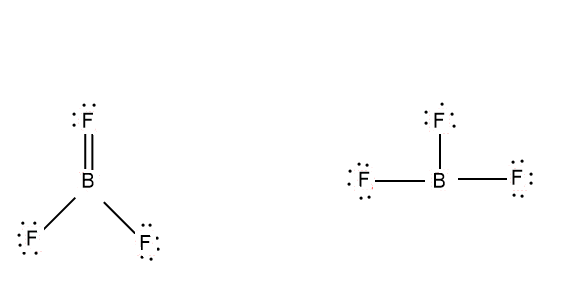
Lewis Structure Boron Trifluoride

Habt ihr euch jemals gefragt, ob Moleküle auch ein bisschen... unvollständig sein können? So wie ein Puzzle, bei dem ein Teil fehlt, oder ein Eis, das schon zur Hälfte aufgegessen ist? Nun, Freunde, lasst mich euch von Boron Trifluorid (BF3) erzählen! Dieses kleine Molekül ist ein echter Charakter, eine chemische Drama-Queen, wenn man so will.
Stellt euch vor, ihr seid Bor. Ihr seid ein nettes Atom, habt drei Freunde (Fluor-Atome), mit denen ihr Bindungen eingehen wollt. Jedes Fluor-Atom bringt ein Elektron mit, und ihr, Bor, steuert auch drei bei. So weit, so gut, richtig?
Normalerweise, in der Welt der chemischen Bindungen, streben Atome nach einem Zustand der Vollständigkeit. Sie wollen, dass ihre äußere Elektronenschale (die "Valenzschale") voll ist. Für viele Atome bedeutet das: Acht Elektronen, die berühmte "Oktettregel". Und hier beginnt die ganze Geschichte mit BF3, die uns so fasziniert!
Wenn Bor mit seinen drei Fluor-Freunden tanzt, hat es nur sechs Elektronen um sich herum. Nicht acht! Das ist so, als ob man eine Party schmeißt, aber zwei Gäste fehlen. Eine echte Tragödie, zumindest aus der Sicht der Oktettregel.
Ihr könnt euch Bor fast vorstellen, wie es frustriert die Augen verdreht. "Warum kann ich nicht einfach acht haben?", scheint es zu fragen. "Warum muss ich immer der Unvollständige sein?"
Aber hier kommt der Clou: Bor ist damit eigentlich ziemlich cool. Es ist nicht verzweifelt oder deprimiert. Im Gegenteil, es nutzt seine "Leere" zu seinem Vorteil. Es ist wie ein unglaublich begeisterter Staubsauger, der nur darauf wartet, noch mehr Elektronen aufzusaugen!
Die Chemie der Sehnsucht: Wie BF3 reagiert
Diese "Elektronenmangel"-Situation macht BF3 zu einer sehr reaktionsfreudigen Substanz. Es ist wie ein sozialer Schmetterling, der ständig auf der Suche nach neuen Kontakten ist, oder, um im Bild zu bleiben, nach Atomen oder Molekülen, die ihm Elektronen spendieren können.
Diese Bereitschaft, Elektronen anzunehmen, macht BF3 zu einer sogenannten Lewis-Säure. Eine Lewis-Säure ist im Grunde ein Molekül, das Elektronenpaare akzeptieren kann. Denkt daran wie an einen Freund, der immer bereit ist, eine helfende Hand zu reichen (oder in diesem Fall, Elektronen anzunehmen).
Es ist diese Eigenschaft, die BF3 in der organischen Chemie so nützlich macht. Es kann als Katalysator für verschiedene Reaktionen dienen, d.h. es kann chemische Reaktionen beschleunigen, ohne selbst verbraucht zu werden. Das ist so, als hätte man einen kleinen Helfer, der im Hintergrund die Fäden zieht und dafür sorgt, dass alles reibungslos abläuft.
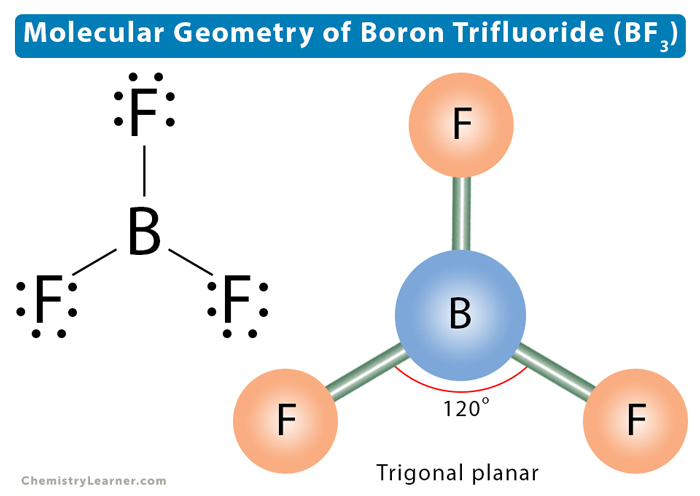
Die geometrische Form: Ein flaches Dreieck
Neben seiner unvollständigen Elektronenschale hat BF3 noch ein weiteres interessantes Merkmal: seine Form. Die drei Fluor-Atome stoßen sich gegenseitig ab, wodurch das Molekül eine flache, dreieckige Struktur erhält. Das ist, als würden drei Kinder an einem Seil ziehen und sich dabei so weit wie möglich voneinander entfernen.
Diese Form ist wichtig, weil sie dazu beiträgt, die Reaktivität von BF3 zu erklären. Die Fluor-Atome blockieren den Zugang zum Bor-Atom nicht vollständig, so dass andere Moleküle leichter an Bor andocken und ihm Elektronen spendieren können.
"Das ist wie ein kleines Dreieck, das bereit ist, neue Freunde zu treffen und Elektronen zu tauschen!" - Ein begeisterter Chemiker
Also, was lernen wir daraus? Manchmal muss man nicht perfekt sein, um etwas Besonderes zu sein. BF3 mag zwar nicht die Oktettregel erfüllen, aber gerade diese Unvollständigkeit macht es zu einem unglaublich nützlichen und interessanten Molekül. Es erinnert uns daran, dass es in der Chemie (und im Leben!) oft die kleinen "Fehler" sind, die uns einzigartig machen.
Denkt das nächste Mal, wenn ihr von BF3 hört, nicht nur an komplizierte chemische Formeln und Reaktionsmechanismen. Denkt an Bor, das unvollständige Atom, das sich weigert, sich unterkriegen zu lassen, und seine "Unvollständigkeit" nutzt, um die Welt der Chemie zu verändern. Und wer weiß, vielleicht inspiriert es uns ja auch dazu, unsere eigenen Unvollkommenheiten zu akzeptieren und das Beste daraus zu machen!



.jpg)