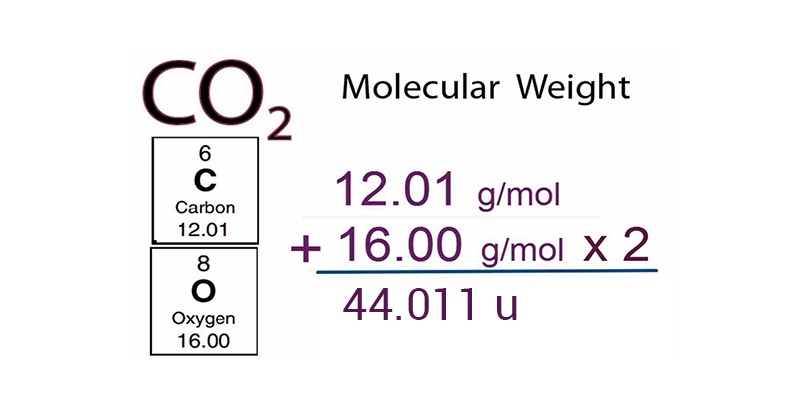
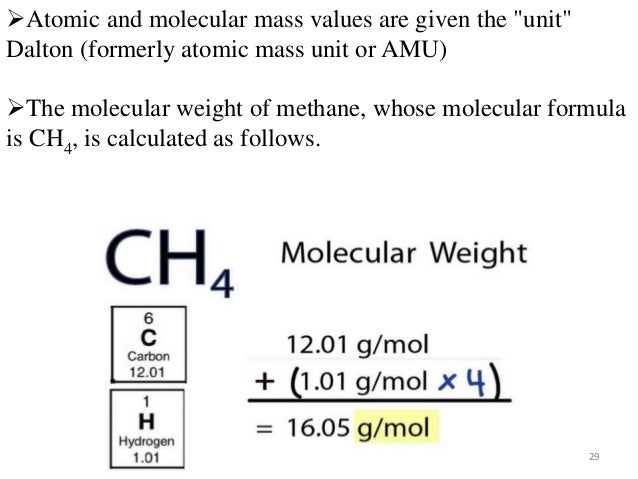
Molecular Weight Units Of Measure
Okay, los geht's! Stell dir vor, du backst einen Kuchen. Du brauchst Mehl, Zucker, Eier… alles in der richtigen Menge, oder? Sonst wird's entweder ein Ziegelstein oder ein flüssiger Matsch. In der Welt der Moleküle ist es genauso! Nur dass wir hier über winzige, unsichtbare Zutaten reden, und die "Menge" messen wir mit etwas namens Molekulargewicht. Und das, meine Freunde, hat natürlich auch eine Einheit!
Die Geheimnisse der Atommasseeinheit (amu)
Die erste Einheit, die wir uns anschauen, ist die Atommasseeinheit, oder kurz amu. Stell dir vor, ein einzelnes Atom, superklein, wiegt irgendetwas. Aber diese "irgendetwas" ist so winzig, dass normale Gewichtseinheiten wie Gramm oder Kilogramm völlig unpraktisch wären. Stell dir vor, du würdest die winzigen Krümel vom Toastbrot mit Tonnen messen! Völlig absurd, oder?
Deshalb haben Wissenschaftler die amu erfunden. Sie haben gesagt: "Okay, ein Kohlenstoffatom, das 12C-Isotop, soll einfach mal genau 12 amu wiegen!" Alles andere wird dann relativ dazu gemessen. Sozusagen Kohlenstoff als Maß aller Dinge. Ein Wasserstoffatom wiegt ungefähr 1 amu, ein Sauerstoffatom ungefähr 16 amu, und so weiter.
Warum ist das wichtig? Denk wieder an den Kuchen. Wenn du genau wissen willst, wie viele Atome von jeder Sorte du in deiner "Molekül-Backmischung" hast, musst du deren relative Gewichte kennen. Die amu hilft dir dabei, die perfekte Balance zu finden – zumindest auf atomarer Ebene!
Das magische Gramm pro Mol (g/mol)
Jetzt kommt der Hammer! Die amu ist zwar super für einzelne Atome, aber in der Praxis arbeiten wir ja selten mit einzelnen Atomen. Wir wollen größere Mengen! Und hier kommt das Gramm pro Mol (g/mol) ins Spiel. Das Mol ist sozusagen die "chemische Supermarkt-Packung". Ein Mol enthält immer die gleiche Anzahl an Teilchen, nämlich 6,022 x 1023 – die Avogadro-Konstante. Das ist eine riesige Zahl! Stell dir vor, du hättest so viele Smarties! Du könntest damit den Mond tapezieren, und hättest immer noch genug für eine Smarties-Pyramide bis zum Mars!
Der Clou ist: Das Molekulargewicht in amu ist numerisch gleich dem Gewicht eines Mols dieser Substanz in Gramm. Klingt kompliziert? Ist es aber nicht! Wenn ein Wasserstoffatom 1 amu wiegt, dann wiegt ein Mol Wasserstoffatome 1 Gramm. Wenn ein Wassermolekül (H2O) 18 amu wiegt (ungefähr, weil Wasserstoff 1 und Sauerstoff 16 amu hat, und wir haben zwei Wasserstoffatome), dann wiegt ein Mol Wassermoleküle 18 Gramm! Verrückt, oder?
Das g/mol ist superpraktisch, weil wir es direkt im Labor verwenden können. Wir können Substanzen abwiegen und wissen genau, wie viele Moleküle wir haben. Kein Smarties-Zählen mehr!
Ein paar Beispiele zum Staunen
- Wasser (H2O): Wie gesagt, ca. 18 g/mol. Eine kleine Flasche Wasser (180g) enthält also etwa 10 Mol Wassermoleküle!
- Kochsalz (NaCl): Ca. 58,5 g/mol. Eine Prise Salz (0,585g) enthält also etwa 0,01 Mol Natriumchlorid!
- Zucker (C12H22O11): Ca. 342 g/mol. Ein Löffel Zucker (3,42g) enthält also etwa 0,01 Mol Saccharose!
Warum das Ganze?
Warum all diese komplizierten Einheiten? Weil Chemie und alles, was mit Molekülen zu tun hat, präzise sein muss! Ob du nun ein neues Medikament entwickelst, einen Kuchen backst oder versuchst, die perfekte Farbe für dein Wohnzimmer zu mischen – das Molekulargewicht und seine Einheiten helfen dir, die richtige Menge von allem zu verwenden. Ohne sie wäre alles nur ein Glücksspiel, und das wollen wir ja nicht, oder? Stell dir vor, dein Kuchen würde explodieren, weil du zu viel Backpulver genommen hast! Oder dein Medikament würde dich heilen *und* in einen Frosch verwandeln! (Okay, vielleicht etwas übertrieben, aber du verstehst den Punkt.)
Also, das nächste Mal, wenn du von amu oder g/mol hörst, keine Panik! Denk einfach an deinen Kuchen, an Smarties und daran, dass diese Einheiten uns helfen, die Welt der Moleküle zu verstehen und zu kontrollieren. Und das ist doch ziemlich cool, oder?


+A+molecular+weight+is+the+sum+of+the+atomic+weights+of+the+atoms+in+a+molecule..jpg)