Oktettregel Einfach Erklärt Für Kinder
Die Welt der Atome ist winzig und geheimnisvoll. Stell dir vor, jedes Atom ist wie ein kleiner Baustein, aus dem alles um uns herum besteht: die Luft, die wir atmen, das Wasser, das wir trinken, sogar wir selbst! Aber wie halten diese winzigen Bausteine zusammen und bilden all die verschiedenen Dinge, die wir sehen?
Die Oktettregel: Ein Streben nach Vollständigkeit
Hier kommt die Oktettregel ins Spiel. Sie ist wie eine einfache Regel, die Atome befolgen, um stabil und zufrieden zu sein. Das Wort "Oktett" kommt von "Okta", was im Griechischen "Acht" bedeutet. Die Oktettregel besagt, dass Atome am liebsten acht Elektronen in ihrer äußersten Schale haben möchten. Diese äußerste Schale wird auch Valenzschale genannt. Es ist wie ein Spiel, bei dem jedes Atom versucht, seine Valenzschale mit acht Elektronen zu füllen.
Warum ist die Oktettregel so wichtig?
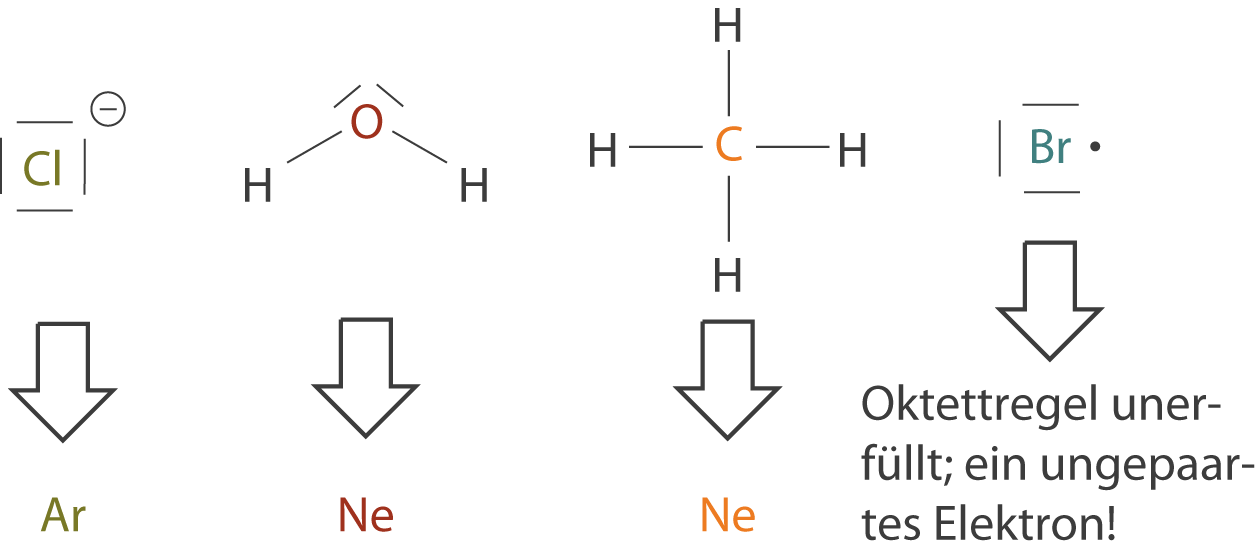
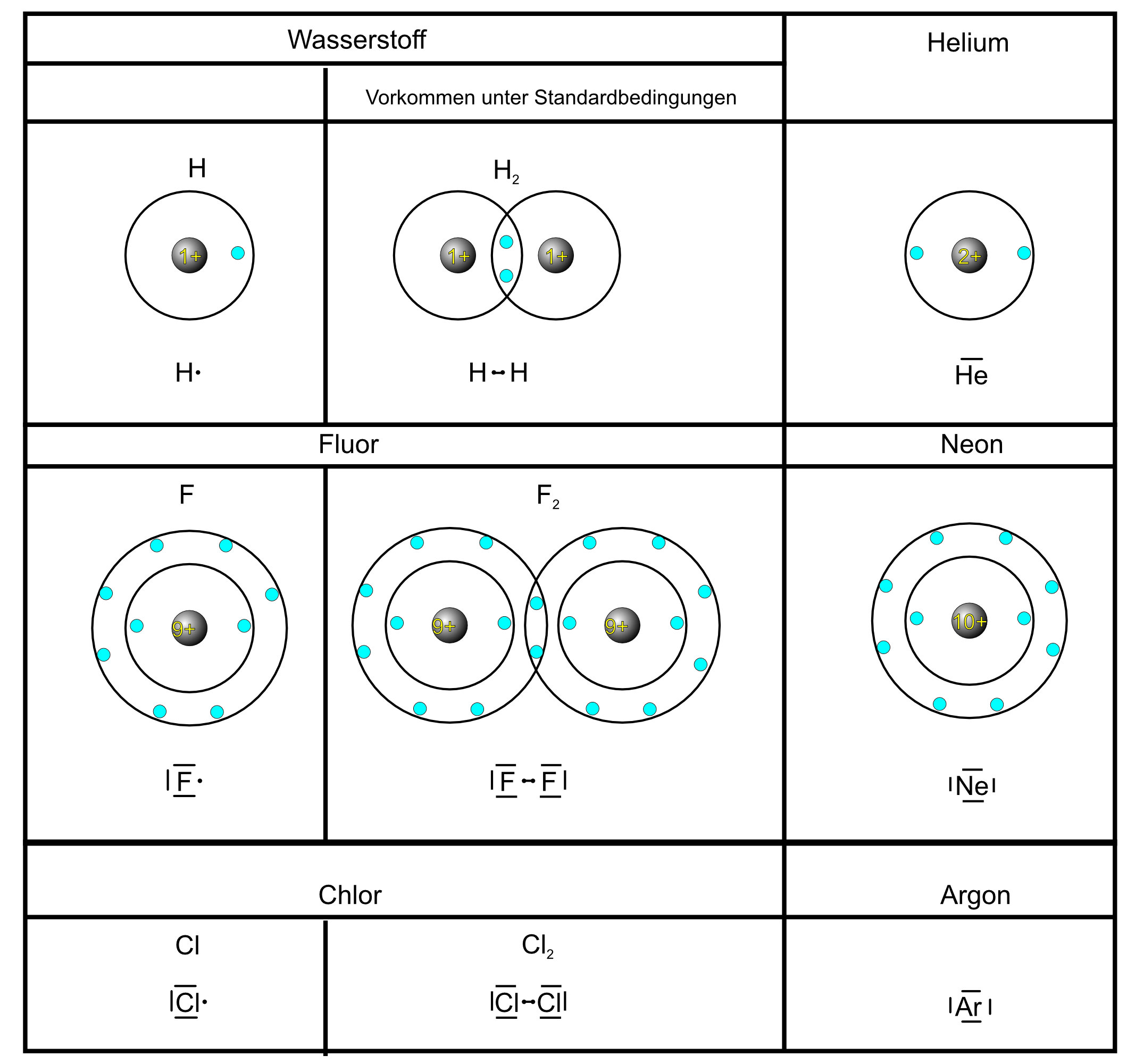
Atome mit einer voll besetzten Valenzschale sind besonders stabil und reagieren nicht gerne mit anderen Atomen. Sie sind wie kleine Könige, die alles haben, was sie brauchen und niemandem etwas geben oder von jemandem etwas nehmen müssen. Die Edelgase, wie Helium, Neon und Argon, sind perfekte Beispiele dafür. Sie haben bereits acht Elektronen (Helium hat zwei, was seiner vollen Valenzschale entspricht) in ihrer Valenzschale und sind daher sehr reaktionsträge. Sie existieren in der Natur als einzelne Atome und bilden keine Verbindungen mit anderen Atomen.
Andere Atome, die keine acht Elektronen in ihrer Valenzschale haben, sind wie kleine Abenteurer, die auf der Suche nach Vollständigkeit sind. Sie versuchen, diese acht Elektronen zu erreichen, indem sie Elektronen teilen, abgeben oder aufnehmen. Dies führt zur Bildung von chemischen Bindungen und damit zur Entstehung von Molekülen und Verbindungen.
Wie Atome die Oktettregel erreichen: Drei Wege zum Glück
Es gibt drei Hauptwege, wie Atome die Oktettregel erfüllen können:
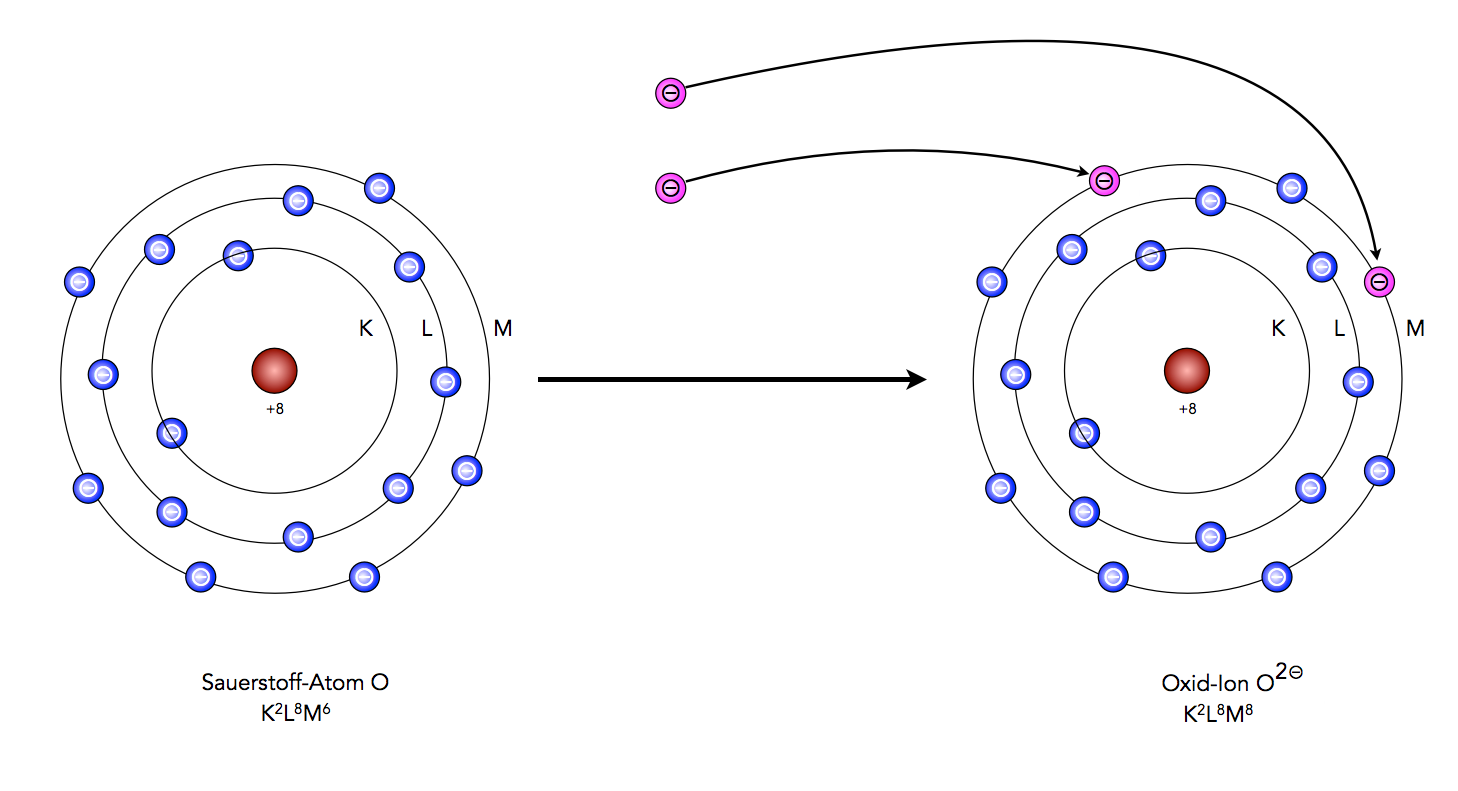
- Ionenbindung: Stell dir vor, ein Atom ist sehr stark und möchte unbedingt ein Elektron haben, während ein anderes Atom es gerne loswerden möchte. Das starke Atom "stiehlt" das Elektron vom schwachen Atom. Das starke Atom wird dadurch negativ geladen (weil es jetzt ein Elektron mehr hat) und das schwache Atom wird positiv geladen (weil es ein Elektron weniger hat). Diese geladenen Atome nennt man Ionen, und die Anziehungskraft zwischen ihnen, aufgrund ihrer unterschiedlichen Ladungen, nennt man Ionenbindung. Ein gutes Beispiel ist Natriumchlorid (Kochsalz): Natrium gibt ein Elektron an Chlor ab, wodurch beide Atome ihre Oktettregel erfüllen und eine stabile Ionenbindung bilden.
- Kovalente Bindung: Manchmal sind Atome nicht stark genug, um Elektronen zu stehlen, aber sie können sie sich teilen. Stell dir vor, zwei Atome halten sich an den Händen und teilen sich ein paar Elektronen. Dadurch haben beide Atome Zugriff auf die geteilten Elektronen und können so ihre Oktettregel erfüllen. Diese Art der Bindung nennt man kovalente Bindung oder Atombindung. Ein Beispiel ist Wasser (H2O): Sauerstoff teilt sich Elektronen mit zwei Wasserstoffatomen.
- Metallbindung: In Metallen sind die Atome eng gepackt und teilen sich ihre Valenzelektronen in einem "Elektronengas". Dieses Elektronengas ermöglicht es den Elektronen, sich frei durch das Metall zu bewegen, was Metalle zu guten Leitern von Elektrizität und Wärme macht. Diese Art der Bindung ist etwas komplexer und wird in der Regel erst später im Chemieunterricht behandelt.
Ausnahmen von der Regel: Es gibt immer Ausnahmen!
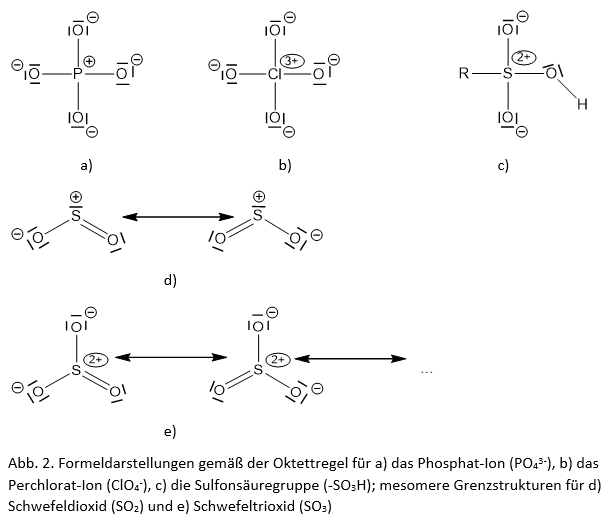
Wie bei fast jeder Regel gibt es auch bei der Oktettregel Ausnahmen. Einige Atome, wie Wasserstoff (H) und Lithium (Li), sind mit nur zwei Elektronen in ihrer Valenzschale zufrieden. Sie folgen der sogenannten Duettregel. Andere Atome, wie Bor (B), können mit weniger als acht Elektronen stabil sein, während andere, wie Schwefel (S) und Phosphor (P), mehr als acht Elektronen in ihrer Valenzschale haben können. Diese Ausnahmen zeigen, dass die Natur komplexer ist als einfache Regeln, aber die Oktettregel ist dennoch ein sehr nützliches Werkzeug, um die chemischen Eigenschaften von vielen Stoffen zu verstehen.
Die Bedeutung der Oktettregel für das Verständnis der Chemie
Die Oktettregel ist ein grundlegendes Konzept in der Chemie. Sie hilft uns zu verstehen, warum Atome sich so verhalten, wie sie es tun, und warum bestimmte chemische Reaktionen stattfinden. Sie erklärt, warum einige Stoffe stabil sind und andere reaktiv, warum einige Stoffe miteinander reagieren und andere nicht. Indem wir die Oktettregel verstehen, können wir vorhersagen, welche Verbindungen sich bilden werden und welche Eigenschaften diese Verbindungen haben werden.
Stell dir vor, du bist ein Detektiv und die Oktettregel ist dein wichtigstes Werkzeug. Du kannst sie verwenden, um die Geheimnisse der Moleküle zu lüften und herauszufinden, wie sie aufgebaut sind und warum sie sich so verhalten, wie sie es tun. Mit der Oktettregel kannst du die Welt der Atome und Moleküle besser verstehen und die Geheimnisse der Chemie entschlüsseln.
Die Oktettregel ist also nicht nur eine trockene Theorie, sondern ein Schlüssel zum Verständnis der Welt um uns herum. Sie erklärt, warum das Wasser so wichtig für uns ist, warum die Luft uns am Leben erhält und warum die verschiedenen Stoffe so unterschiedliche Eigenschaften haben. Die Oktettregel ist wie eine Landkarte, die uns durch die faszinierende Landschaft der Chemie führt.
Je mehr du über die Oktettregel und die Welt der Atome lernst, desto besser wirst du verstehen, wie alles zusammenhängt und wie die winzigsten Bausteine des Universums die Grundlage für alles bilden, was wir sehen und erleben.
![Oktettregel Einfach Erklärt Für Kinder Oktettregel · Elektronenoktett, Edelgasregel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/11/Oktettregel_WP_1-1024x576.jpg)