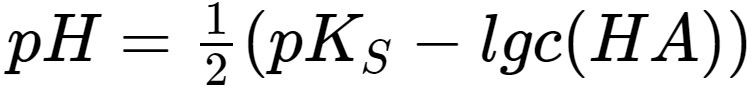Ph Wert Berechnung Schwacher Säuren

Hallo liebe Abenteurer und Wissensdurstige! Heute entführe ich euch auf eine etwas andere Reise – in die faszinierende Welt der Chemie, genauer gesagt, zur Berechnung des pH-Werts schwacher Säuren. Keine Sorge, es wird nicht langweilig oder kompliziert! Stellt euch vor, wir entdecken ein verstecktes Juwel, das auf den ersten Blick unscheinbar wirkt, aber bei näherer Betrachtung unglaubliche Geheimnisse birgt. Ähnlich wie bei einem kleinen, unscheinbaren Café in einer belebten Stadt, das den besten Kaffee der Welt serviert.
Warum erzähle ich euch das alles? Nun, auf meinen Reisen bin ich immer wieder auf Dinge gestoßen, die mich zum Nachdenken angeregt haben. Oftmals sind es die scheinbar komplexen Dinge, die, wenn man sie einmal verstanden hat, eine ganz neue Perspektive eröffnen. Und so ist es auch mit dem pH-Wert schwacher Säuren. Es mag anfangs abschreckend wirken, aber ich verspreche euch, am Ende dieser kleinen "Reise" werdet ihr einiges gelernt haben, das euch vielleicht sogar im Alltag nützlich sein wird. Und wer weiß, vielleicht könnt ihr ja sogar in einem Gespräch mit Einheimischen mit eurem neuen Wissen glänzen!
Was ist eigentlich eine schwache Säure? Eine kleine Einführung
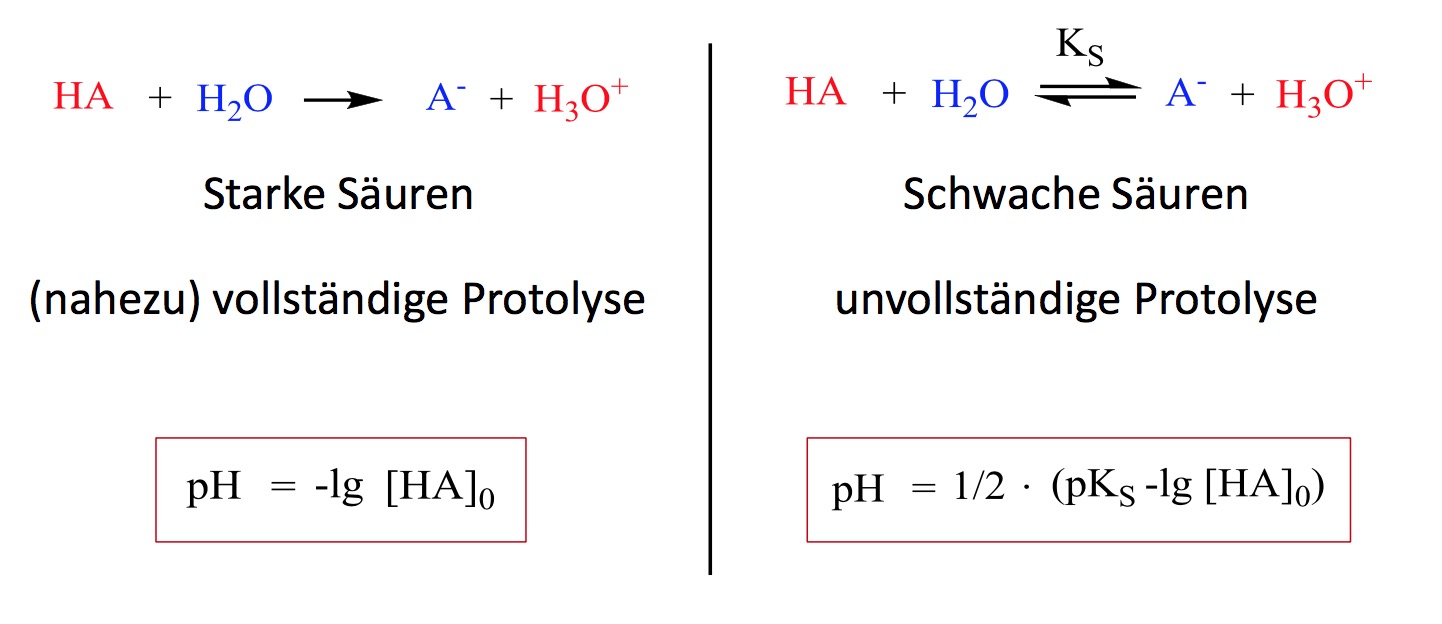
Bevor wir uns in die eigentliche Berechnung stürzen, sollten wir kurz klären, was eine schwache Säure überhaupt ist. Stellt euch vor, ihr habt zwei verschiedene Sorten Limonade. Die eine ist super sauer, die andere eher mild. Die super saure Limonade, das wäre in unserem chemischen Vergleich eine starke Säure. Sie gibt alle ihre "sauren" Zutaten (in der Chemie sind das Protonen, also H+-Ionen) bereitwillig ins Wasser ab. Die milde Limonade hingegen, die hält ihre sauren Zutaten lieber zurück. Das ist eine schwache Säure. Sie gibt nur einen Teil ihrer Protonen ab.
Chemisch ausgedrückt bedeutet das: Eine schwache Säure dissoziiert in Wasser nicht vollständig in ihre Ionen. Das heißt, ein Teil der Säure bleibt in ihrer ursprünglichen, undissoziierten Form erhalten. Im Gegensatz dazu dissoziieren starke Säuren fast vollständig.
Das Beispiel Essigsäure: Unser Reisebegleiter
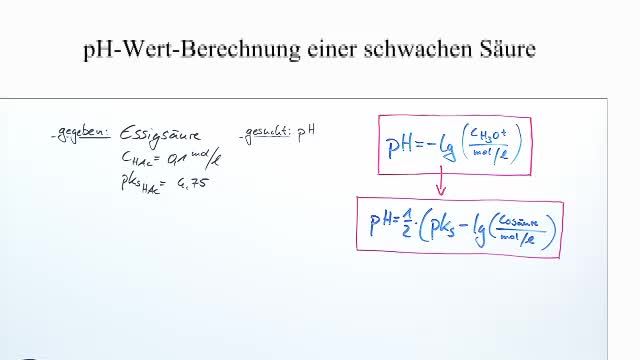
Eine der bekanntesten schwachen Säuren ist Essigsäure (CH3COOH). Sie ist der Hauptbestandteil von Essig und findet sich in vielen Lebensmitteln und Reinigungsmitteln wieder. Wir werden Essigsäure als unser Beispiel verwenden, um die pH-Wert Berechnung zu verstehen. Stellt euch vor, wir besuchen eine Essigmanufaktur in Italien! Dort lernen wir nicht nur, wie Essig hergestellt wird, sondern auch etwas über seine chemischen Eigenschaften.
Die Dissoziationsgleichung für Essigsäure sieht so aus:
CH3COOH (aq) ⇌ H+ (aq) + CH3COO- (aq)
Das ⇌-Zeichen bedeutet, dass es sich um eine reversible Reaktion handelt. Das heißt, die Reaktion kann in beide Richtungen ablaufen: Essigsäure kann Protonen abgeben (Dissoziation), aber die Protonen können sich auch wieder mit den Acetat-Ionen (CH3COO-) verbinden und Essigsäure bilden.
Der Schlüssel zur Berechnung: Die Säurekonstante (Ks)
Hier kommt ein weiterer wichtiger Begriff ins Spiel: Die Säurekonstante (Ks). Sie ist der Schlüssel zur Berechnung des pH-Werts schwacher Säuren. Die Säurekonstante beschreibt das Verhältnis zwischen den Konzentrationen der dissoziierten und undissoziierten Form der Säure im Gleichgewicht. Je kleiner der Ks-Wert, desto schwächer ist die Säure.
Für die Dissoziation der Essigsäure sieht die Gleichung für die Säurekonstante so aus:
Ks = [H+] * [CH3COO-] / [CH3COOH]
Dabei stehen die eckigen Klammern für die Konzentrationen der jeweiligen Stoffe im Gleichgewicht.
Der Ks-Wert für Essigsäure beträgt etwa 1,8 x 10-5. Das bedeutet, dass bei einer bestimmten Konzentration von Essigsäure nur ein sehr kleiner Teil davon in Ionen dissoziiert. Im Vergleich dazu haben starke Säuren sehr hohe Ks-Werte.
Die pH-Wert Berechnung: Schritt für Schritt
Nun sind wir bereit für die eigentliche pH-Wert Berechnung. Keine Panik, es ist einfacher als es aussieht! Wir werden uns ein kleines Beispiel ansehen, um das Ganze zu veranschaulichen.
Beispiel: Berechne den pH-Wert einer 0,1 mol/L Essigsäure-Lösung.
- Aufstellen des Reaktionsschemas:
Wir haben bereits die Dissoziationsgleichung:
CH3COOH (aq) ⇌ H+ (aq) + CH3COO- (aq)
- Aufstellen einer Tabelle (das sogenannte "ICE"-Schema):
ICE steht für Initial (Anfangskonzentration), Change (Änderung) und Equilibrium (Gleichgewichtskonzentration).
CH3COOH H+ CH3COO- Initial 0,1 0 0 Change -x +x +x Equilibrium 0,1 - x x x Dabei steht "x" für die Konzentration der dissoziierten Essigsäure im Gleichgewicht.
- Aufstellen der Gleichung für Ks:
Ks = [H+] * [CH3COO-] / [CH3COOH]
Wir setzen die Gleichgewichtskonzentrationen aus der Tabelle ein:
1,8 x 10-5 = x * x / (0,1 - x)
- Vereinfachung:
Da Essigsäure eine schwache Säure ist, ist die Dissoziation sehr gering. Das bedeutet, dass "x" im Vergleich zu 0,1 sehr klein ist. Daher können wir "x" im Nenner vernachlässigen:
1,8 x 10-5 ≈ x2 / 0,1
- Lösen nach "x":
x2 ≈ 1,8 x 10-6
x ≈ √(1,8 x 10-6) ≈ 1,34 x 10-3 mol/L
"x" entspricht der Konzentration der H+-Ionen im Gleichgewicht: [H+] = 1,34 x 10-3 mol/L
- Berechnung des pH-Werts:
Der pH-Wert ist definiert als der negative dekadische Logarithmus der H+-Ionenkonzentration:
pH = -log10[H+]
pH = -log10(1,34 x 10-3)
pH ≈ 2,87
Der pH-Wert einer 0,1 mol/L Essigsäure-Lösung beträgt also etwa 2,87. Das bedeutet, die Lösung ist sauer, aber nicht so stark sauer wie beispielsweise Salzsäure.
Noch ein paar Tipps und Tricks
Die Vereinfachung, "x" im Nenner zu vernachlässigen, ist nicht immer erlaubt. Es gibt eine Faustregel: Wenn die Anfangskonzentration der Säure mindestens 100-mal größer ist als der Ks-Wert, dann ist die Vereinfachung gerechtfertigt. In unserem Beispiel ist das der Fall (0,1 > 100 * 1,8 x 10-5).
Wenn die Vereinfachung nicht möglich ist, muss die quadratische Gleichung gelöst werden. Das kann etwas aufwendiger sein, aber mit einem Taschenrechner oder einem Online-Tool ist das kein Problem.
Warum ist das alles wichtig?
Ihr fragt euch vielleicht, warum ihr das alles wissen solltet. Nun, das Verständnis des pH-Werts und der Säurekonstante ist wichtig in vielen Bereichen:
- Lebensmittelchemie: Bei der Herstellung von Lebensmitteln wie Joghurt, Käse oder Sauerkraut spielt der pH-Wert eine entscheidende Rolle.
- Medizin: Der pH-Wert des Blutes muss konstant gehalten werden, um lebenswichtige Funktionen aufrechtzuerhalten.
- Umweltchemie: Der pH-Wert von Böden und Gewässern beeinflusst das Wachstum von Pflanzen und Tieren.
- Analytische Chemie: Bei vielen chemischen Analysen ist die Kenntnis des pH-Werts unerlässlich.
Also, das nächste Mal, wenn ihr ein saures Lebensmittel probiert oder von einem Chemiker hört, der über pH-Werte spricht, könnt ihr mitreden und euer neu gewonnenes Wissen einbringen. Und wer weiß, vielleicht inspiriert euch diese kleine "chemische Reise" ja sogar dazu, noch mehr über die faszinierende Welt der Chemie zu lernen! So wie ich auf meinen Reisen immer wieder neue Dinge entdecke, die mich begeistern.
Ich hoffe, diese kleine Reise in die Welt der pH-Wert Berechnung schwacher Säuren hat euch gefallen und ihr habt etwas Neues gelernt. Bis zum nächsten Abenteuer!