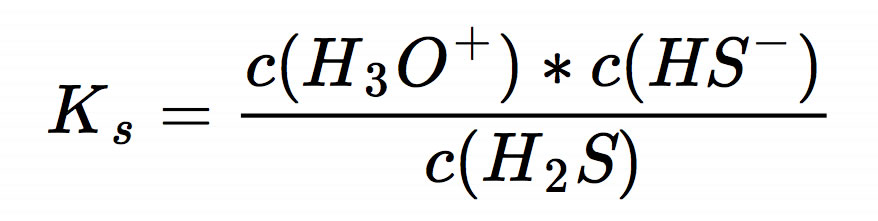Ph Wert Schwache Säure Formel

Herzlich willkommen! Wenn du dich für einen Kurztrip oder einen längeren Aufenthalt in einem deutschsprachigen Land befindest und zufällig über das Thema "pH-Wert schwacher Säuren" stolperst, bist du hier genau richtig. Keine Angst, du musst kein Chemie-Genie sein, um das zu verstehen. Wir erklären dir alles ganz einfach und verständlich, damit du bei Gesprächen mit Einheimischen mitreden kannst oder einfach nur dein Wissen erweitern möchtest. Los geht's!
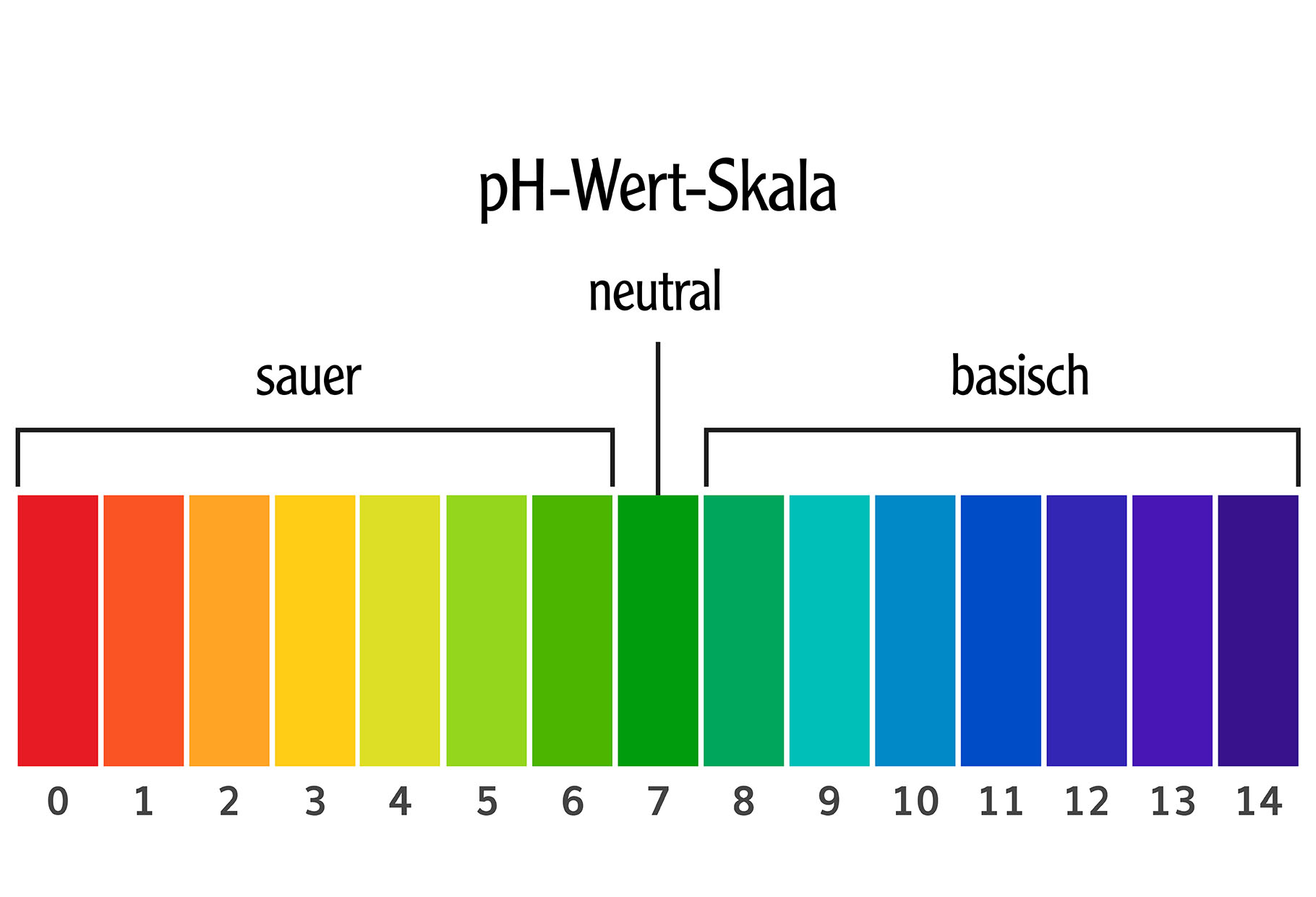
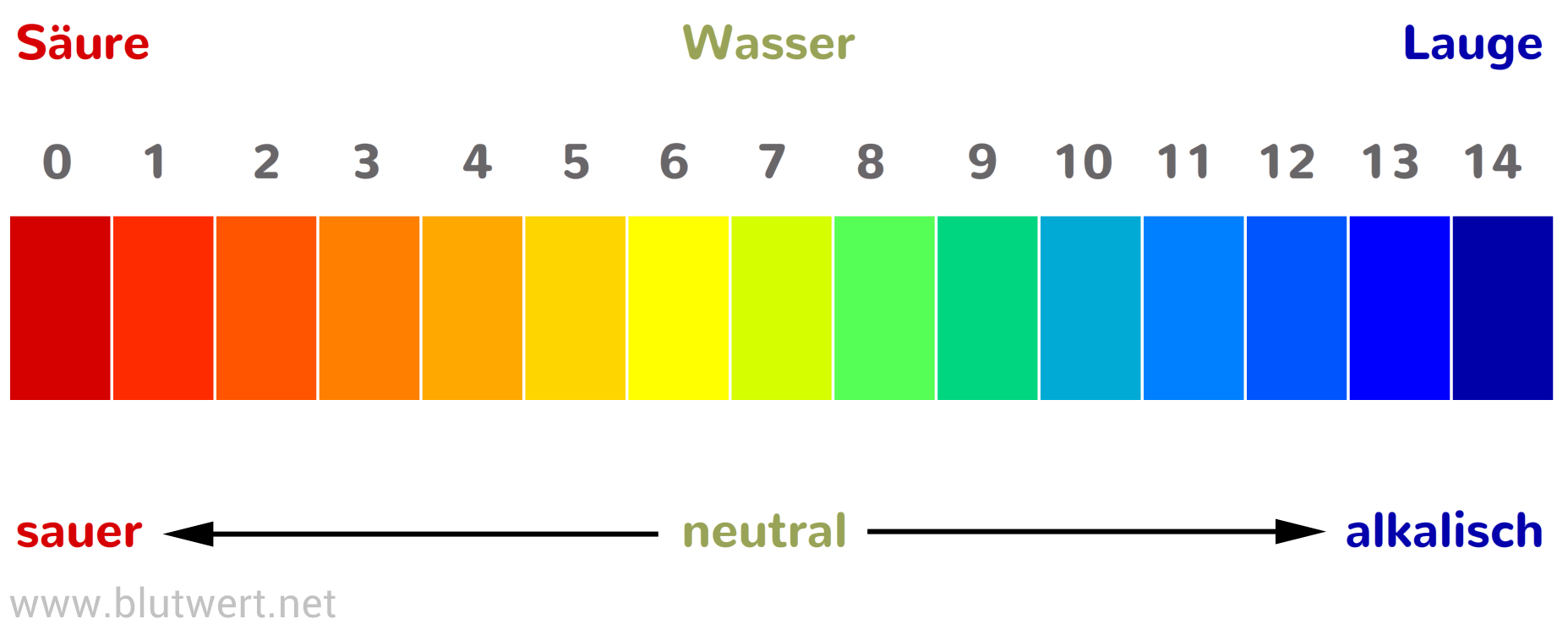
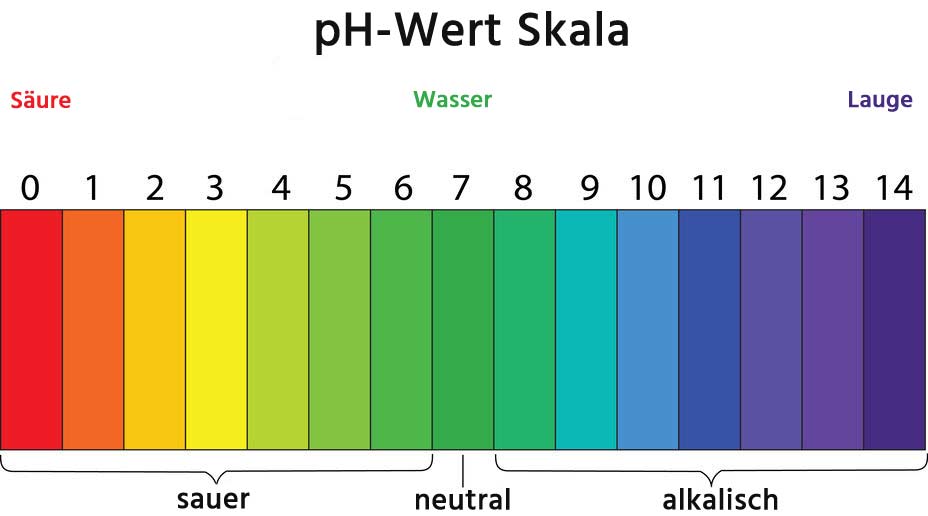
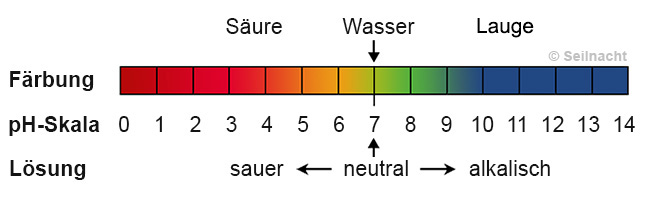
Was ist eigentlich der pH-Wert?
Stell dir den pH-Wert wie eine Skala vor, die von 0 bis 14 reicht. Sie zeigt an, wie sauer oder basisch (auch alkalisch genannt) eine Lösung ist. Eine Lösung mit einem pH-Wert von 7 ist neutral, wie reines Wasser. Werte unter 7 bedeuten, dass die Lösung sauer ist, und Werte über 7 bedeuten, dass sie basisch ist. Je niedriger der pH-Wert, desto saurer ist die Lösung, und je höher der pH-Wert, desto basischer ist sie.
Du kennst bestimmt einige saure und basische Substanzen aus dem Alltag: Zitronensaft ist sauer (pH-Wert etwa 2), während Seife basisch ist (pH-Wert etwa 9-10).
Säuren: Stark und Schwach
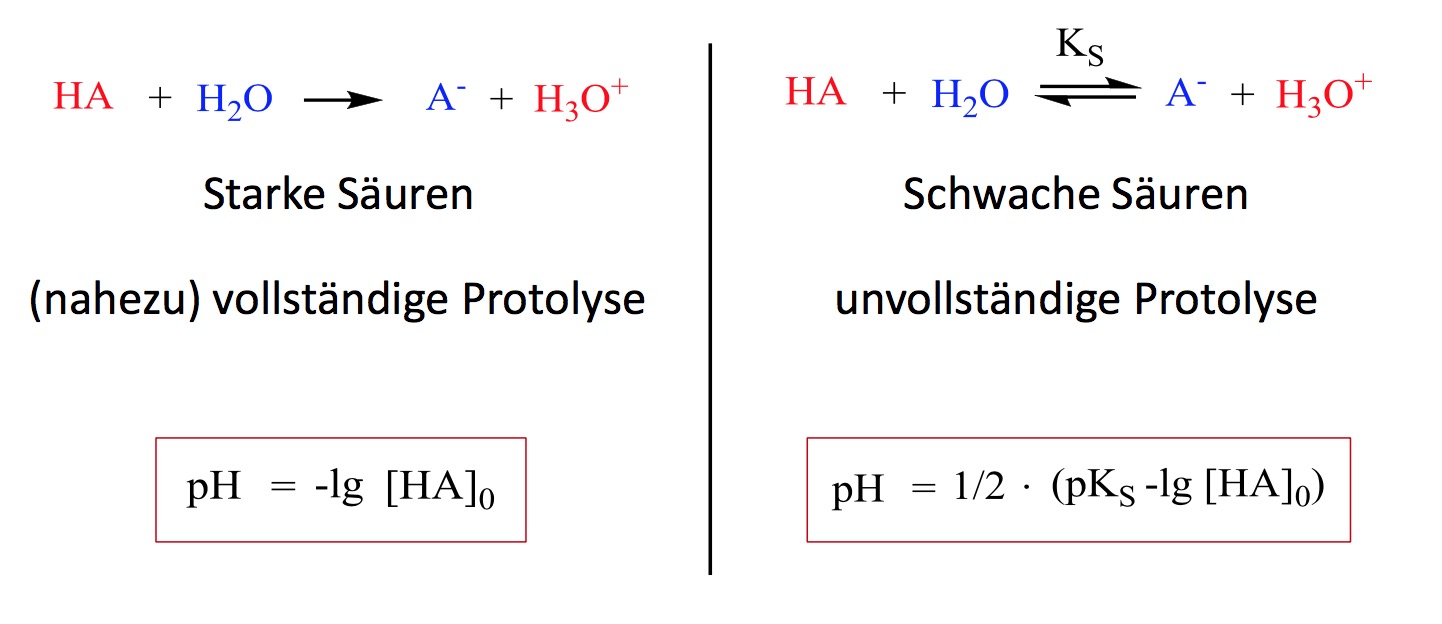
Säuren sind Stoffe, die in Wasser Protonen (H+-Ionen) abgeben können. Dabei unterscheidet man grundsätzlich zwischen starken und schwachen Säuren. Der Unterschied liegt in der Art und Weise, wie sie in Wasser reagieren.
- Starke Säuren: Starke Säuren zerfallen vollständig in Wasser in ihre Ionen. Das bedeutet, dass fast jedes Säuremolekül ein Proton abgibt. Salzsäure (HCl) ist ein typisches Beispiel für eine starke Säure.
- Schwache Säuren: Schwache Säuren zerfallen nur teilweise in Wasser in ihre Ionen. Das bedeutet, dass ein Großteil der Säuremoleküle intakt bleibt und nicht protoniert wird. Essigsäure (CH3COOH), die in Essig vorkommt, ist ein gutes Beispiel für eine schwache Säure.
Der Unterschied in der Dissoziation (Zerfall in Ionen) ist entscheidend für den pH-Wert der Lösung.
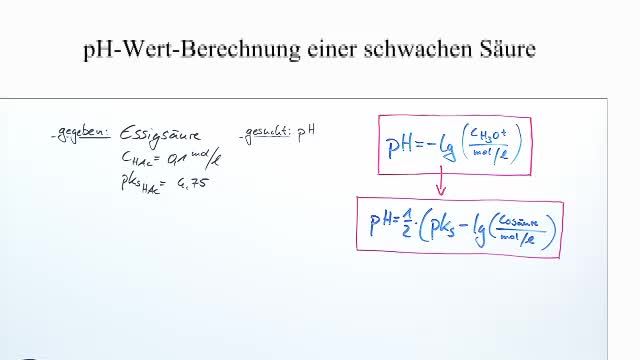
Die pH-Wert Berechnung bei Schwachen Säuren: Die Formel
Die Berechnung des pH-Wertes einer schwachen Säure ist etwas komplizierter als bei einer starken Säure, da wir berücksichtigen müssen, dass die Säure nicht vollständig dissoziiert. Hier kommt die Säurekonstante Ks ins Spiel.
Was ist die Säurekonstante (Ks)?
Die Säurekonstante Ks ist ein Maß dafür, wie stark eine Säure ist. Sie gibt an, in welchem Umfang eine Säure in Wasser dissoziiert. Je größer der Wert von Ks, desto stärker ist die Säure. Für schwache Säuren ist Ks immer sehr klein, da sie nur wenig dissoziieren.
Die Säurekonstante ist definiert als:
Ks = [H+] [A-] / [HA]
Wobei:
- [H+] die Konzentration der Wasserstoffionen (Protonen) ist.
- [A-] die Konzentration der konjugierten Base ist (das, was von der Säure übrigbleibt, nachdem sie ein Proton abgegeben hat).
- [HA] die Konzentration der undissoziierten Säure ist.
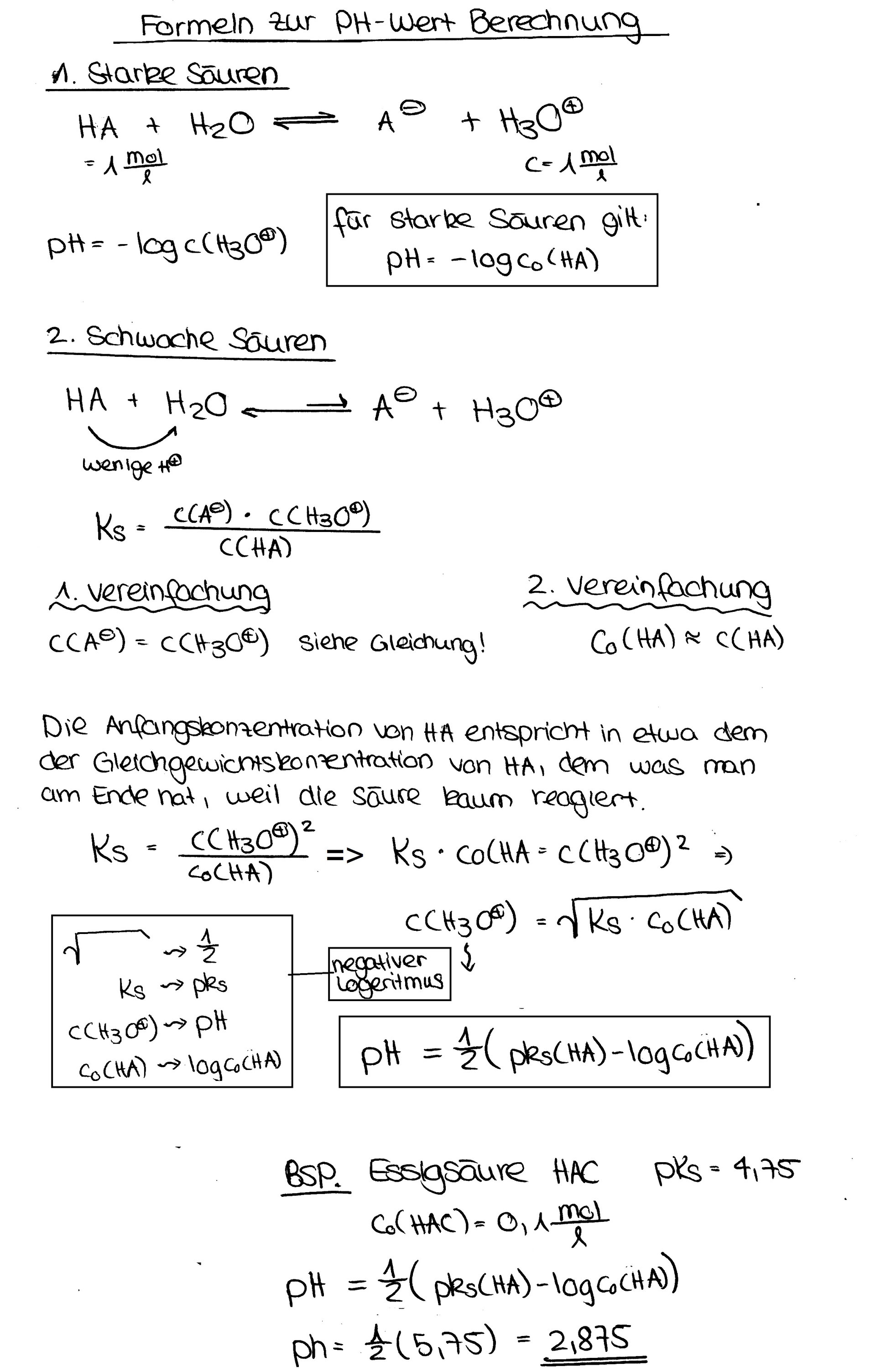
Die Herleitung der pH-Wert Formel
Um den pH-Wert einer schwachen Säure zu berechnen, müssen wir einige Vereinfachungen vornehmen. Wir gehen davon aus, dass die Konzentration der Wasserstoffionen [H+] und die Konzentration der konjugierten Base [A-] gleich sind (da jedes dissoziierte Säuremolekül ein H+-Ion und ein A--Ion erzeugt). Außerdem gehen wir davon aus, dass die Konzentration der undissoziierten Säure [HA] ungefähr gleich der ursprünglichen Konzentration der Säure (c0) ist, da nur ein kleiner Teil der Säure dissoziiert.
Mit diesen Vereinfachungen können wir die Säurekonstante wie folgt schreiben:
Ks ≈ [H+]2 / c0
Um die Konzentration der Wasserstoffionen [H+] zu berechnen, lösen wir die Gleichung nach [H+] auf:
[H+] ≈ √(Ks * c0)
Da der pH-Wert definiert ist als der negative dekadische Logarithmus der Wasserstoffionenkonzentration (pH = -log10[H+]), erhalten wir die Formel zur Berechnung des pH-Wertes einer schwachen Säure:
pH ≈ -log10(√(Ks * c0))
Oder, etwas anders geschrieben:
pH ≈ 0.5 * (pKs - log10(c0))
Wobei pKs = -log10(Ks) ist.
Ein Beispiel zur Veranschaulichung
Nehmen wir an, wir haben eine Essigsäurelösung mit einer Konzentration von 0,1 mol/L (c0 = 0,1 mol/L). Die Säurekonstante von Essigsäure beträgt Ks = 1,8 * 10-5. Berechnen wir den pH-Wert:
- Berechne die Konzentration der Wasserstoffionen:
[H+] ≈ √(1,8 * 10-5 * 0,1) ≈ √(1,8 * 10-6) ≈ 0,00134 mol/L - Berechne den pH-Wert:
pH ≈ -log10(0,00134) ≈ 2,87
Der pH-Wert der Essigsäurelösung beträgt also etwa 2,87. Das ist deutlich saurer als reines Wasser (pH 7), aber nicht so sauer wie eine starke Säure wie Salzsäure.
Wichtige Hinweise und Vereinfachungen
Es ist wichtig zu beachten, dass die oben genannten Formeln Vereinfachungen darstellen. Sie funktionieren gut, wenn die Säure schwach ist und die Konzentration nicht zu gering ist. Bei sehr schwachen Säuren oder sehr verdünnten Lösungen müssen komplexere Berechnungen durchgeführt werden, die die Autoprotolyse des Wassers berücksichtigen (d.h. die Tatsache, dass Wasser selbst in geringem Maße in H+ und OH- Ionen zerfällt). Für die meisten alltagsrelevanten Situationen sind die vereinfachten Formeln jedoch ausreichend.
pH-Wert im Alltag in Deutschland, Österreich und der Schweiz
Der pH-Wert spielt in vielen Bereichen des täglichen Lebens in deutschsprachigen Ländern eine Rolle:
- Lebensmittel: Die Säure von Lebensmitteln beeinflusst ihren Geschmack und ihre Haltbarkeit. Beispielsweise wird Essig (enthält Essigsäure) verwendet, um Lebensmittel zu konservieren.
- Wasserqualität: Der pH-Wert von Trinkwasser wird regelmäßig überwacht, um sicherzustellen, dass er im optimalen Bereich liegt (in der Regel zwischen 6,5 und 8,5).
- Körperpflege: Der pH-Wert von Hautpflegeprodukten ist wichtig, um die natürliche Schutzbarriere der Haut zu erhalten.
- Gartenbau: Der pH-Wert des Bodens beeinflusst das Wachstum von Pflanzen. Viele Pflanzen bevorzugen einen leicht sauren Boden.
Du wirst vielleicht feststellen, dass viele Produkte in deutschen Supermärkten den pH-Wert angeben, besonders bei Hautpflegeprodukten und Reinigungsmitteln. Achte einfach mal darauf!
Zusammenfassung und Fazit
Die Berechnung des pH-Wertes einer schwachen Säure erfordert die Berücksichtigung der Säurekonstante Ks und der Konzentration der Säure. Die vereinfachte Formel pH ≈ -log10(√(Ks * c0)) ermöglicht es uns, den pH-Wert relativ einfach zu bestimmen. Obwohl die Berechnungen auf Vereinfachungen beruhen, liefern sie in vielen Fällen gute Ergebnisse.
Ich hoffe, diese Erklärung hat dir geholfen, das Thema pH-Wert schwacher Säuren besser zu verstehen! Viel Spaß beim Entdecken der deutschsprachigen Länder!
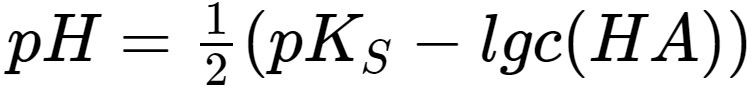


![Ph Wert Schwache Säure Formel pH Wert • Definition, Skala, Tabelle, Bedeutung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/04/pH-Wert-Farbskala-1024x576.png)