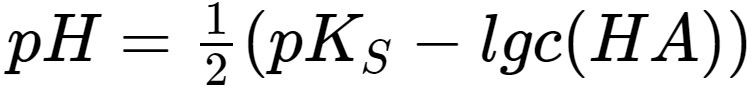Ph Wert Von Schwachen Säuren

Herzlich Willkommen in Deutschland! Vielleicht bist du gerade erst angekommen, planst einen Kurzaufenthalt oder bist schon länger hier. Egal, wie lange du bleibst, es ist immer gut, ein paar grundlegende Dinge über das Land zu wissen. Heute tauchen wir in ein Thema ein, das vielleicht nicht sofort auf deiner Sightseeing-Liste steht, aber durchaus relevant sein kann: den pH-Wert von schwachen Säuren. Keine Sorge, wir machen es nicht zu kompliziert! Denk eher an eine kleine, nützliche Wissenslücke, die dir im Alltag begegnen könnte, zum Beispiel beim Kochen, Putzen oder sogar beim Verständnis einiger lokaler Produkte.
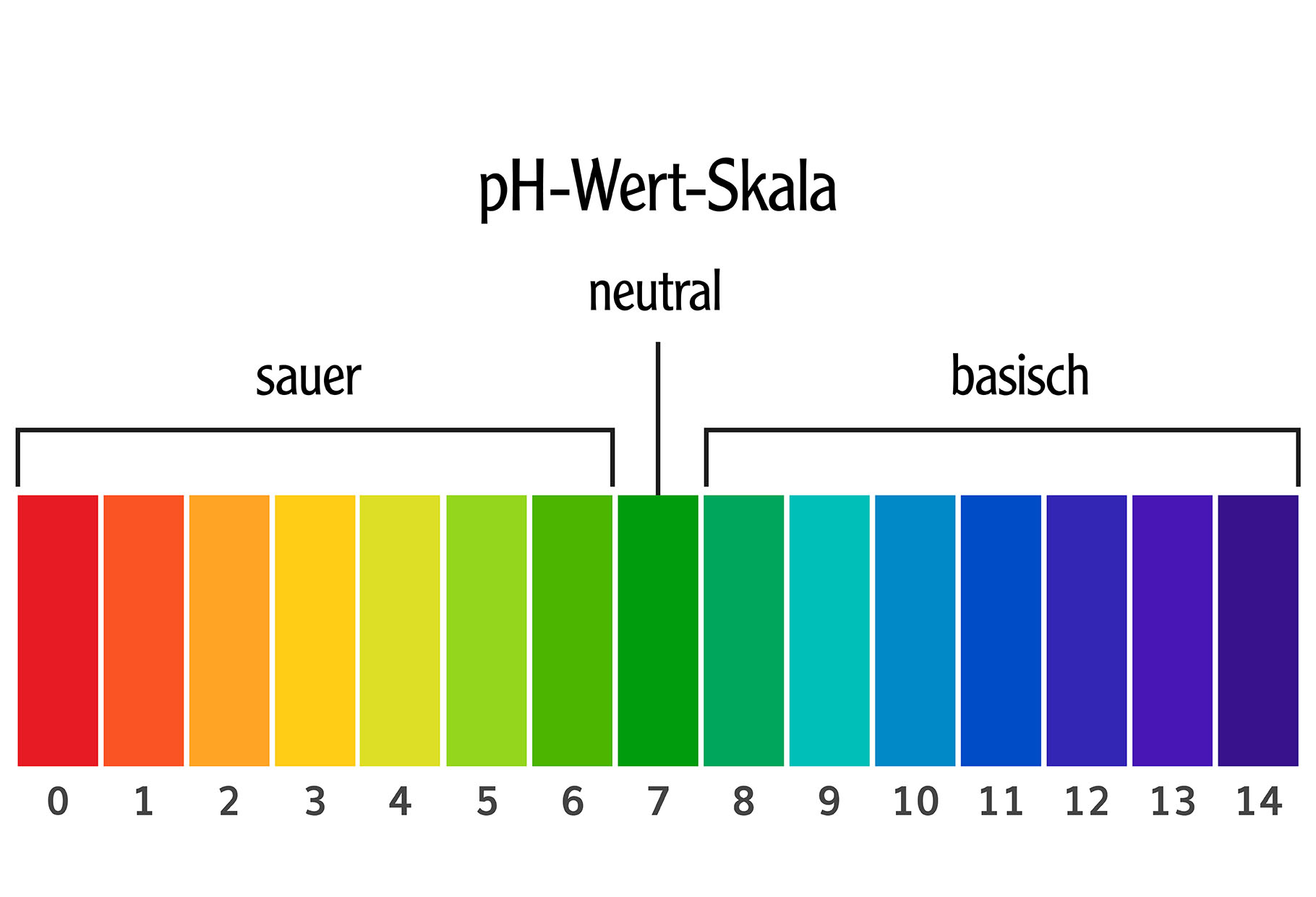
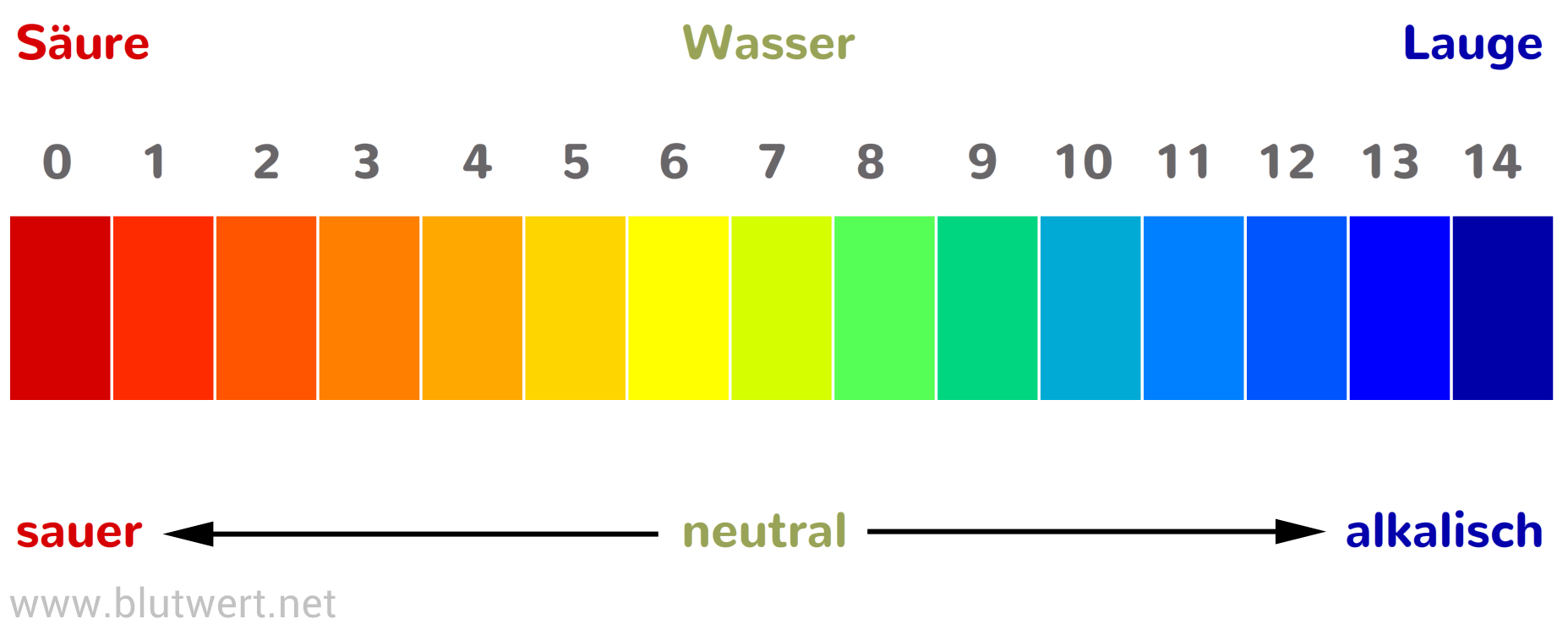
Was ist der pH-Wert überhaupt?
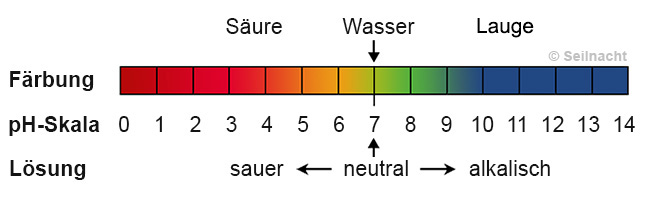
Stell dir vor, der pH-Wert ist eine Skala, die von 0 bis 14 reicht. Sie sagt uns, ob eine Lösung sauer, neutral oder basisch (auch alkalisch genannt) ist. Ein pH-Wert von 7 ist neutral, alles darunter ist sauer, und alles darüber ist basisch. Je niedriger der Wert, desto saurer ist die Lösung, und je höher der Wert, desto basischer ist sie.
Du kennst das vielleicht schon aus dem Chemieunterricht, aber lass uns das nochmal kurz auffrischen: Der pH-Wert misst die Konzentration von Wasserstoffionen (H+) in einer Lösung. Viele H+ Ionen bedeuten eine saure Lösung (niedriger pH-Wert), wenige H+ Ionen bedeuten eine basische Lösung (hoher pH-Wert).
Säuren: Stark vs. Schwach
Nicht alle Säuren sind gleich! Es gibt starke und schwache Säuren. Der Unterschied liegt darin, wie gut sie in Wasser dissoziieren, das heißt, wie gut sie ihre Protonen (H+) abgeben.
Starke Säuren dissoziieren fast vollständig in Wasser. Das bedeutet, dass fast alle Säuremoleküle ihre Protonen abgeben und zu H+ Ionen werden. Beispiele für starke Säuren sind Salzsäure (HCl) und Schwefelsäure (H2SO4). Sei vorsichtig mit diesen! Sie sind ätzend und können gefährlich sein.
Schwache Säuren hingegen dissoziieren nur teilweise in Wasser. Nur ein kleiner Teil der Säuremoleküle gibt seine Protonen ab. Das bedeutet, dass in der Lösung ein Gleichgewicht zwischen den undissoziierten Säuremolekülen und den H+ Ionen besteht. Beispiele für schwache Säuren sind Essigsäure (CH3COOH, der Hauptbestandteil von Essig) und Zitronensäure (C6H8O7, die in Zitrusfrüchten vorkommt).
Merke dir: Schwache Säuren sind in der Regel weniger ätzend als starke Säuren, aber das bedeutet nicht, dass sie harmlos sind. Auch hier ist Vorsicht geboten, besonders bei konzentrierten Lösungen.
Der pH-Wert von schwachen Säuren: Warum ist er besonders?
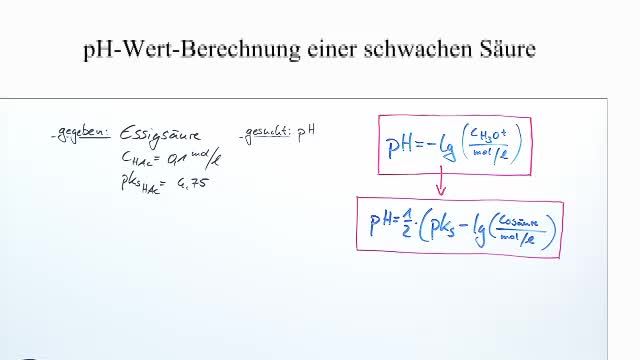
Die Berechnung des pH-Wertes einer starken Säure ist relativ einfach, da wir davon ausgehen können, dass sie vollständig dissoziiert ist. Bei schwachen Säuren ist das etwas komplizierter, weil wir die Dissoziation berücksichtigen müssen. Da nur ein Teil der Säuremoleküle H+ Ionen freisetzt, hängt der pH-Wert nicht nur von der Konzentration der Säure ab, sondern auch von ihrer Säurekonstante (Ka).
Die Säurekonstante (Ka) ist ein Maß dafür, wie stark eine Säure ist. Je größer der Ka-Wert, desto stärker ist die Säure (innerhalb der schwachen Säuren). Ein kleinerer Ka-Wert bedeutet, dass die Säure weniger stark ist und weniger H+ Ionen freisetzt.
Die Formel zur Berechnung des pH-Wertes einer schwachen Säure sieht folgendermaßen aus (keine Sorge, du musst das nicht auswendig lernen!):
pH = -log10√(Ka * c)
Wobei:
- Ka die Säurekonstante ist
- c die Konzentration der Säure ist
Diese Formel gilt für einfache, monoprotische Säuren (Säuren, die nur ein Proton abgeben können). Bei mehrprotonigen Säuren (z.B. Zitronensäure, die drei Protonen abgeben kann) ist die Berechnung komplexer.
Beispiele aus dem Alltag in Deutschland
Wo begegnest du in Deutschland schwachen Säuren?
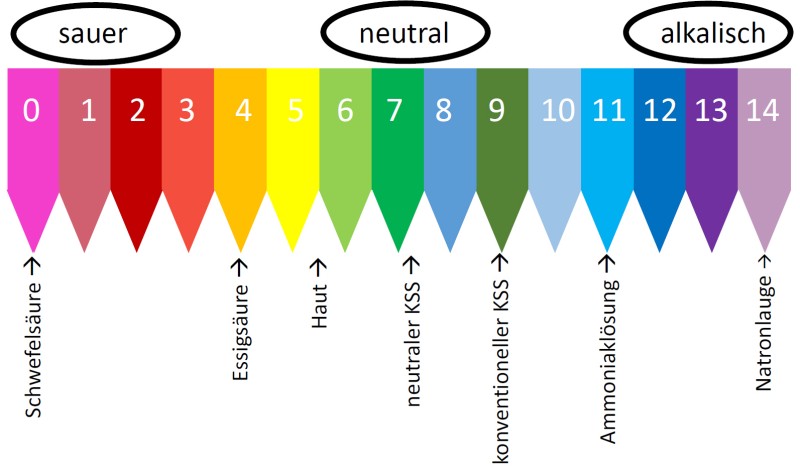
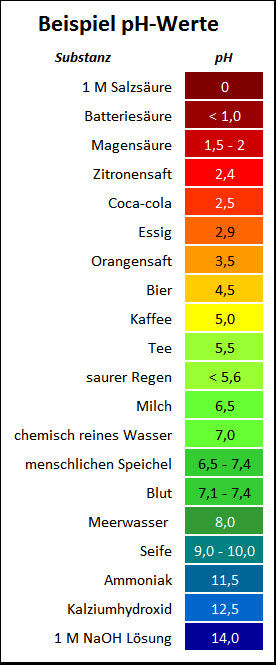
- Essig: Wie bereits erwähnt, ist Essigsäure der Hauptbestandteil von Essig. Essig wird häufig zum Kochen (z.B. für Salatdressings, Marinaden oder zum Einlegen von Gemüse), aber auch zum Putzen (z.B. als Kalklöser) verwendet. Die Stärke des Essigs, also die Konzentration der Essigsäure, beeinflusst natürlich den pH-Wert.
- Zitronensaft: Zitronensaft enthält Zitronensäure und wird ebenfalls zum Kochen und Backen verwendet. Er kann auch als natürliches Bleichmittel oder Fleckenentferner dienen.
- Joghurt und Sauerkraut: Durch Fermentation entstehen in Joghurt und Sauerkraut Milchsäure. Diese trägt zum sauren Geschmack bei und wirkt konservierend.
- Reinigungsmittel: Einige Reinigungsmittel enthalten schwache Säuren, um Kalkablagerungen oder andere Verschmutzungen zu lösen. Achte immer auf die Hinweise auf der Verpackung und trage gegebenenfalls Handschuhe.
- Hautpflegeprodukte: Viele Hautpflegeprodukte, wie z.B. Peelings oder Tonics, enthalten schwache Säuren (z.B. AHA-Säuren oder BHA-Säuren), um abgestorbene Hautzellen zu entfernen und das Hautbild zu verbessern.
Warum ist das für dich als Tourist oder Expat relevant?
Auch wenn du nicht vorhast, chemische Experimente durchzuführen, kann das Wissen über den pH-Wert von schwachen Säuren in einigen Situationen nützlich sein:
- Kochen: Wenn du deutsche Rezepte ausprobierst, stößt du vielleicht auf Zutaten wie Essig oder Zitronensaft. Das Verständnis ihrer Säure kann dir helfen, die Mengen richtig zu dosieren und den Geschmack deiner Gerichte zu optimieren.
- Putzen: Essig ist ein beliebtes und umweltfreundliches Reinigungsmittel in Deutschland. Wenn du deine Unterkunft sauber halten möchtest, kann Essig ein nützlicher Helfer sein.
- Hautpflege: Wenn du Hautpflegeprodukte kaufst, achte auf die Inhaltsstoffe. Wenn du empfindliche Haut hast, solltest du Produkte mit sehr sauren Inhaltsstoffen vermeiden.
- Lebensmittelkonservierung: Das Einlegen von Gemüse in Essig oder das Fermentieren von Sauerkraut sind traditionelle Methoden der Lebensmittelkonservierung in Deutschland. Das Verständnis der Säure hilft dir, die Haltbarkeit und Sicherheit dieser Lebensmittel besser einzuschätzen.
- Umgang mit Reinigungsmitteln: Wenn du in Deutschland putzt, ist es wichtig zu wissen, ob ein Produkt Säure enthält. Dies kann dir helfen, zu verstehen, wie du es richtig einsetzt und dich davor zu schützen, dich zu verletzen.
Sicherheitshinweise
Egal, ob es sich um starke oder schwache Säuren handelt, beachte immer die folgenden Sicherheitshinweise:
- Lies die Etiketten: Informiere dich immer über die Inhaltsstoffe und Sicherheitshinweise auf den Produkten, die du verwendest.
- Trage Handschuhe: Beim Umgang mit konzentrierten Säuren oder Reinigungsmitteln solltest du immer Handschuhe tragen, um deine Haut zu schützen.
- Vermeide Augenkontakt: Säuren können die Augen reizen. Wenn Säure in die Augen gelangt, spüle sie sofort mit viel Wasser aus und suche einen Arzt auf.
- Nicht mischen: Mische niemals verschiedene Reinigungsmittel oder Chemikalien miteinander, da dies gefährliche Reaktionen auslösen kann.
- Gut lüften: Sorge beim Umgang mit Säuren oder Reinigungsmitteln für eine gute Belüftung.
- Kindersicher aufbewahren: Bewahre alle Chemikalien und Reinigungsmittel außerhalb der Reichweite von Kindern auf.
Fazit
Der pH-Wert von schwachen Säuren mag auf den ersten Blick kompliziert erscheinen, aber mit ein paar grundlegenden Kenntnissen kannst du ihn im Alltag besser verstehen und einschätzen. Ob beim Kochen, Putzen oder bei der Auswahl von Hautpflegeprodukten – ein bisschen Wissen über Säuren und Basen kann dir in Deutschland (und natürlich auch anderswo!) von Nutzen sein. Und keine Sorge, du musst kein Chemieexperte sein, um dich hier zurechtzufinden. Genieße deinen Aufenthalt und entdecke die Vielfalt Deutschlands – und vielleicht achtest du ja jetzt ein bisschen genauer auf die Zutatenliste im Supermarkt oder die Inhaltsstoffe deines Lieblingsreinigers!
Wir hoffen, dieser kleine Ausflug in die Welt der schwachen Säuren war informativ und hilfreich für dich. Willkommen in Deutschland!