Ph Wert Von Starken Säuren Berechnen

Die Berechnung des pH-Werts starker Säuren ist ein fundamentales Konzept in der Chemie, das weit über reine Formelanwendung hinausgeht. Es berührt das Verständnis der Protolyse, der Ionenstärke und der Dissoziationskonstanten. Dieser Artikel widmet sich einer detaillierten Betrachtung der pH-Wert Berechnung starker Säuren, indem er sowohl die theoretischen Grundlagen als auch praktische Beispiele einbezieht. Wir werden dabei aufzeigen, wie die einfache Formel pH = -log[H+] in der Realität durch Faktoren beeinflusst werden kann, die oft übersehen werden.
Grundlagen der Säure-Base-Chemie
Bevor wir uns der Berechnung des pH-Werts starker Säuren zuwenden, ist es wichtig, die grundlegenden Definitionen und Konzepte der Säure-Base-Chemie zu rekapitulieren. Eine Säure ist nach der klassischen Definition von Arrhenius eine Substanz, die in wässriger Lösung Wasserstoffionen (H+) freisetzt. Nach der umfassenderen Definition von Brønsted-Lowry ist eine Säure ein Protonendonator. Eine Base hingegen ist ein Protonenakzeptor. Diese Definition ist besonders nützlich, da sie auch Reaktionen in nicht-wässrigen Lösungsmitteln berücksichtigt.
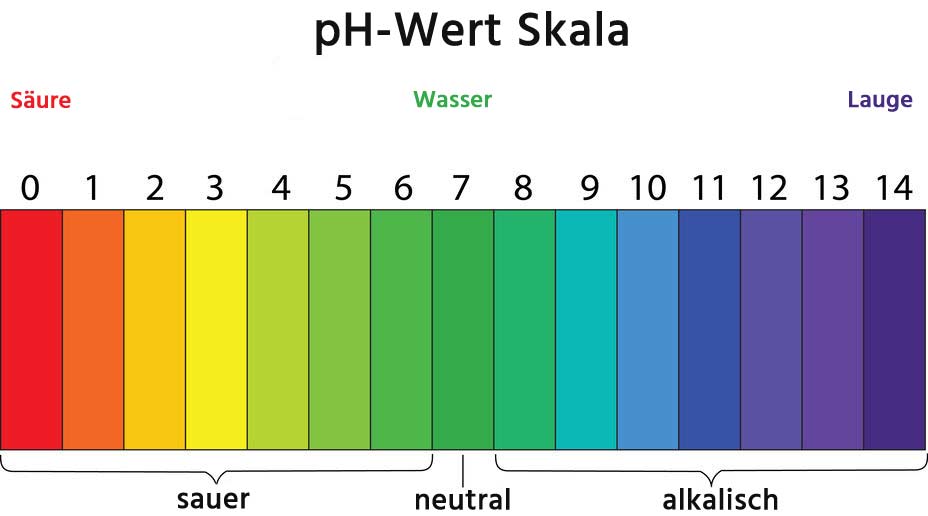
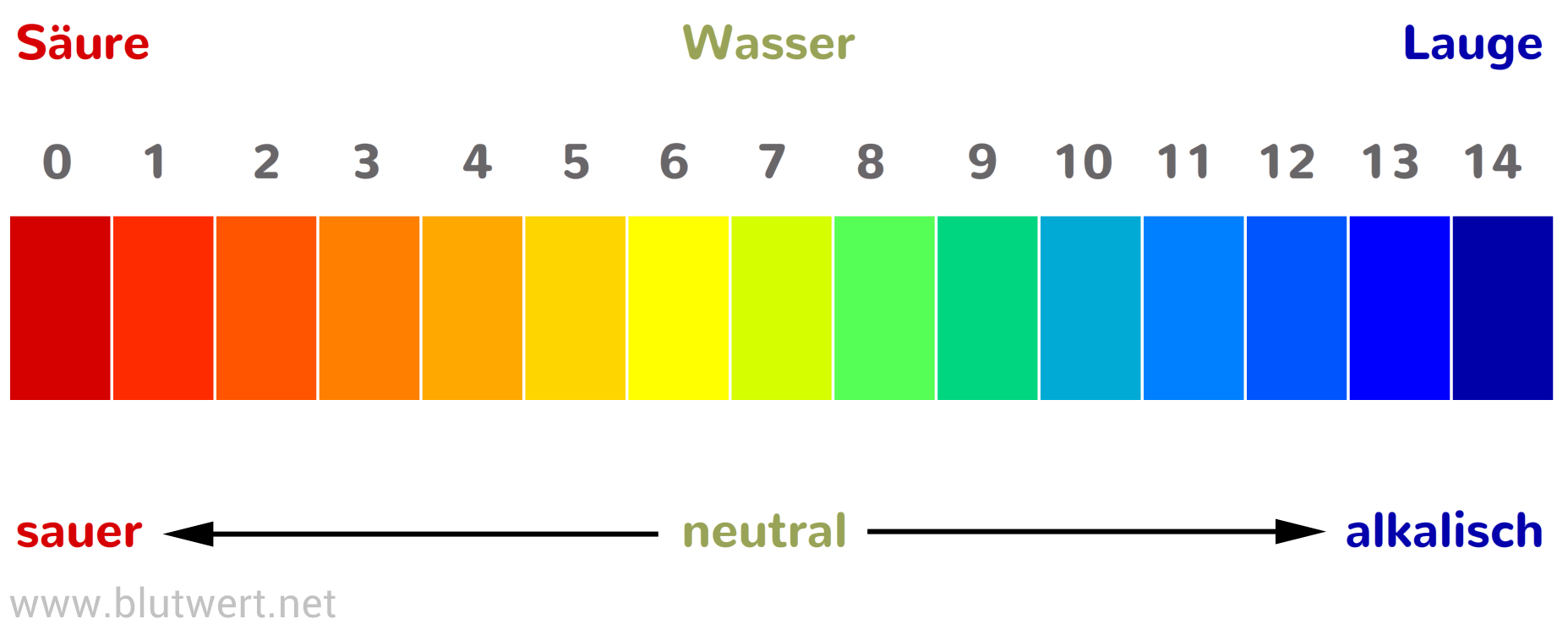
Der pH-Wert ist ein Maß für die Konzentration der Wasserstoffionen (H+) in einer Lösung und wird definiert als der negative dekadische Logarithmus der H+-Konzentration:
pH = -log10[H+]
Ein pH-Wert von 7 wird als neutral betrachtet, Werte unter 7 sind sauer, und Werte über 7 sind basisch. Es ist wichtig zu betonen, dass der pH-Wert keine lineare Skala ist. Eine pH-Wert-Änderung um eine Einheit entspricht einer zehnfachen Änderung der H+-Konzentration.
Starke und schwache Säuren
Säuren werden anhand ihrer Fähigkeit, in Wasser zu dissoziieren, in starke und schwache Säuren unterteilt. Starke Säuren dissoziieren in Wasser vollständig in ihre Ionen, während schwache Säuren nur teilweise dissoziieren. Diese Unterscheidung ist entscheidend für die Berechnung des pH-Werts. Beispiele für starke Säuren sind Salzsäure (HCl), Schwefelsäure (H2SO4) und Salpetersäure (HNO3).
Die Dissoziation einer starken Säure kann wie folgt dargestellt werden:
HA (aq) → H+(aq) + A-(aq)
Da die Dissoziation vollständig ist, entspricht die Konzentration der H+-Ionen in der Lösung der Ausgangskonzentration der starken Säure. Für schwache Säuren hingegen muss die Dissoziationskonstante (Ka) berücksichtigt werden, was die pH-Wert-Berechnung komplexer macht.
Die Berechnung des pH-Werts starker Säuren: Eine detaillierte Betrachtung
Die Berechnung des pH-Werts einer starken Säure ist im Prinzip einfach, da wir davon ausgehen, dass die Säure vollständig dissoziiert. Dies bedeutet, dass die Konzentration der H+-Ionen direkt der Konzentration der Säure entspricht.
Schritt-für-Schritt-Anleitung
- Bestimmung der Säurekonzentration: Ermitteln Sie die molare Konzentration (Molarität) der starken Säure in der Lösung.
- Annahme der vollständigen Dissoziation: Da es sich um eine starke Säure handelt, nehmen wir an, dass sie vollständig in H+-Ionen und das entsprechende Anion dissoziiert.
- H+-Konzentration bestimmen: Die Konzentration der H+-Ionen entspricht der Konzentration der ursprünglichen Säure. Achtung: Bei mehrprotonigen Säuren (z.B. H2SO4) muss die Stöchiometrie berücksichtigt werden. Schwefelsäure gibt zwei Protonen pro Molekül ab.
- pH-Wert berechnen: Berechnen Sie den pH-Wert mit der Formel pH = -log10[H+].
Beispiele
Beispiel 1: Berechnen Sie den pH-Wert einer 0,01 M Salzsäure (HCl) Lösung.
Da HCl eine starke Säure ist, dissoziiert sie vollständig: HCl → H+ + Cl-. Daher ist [H+] = 0,01 M.
pH = -log10(0,01) = -log10(10-2) = 2
Der pH-Wert der 0,01 M HCl-Lösung beträgt 2.
Beispiel 2: Berechnen Sie den pH-Wert einer 0,005 M Schwefelsäure (H2SO4) Lösung.
Schwefelsäure ist eine diprotische Säure, d.h., sie gibt zwei Protonen ab: H2SO4 → 2H+ + SO42-. Daher ist [H+] = 2 * 0,005 M = 0,01 M.
pH = -log10(0,01) = 2
Der pH-Wert der 0,005 M H2SO4-Lösung beträgt 2.
Einschränkungen und Besonderheiten
Obwohl die Berechnung des pH-Werts starker Säuren auf den ersten Blick einfach erscheint, gibt es einige Einschränkungen und Besonderheiten, die berücksichtigt werden müssen:
Sehr verdünnte Lösungen
Bei sehr verdünnten Lösungen (z.B. [H+] < 10-7 M) muss die Eigenprotolyse des Wassers berücksichtigt werden. Wasser dissoziiert selbst in geringem Maße in H+ und OH-: H2O ⇌ H+ + OH-. Die Konzentration der H+-Ionen aus der Eigenprotolyse des Wassers beträgt 10-7 M. In solchen Fällen muss die H+-Konzentration der Säure zur H+-Konzentration des Wassers addiert werden. Die Vernachlässigung dieses Effekts kann zu falschen pH-Wert-Berechnungen führen. Es ist auch wichtig zu beachten, dass bei der Zugabe einer Säure, die zu einer H+ Konzentration von unter 10-7 M führt, der pH Wert nicht über 7 liegen kann.
Ionenstärke
In konzentrierteren Lösungen kann die Ionenstärke die Aktivitätskoeffizienten der Ionen beeinflussen. Die Aktivität eines Ions ist ein Maß für seine "effektive Konzentration" unter Berücksichtigung der interionischen Wechselwirkungen. Die Formel pH = -log[H+] verwendet die Konzentration anstelle der Aktivität. Für präzisere Berechnungen sollte die Aktivität anstelle der Konzentration verwendet werden. Die Aktivität (a) ist gegeben durch a = γ * [Konzentration], wobei γ der Aktivitätskoeffizient ist. Die Berechnung von Aktivitätskoeffizienten ist komplex und erfordert die Verwendung von Modellen wie der Debye-Hückel-Theorie. In den meisten Fällen kann der Effekt der Ionenstärke jedoch bei nicht extrem hohen Konzentrationen vernachlässigt werden.
Temperatur
Die Temperatur beeinflusst die Dissoziation des Wassers und somit auch den pH-Wert. Die Eigenprotolyse des Wassers ist temperaturabhängig, was bedeutet, dass die Konzentration der H+- und OH--Ionen mit der Temperatur variiert. Bei höheren Temperaturen ist die Konzentration beider Ionen höher, was den Neutralpunkt verschiebt. In der Regel wird der pH-Wert bei Raumtemperatur (25°C) angegeben.
Mehrprotonige Säuren
Wie bereits erwähnt, müssen bei mehrprotonigen Säuren wie Schwefelsäure (H2SO4) die einzelnen Dissoziationsschritte berücksichtigt werden. Während die erste Dissoziation von H2SO4 als vollständig betrachtet wird, ist die zweite Dissoziation (HSO4- ⇌ H+ + SO42-) nicht vollständig. Für eine genaue Berechnung des pH-Werts muss die Dissoziationskonstante Ka2 berücksichtigt werden, was die Berechnung verkompliziert. In der Praxis wird diese Verkomplizierung oft vernachlässigt, insbesondere wenn die Konzentration der Säure relativ hoch ist.
Zusammenfassung
Die Berechnung des pH-Werts starker Säuren basiert auf der Annahme der vollständigen Dissoziation. Die einfache Formel pH = -log[H+] liefert in vielen Fällen eine gute Näherung. Es ist jedoch wichtig, die Einschränkungen dieser Annahme zu verstehen, insbesondere bei sehr verdünnten Lösungen, hohen Ionenstärken und der Behandlung von mehrprotonigen Säuren. Die Berücksichtigung dieser Faktoren ermöglicht eine genauere und fundiertere Bestimmung des pH-Werts in verschiedenen chemischen Kontexten. Eine vertiefte Auseinandersetzung mit diesen Aspekten ist essenziell für jeden, der sich intensiv mit der Chemie von Säuren und Basen beschäftigt.



![Ph Wert Von Starken Säuren Berechnen pH Wert • Definition, Skala, Tabelle, Bedeutung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/04/pH-Wert-Farbskala-1024x576.png)





![Ph Wert Von Starken Säuren Berechnen pH-Wert einfach erklärt • Skala und Bedeutung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/11/pH-Wert-Thumbnail-1024x576.png)