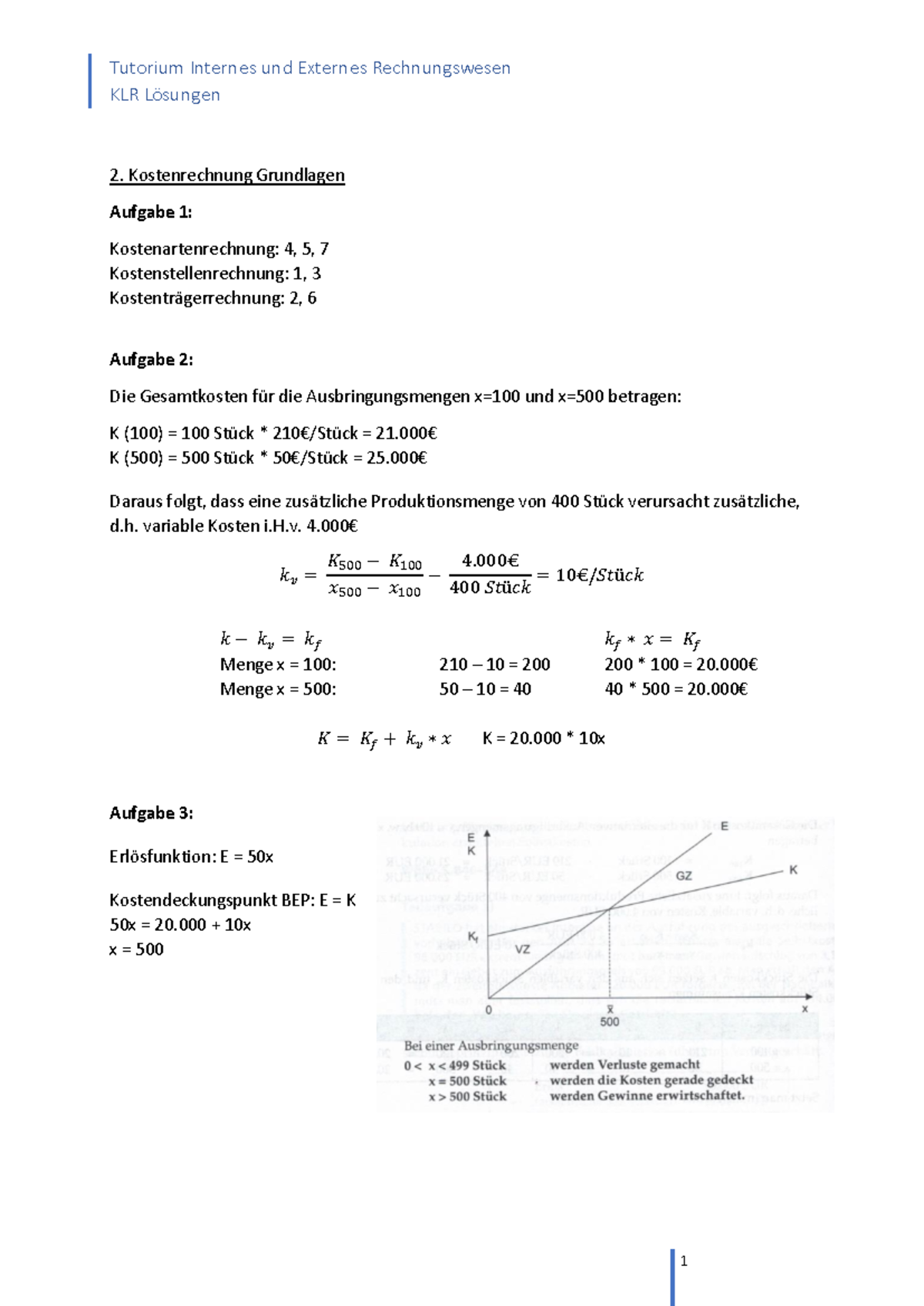
Redoxreaktion übungen Mit Lösungen Klasse 9

Redoxreaktionen sind ein fundamentales Konzept in der Chemie, das Schülern der 9. Klasse oft Kopfzerbrechen bereitet. Nicht nur, weil sie die gleichzeitige Oxidation und Reduktion von Stoffen beschreiben, sondern auch, weil das Verständnis für die zugrundeliegenden Elektronenübergänge und die Aufstellung korrekter Reaktionsgleichungen Übung erfordert. Dieser Artikel dient als Leitfaden, um Redoxreaktionen anhand von Beispielen und Übungsaufgaben mit Lösungen zu veranschaulichen und zu vertiefen, wobei der Fokus auf den didaktischen Wert und die Erfahrung der Lernenden gelegt wird.
Das Wesen der Redoxreaktion: Oxidation und Reduktion
Im Kern einer Redoxreaktion steht der Elektronenübergang. Ein Stoff gibt Elektronen ab (Oxidation), während ein anderer Stoff diese Elektronen aufnimmt (Reduktion). Diese Prozesse sind untrennbar miteinander verbunden. Man kann sich das wie ein Tauziehen vorstellen: Damit jemand ziehen kann, muss auch jemand da sein, der gezogen wird. Die Oxidation wird durch die Erhöhung der Oxidationszahl des oxidierten Stoffes gekennzeichnet, während die Reduktion durch die Verringerung der Oxidationszahl des reduzierten Stoffes gekennzeichnet ist.
Die Oxidationszahl ist eine formale Ladung, die einem Atom in einer Verbindung zugewiesen wird. Sie hilft, den Elektronenübergang zu verfolgen. Es ist wichtig, die Regeln zur Bestimmung von Oxidationszahlen zu beherrschen, bevor man sich mit komplexeren Redoxreaktionen beschäftigt.
Übungsaufgabe 1: Oxidationszahlen bestimmen
Bestimme die Oxidationszahlen aller Elemente in den folgenden Verbindungen:
- H2O
- KMnO4
- CO2
- Fe2O3
Lösung:
- H2O: H = +1, O = -2
- KMnO4: K = +1, Mn = +7, O = -2
- CO2: C = +4, O = -2
- Fe2O3: Fe = +3, O = -2
Diese Übung dient dazu, das Fundament für das Verständnis von Redoxreaktionen zu legen. Es ist entscheidend, dass Schüler diese grundlegenden Konzepte beherrschen, bevor sie sich an komplexere Aufgaben wagen. Die Bestimmung von Oxidationszahlen ist vergleichbar mit dem Lesen einer Partitur vor dem Spielen eines Musikstücks: Sie liefert die notwendigen Informationen, um die Reaktion korrekt zu interpretieren und zu verstehen.
Identifizierung von Redoxreaktionen
Nicht jede chemische Reaktion ist eine Redoxreaktion. Um eine Redoxreaktion zu identifizieren, muss man überprüfen, ob sich die Oxidationszahlen von mindestens zwei Elementen während der Reaktion ändern. Dies ist der springende Punkt. Wenn sich keine Oxidationszahlen ändern, handelt es sich um eine andere Art von Reaktion, beispielsweise eine Säure-Base-Reaktion oder eine Fällungsreaktion.
Übungsaufgabe 2: Redoxreaktion erkennen
Welche der folgenden Reaktionen sind Redoxreaktionen?
- NaOH + HCl → NaCl + H2O
- 2 Mg + O2 → 2 MgO
- AgNO3 + NaCl → AgCl + NaNO3
- Zn + CuSO4 → ZnSO4 + Cu
Lösung:
- Reaktion 2 und 4 sind Redoxreaktionen.
- Reaktion 1 ist eine Neutralisationsreaktion.
- Reaktion 3 ist eine Fällungsreaktion.
Erläuterung: In Reaktion 2 ändert sich die Oxidationszahl von Mg von 0 auf +2 und die von O von 0 auf -2. In Reaktion 4 ändert sich die Oxidationszahl von Zn von 0 auf +2 und die von Cu von +2 auf 0. In den anderen Reaktionen bleiben die Oxidationszahlen aller Elemente unverändert.
Diese Übung schult das kritische Denken der Schüler. Sie lernen, chemische Gleichungen zu analysieren und anhand der Veränderungen der Oxidationszahlen zu beurteilen, ob ein Elektronenübergang stattgefunden hat. Das Erkennen von Mustern und das Verstehen der zugrundeliegenden Prinzipien sind entscheidend für den Erfolg in der Chemie.
Aufstellen von Redoxreaktionsgleichungen
Das Aufstellen von Redoxreaktionsgleichungen kann zunächst herausfordernd sein, aber mit der richtigen Methode und ausreichend Übung wird es beherrschbar. Die häufigste Methode ist die Halbzellenmethode. Dabei wird die Redoxreaktion in zwei Halbreaktionen aufgeteilt: eine Oxidationshalbzelle und eine Reduktionshalbzelle. Diese Halbreaktionen werden dann separat ausgeglichen, bevor sie kombiniert werden, um die vollständige Redoxreaktionsgleichung zu erhalten.
Die Schritte der Halbzellenmethode sind:
- Bestimme die Oxidationszahlen aller Elemente in der Reaktion.
- Identifiziere die oxidierten und reduzierten Stoffe.
- Schreibe die Halbreaktionen für Oxidation und Reduktion.
- Gleiche die Atome in jeder Halbreaktion aus (außer Sauerstoff und Wasserstoff).
- Gleiche den Sauerstoff durch Hinzufügen von H2O aus.
- Gleiche den Wasserstoff durch Hinzufügen von H+ aus.
- Gleiche die Ladung durch Hinzufügen von Elektronen aus.
- Multipliziere die Halbreaktionen gegebenenfalls mit Faktoren, so dass die Anzahl der abgegebenen Elektronen gleich der Anzahl der aufgenommenen Elektronen ist.
- Addiere die Halbreaktionen und kürze gleiche Spezies auf beiden Seiten der Gleichung.
- Überprüfe, ob die Atome und die Ladung ausgeglichen sind.
Übungsaufgabe 3: Redoxreaktionsgleichung aufstellen
Stelle die folgende Redoxreaktionsgleichung auf:
MnO4- + Fe2+ → Mn2+ + Fe3+ (in saurer Lösung)
Lösung:
- Oxidationszahlen: Mn (+7), O (-2), Fe (+2), Fe (+3)
- Oxidation: Fe2+ → Fe3+ (Eisen wird oxidiert) Reduktion: MnO4- → Mn2+ (Mangan wird reduziert)
- Halbreaktionen: Oxidation: Fe2+ → Fe3+ Reduktion: MnO4- → Mn2+
- Atome ausgleichen: Oxidation: Fe2+ → Fe3+ Reduktion: MnO4- → Mn2+
- Sauerstoff ausgleichen: Oxidation: Fe2+ → Fe3+ Reduktion: MnO4- → Mn2+ + 4 H2O
- Wasserstoff ausgleichen: Oxidation: Fe2+ → Fe3+ Reduktion: MnO4- + 8 H+ → Mn2+ + 4 H2O
- Ladung ausgleichen: Oxidation: Fe2+ → Fe3+ + e- Reduktion: MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O
- Halbreaktionen multiplizieren: Oxidation: 5 Fe2+ → 5 Fe3+ + 5 e- Reduktion: MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O
- Halbreaktionen addieren und kürzen: 5 Fe2+ + MnO4- + 8 H+ → 5 Fe3+ + Mn2+ + 4 H2O
- Überprüfen: Atome und Ladung sind ausgeglichen.
Die resultierende ausgeglichene Redoxreaktionsgleichung ist:
5 Fe2+ + MnO4- + 8 H+ → 5 Fe3+ + Mn2+ + 4 H2O
Diese Aufgabe demonstriert die praktische Anwendung der Halbzellenmethode. Die Schüler lernen, systematisch vorzugehen und jeden Schritt sorgfältig auszuführen, um zu einer korrekten Reaktionsgleichung zu gelangen. Es fördert das logische Denken und die Problemlösungsfähigkeiten.
Anwendungen von Redoxreaktionen
Redoxreaktionen sind nicht nur theoretische Konzepte, sondern spielen eine entscheidende Rolle in vielen Bereichen unseres Lebens. Von der Verbrennung von Brennstoffen zur Energiegewinnung bis hin zur Korrosion von Metallen und den Prozessen in Batterien sind Redoxreaktionen allgegenwärtig.
Einige Beispiele sind:
- Verbrennung: Die Verbrennung von Holz, Erdgas oder Benzin ist eine Redoxreaktion, bei der Kohlenstoff und Wasserstoff mit Sauerstoff reagieren und Energie freisetzen.
- Korrosion: Rostbildung (die Korrosion von Eisen) ist eine Redoxreaktion, bei der Eisen mit Sauerstoff und Wasser reagiert und Eisenoxid bildet.
- Batterien: Batterien nutzen Redoxreaktionen, um chemische Energie in elektrische Energie umzuwandeln.
- Photosynthese: Pflanzen nutzen Photosynthese, eine komplexe Redoxreaktion, um Sonnenlicht, Wasser und Kohlendioxid in Glukose und Sauerstoff umzuwandeln.
- Atmung: Tiere und Menschen nutzen die Atmung, eine Redoxreaktion, um Glukose mit Sauerstoff zu verbrennen und Energie freizusetzen.
Das Verständnis für die Bedeutung von Redoxreaktionen in diesen Alltagssituationen kann das Interesse der Schüler wecken und die Relevanz des Themas verdeutlichen. Es zeigt, dass Chemie nicht nur im Labor stattfindet, sondern unser Leben in vielfältiger Weise beeinflusst.
Zusätzliche Übungen
Um das Verständnis weiter zu vertiefen, sind hier einige zusätzliche Übungsaufgaben:
- Bestimme die Oxidationszahlen aller Elemente in K2Cr2O7.
- Ist die Reaktion 2 H2O → 2 H2 + O2 eine Redoxreaktion? Begründe deine Antwort.
- Stelle die Redoxreaktionsgleichung für die Reaktion von Zink mit Salzsäure (HCl) auf: Zn + HCl → ZnCl2 + H2
- Nenne drei Beispiele für Anwendungen von Redoxreaktionen im Alltag.
Hinweis: Die Lösungen zu diesen Übungen können online oder in Lehrbüchern gefunden werden. Es ist wichtig, dass die Schüler die Aufgaben selbstständig bearbeiten und ihre Lösungen anschließend überprüfen, um ihr Verständnis zu festigen.
Das erfolgreiche Erlernen von Redoxreaktionen erfordert Ausdauer und Übung. Durch das Bearbeiten von Übungsaufgaben, das Verstehen der zugrundeliegenden Konzepte und das Erkennen der Relevanz in der realen Welt können Schüler diese Herausforderung meistern und eine solide Grundlage für weitere Studien in der Chemie legen.