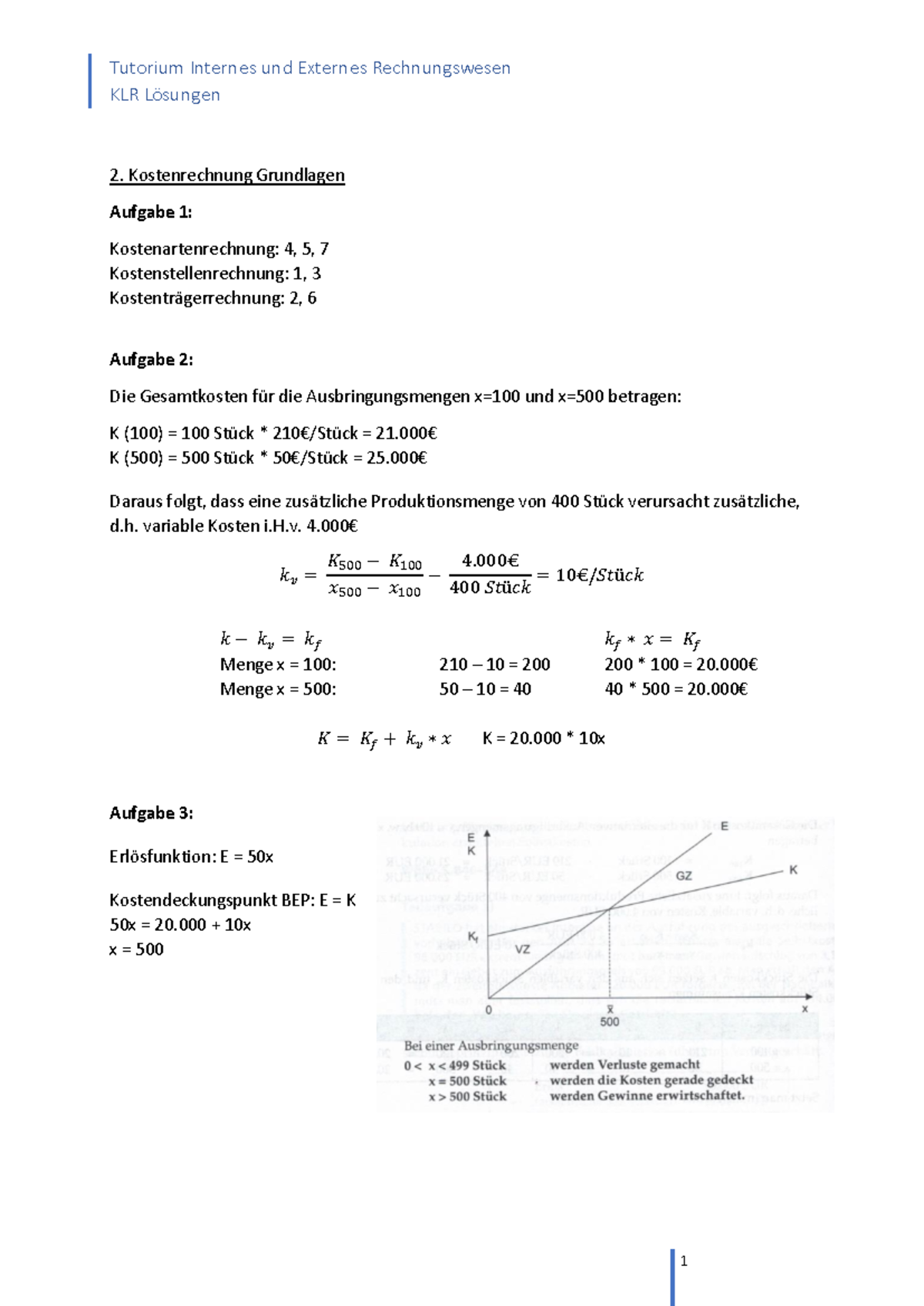
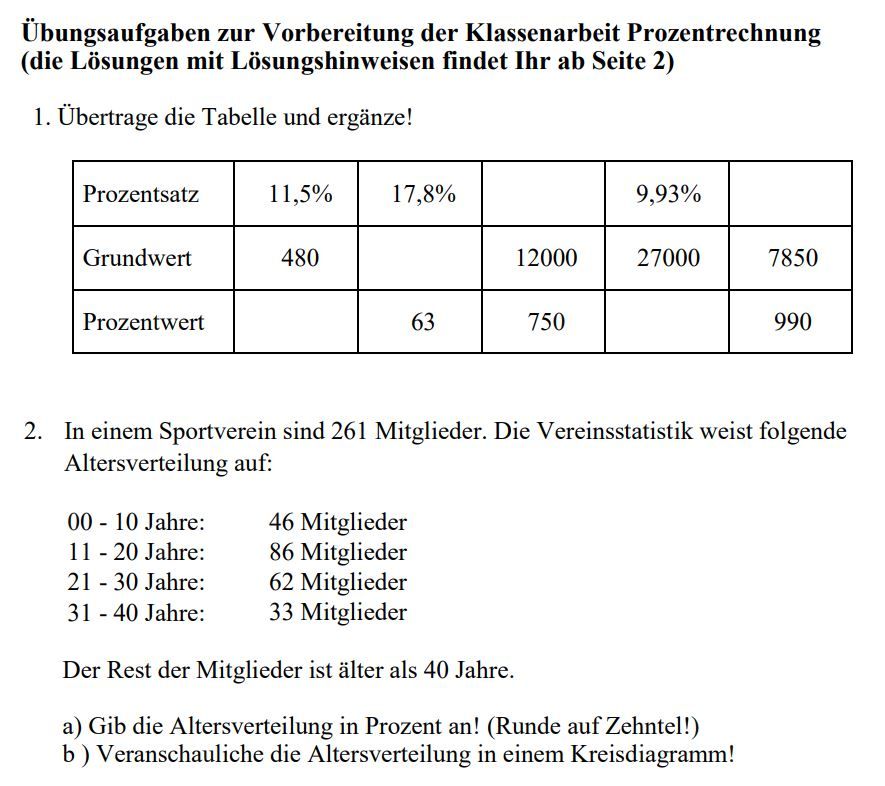
Redoxreaktionen übungen Mit Lösungen Pdf

Redoxreaktionen, kurz für Reduktions-Oxidations-Reaktionen, sind fundamentale chemische Prozesse, die in vielen Bereichen unseres Lebens eine Rolle spielen. Von der Energiegewinnung in Batterien bis hin zur Korrosion von Metallen, von der Photosynthese in Pflanzen bis zur Atmung in unseren Körpern – Redoxreaktionen sind allgegenwärtig. Das Verständnis dieser Reaktionen ist daher essentiell für jeden, der sich mit Chemie, Biologie, Materialwissenschaften oder Umwelttechnik beschäftigt. Dieser Artikel soll eine Einführung in Redoxreaktionen geben und aufzeigen, wie man sie üben und verstehen kann, insbesondere mit Hilfe von Übungsaufgaben und Lösungsbeispielen im PDF-Format.
Was sind Redoxreaktionen?
Im Kern beschreibt eine Redoxreaktion den gleichzeitigen Transfer von Elektronen zwischen zwei chemischen Spezies. Es handelt sich also immer um zwei Teilprozesse, die gekoppelt ablaufen:
- Oxidation: Die Abgabe von Elektronen durch eine chemische Spezies. Die Oxidationszahl der Spezies erhöht sich.
- Reduktion: Die Aufnahme von Elektronen durch eine chemische Spezies. Die Oxidationszahl der Spezies verringert sich.
Die Spezies, die Elektronen abgibt (oxidiert wird), wird als Reduktionsmittel bezeichnet, da sie die Reduktion einer anderen Spezies bewirkt. Umgekehrt wird die Spezies, die Elektronen aufnimmt (reduziert wird), als Oxidationsmittel bezeichnet, da sie die Oxidation einer anderen Spezies bewirkt. Es ist wichtig zu betonen, dass Oxidation und Reduktion immer zusammen auftreten; es kann keine Oxidation ohne gleichzeitige Reduktion geben und umgekehrt. Denken Sie daran: "LEO says GER" – Lose Electrons = Oxidation, Gain Electrons = Reduction.
Oxidationszahlen: Ein Schlüssel zum Verständnis
Um Redoxreaktionen zu verstehen und zu identifizieren, ist die Kenntnis der Oxidationszahlen unerlässlich. Die Oxidationszahl ist eine formale Ladung, die einem Atom in einer chemischen Verbindung zugewiesen wird, unter der Annahme, dass alle Bindungen ionisch sind. Die Oxidationszahl ist keine tatsächliche Ladung, sondern ein Hilfsmittel, um den Elektronentransfer in einer Reaktion zu verfolgen.
Hier sind einige Regeln zur Bestimmung von Oxidationszahlen:
- Die Oxidationszahl eines Elements in seiner elementaren Form ist immer 0 (z.B. O2, Fe, Cu).
- Die Oxidationszahl eines einatomigen Ions entspricht seiner Ladung (z.B. Na+ hat eine Oxidationszahl von +1, Cl- hat eine Oxidationszahl von -1).
- Die Summe der Oxidationszahlen aller Atome in einer neutralen Verbindung ist 0.
- Die Summe der Oxidationszahlen aller Atome in einem Polyatomion entspricht der Ladung des Ions.
- Fluor (F) hat immer eine Oxidationszahl von -1 in Verbindungen.
- Sauerstoff (O) hat in der Regel eine Oxidationszahl von -2, außer in Peroxiden (z.B. H2O2), wo sie -1 ist, und in Verbindungen mit Fluor, wo sie positiv ist.
- Wasserstoff (H) hat in der Regel eine Oxidationszahl von +1, außer in Metallhydriden (z.B. NaH), wo sie -1 ist.
Durch das Anwenden dieser Regeln können Sie die Oxidationszahlen der Atome in einer Verbindung bestimmen und somit erkennen, ob eine Reaktion eine Redoxreaktion ist oder nicht. Wenn sich die Oxidationszahl eines Atoms während einer Reaktion ändert, handelt es sich um eine Redoxreaktion.
Beispiele für Redoxreaktionen
Betrachten wir einige Beispiele:
- Verbrennung von Methan (CH4): CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
- Kohlenstoff (C) oxidiert von -4 in CH4 zu +4 in CO2.
- Sauerstoff (O) reduziert von 0 in O2 zu -2 in H2O und CO2.
- Reaktion von Zink mit Salzsäure: Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
- Zink (Zn) oxidiert von 0 zu +2.
- Wasserstoff (H) reduziert von +1 zu 0.
- Rostbildung (Korrosion von Eisen): 4Fe(s) + 3O2(g) → 2Fe2O3(s)
- Eisen (Fe) oxidiert von 0 zu +3.
- Sauerstoff (O) reduziert von 0 zu -2.
Übungen und Lösungsbeispiele im PDF-Format
Der beste Weg, Redoxreaktionen zu meistern, ist durch Übung. Viele Online-Ressourcen bieten Übungsaufgaben und Lösungsbeispiele im PDF-Format an. Diese PDFs sind besonders hilfreich, da sie eine strukturierte Sammlung von Aufgaben mit steigendem Schwierigkeitsgrad bieten. Sie können diese Übungen nutzen, um Ihr Verständnis der Konzepte zu festigen und Ihre Fähigkeiten zur Problemlösung zu verbessern.
Wo findet man solche PDFs?
- Webseiten von Universitäten und Hochschulen: Viele Universitäten stellen Übungsmaterialien und Altklausuren online zur Verfügung. Suchen Sie auf den Webseiten der Chemie- oder Ingenieurfakultäten.
- Online-Lernplattformen: Plattformen wie Khan Academy, Coursera oder edX bieten Kurse und Übungsmaterialien zur Chemie an, die oft auch Redoxreaktionen abdecken.
- Lehrbücher und Übungsbücher: Viele Chemie-Lehrbücher enthalten umfangreiche Übungsaufgaben mit Lösungen.
- Spezifische Webseiten für Chemie: Suchen Sie nach Webseiten, die sich auf Chemie-Unterrichtsmaterialien spezialisiert haben. Geben Sie Suchbegriffe wie "Redoxreaktionen Übungen PDF" oder "Redoxreaktionen Aufgaben mit Lösungen PDF" ein.
Was sollte man in einem solchen PDF erwarten?
Ein gutes PDF mit Übungsaufgaben zu Redoxreaktionen sollte typischerweise Folgendes enthalten:
- Aufgaben zur Bestimmung von Oxidationszahlen: Diese Aufgaben helfen Ihnen, die Regeln zur Bestimmung von Oxidationszahlen zu üben und zu festigen.
- Aufgaben zur Identifizierung von Redoxreaktionen: Diese Aufgaben fordern Sie auf, zu erkennen, ob eine gegebene Reaktion eine Redoxreaktion ist oder nicht, basierend auf der Änderung der Oxidationszahlen.
- Aufgaben zum Aufstellen von Redoxreaktionsgleichungen: Diese Aufgaben sind anspruchsvoller und erfordern, dass Sie Redoxreaktionen vollständig aufstellen und ausgleichen. Dies beinhaltet oft das Aufteilen der Reaktion in Halbgleichungen (Oxidations- und Reduktionshalbgleichung) und das Ausgleichen der Ladungen und Atome.
- Aufgaben zur Berechnung von Stoffmengen in Redoxreaktionen: Diese Aufgaben beinhalten typischerweise stöchiometrische Berechnungen, um die Mengen der beteiligten Stoffe zu bestimmen.
- Ausführliche Lösungen: Jede Aufgabe sollte mit einer detaillierten Lösung versehen sein, die jeden Schritt des Lösungswegs erklärt. Dies ist wichtig, um Fehler zu verstehen und zu lernen, wie man die Aufgaben richtig angeht.
Tipps zum Üben von Redoxreaktionen
Hier sind einige Tipps, die Ihnen helfen können, das Beste aus Ihren Übungsaufgaben zu machen:
- Beginnen Sie mit den Grundlagen: Stellen Sie sicher, dass Sie die Regeln zur Bestimmung von Oxidationszahlen und die Definitionen von Oxidation und Reduktion verstehen, bevor Sie sich an komplexere Aufgaben wagen.
- Arbeiten Sie systematisch: Gehen Sie die Aufgaben Schritt für Schritt durch. Schreiben Sie alle Zwischenschritte auf, um Fehler zu vermeiden.
- Überprüfen Sie Ihre Lösungen sorgfältig: Vergleichen Sie Ihre Lösungen mit den Lösungen im PDF und versuchen Sie, Ihre Fehler zu verstehen. Fragen Sie sich, warum Sie einen Fehler gemacht haben und wie Sie ihn in Zukunft vermeiden können.
- Nutzen Sie verschiedene Ressourcen: Verwenden Sie nicht nur PDFs, sondern auch Lehrbücher, Online-Kurse und andere Lernmaterialien, um Ihr Wissen zu erweitern.
- Suchen Sie Hilfe, wenn Sie nicht weiterkommen: Wenn Sie Schwierigkeiten haben, eine Aufgabe zu lösen, scheuen Sie sich nicht, Ihren Lehrer, Tutor oder Kommilitonen um Hilfe zu bitten.
- Wiederholen Sie regelmäßig: Wiederholen Sie die Übungsaufgaben regelmäßig, um Ihr Wissen zu festigen und Ihre Fähigkeiten zu verbessern.
Fazit
Redoxreaktionen sind ein wichtiger Bestandteil der Chemie. Durch das Verständnis der Grundlagen, das Üben mit Aufgaben und das Nutzen von Ressourcen wie PDFs mit Lösungsbeispielen können Sie diese Reaktionen meistern und Ihr chemisches Wissen erweitern. Die Fähigkeit, Oxidationszahlen zu bestimmen, Redoxreaktionen zu identifizieren und Reaktionsgleichungen aufzustellen und auszugleichen, ist eine wertvolle Fähigkeit, die Ihnen in vielen Bereichen von Nutzen sein wird.


![Redoxreaktionen übungen Mit Lösungen Pdf [Auto] Boo, even the Citroen C3 is a crossover now: meet the electric e](https://www.topgear.com/sites/default/files/2023/10/CL_23.026.012.jpg)