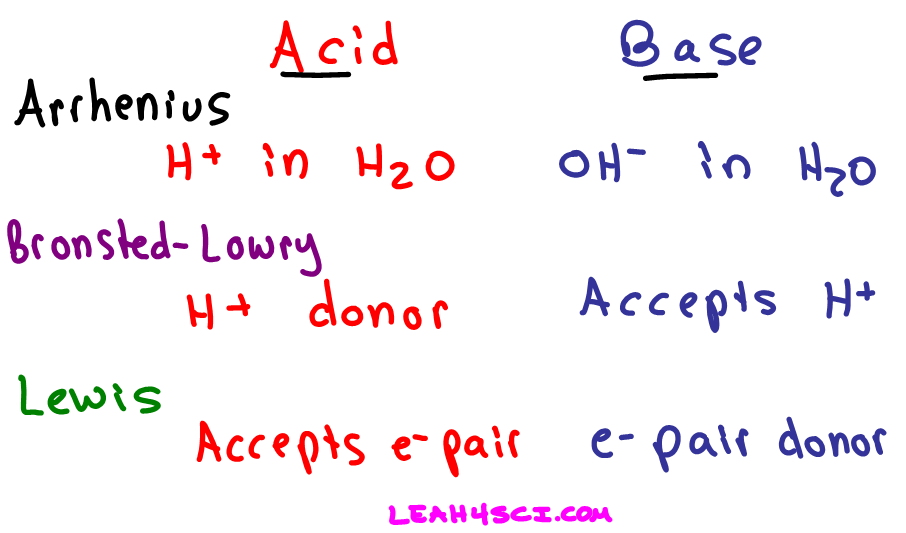Säure Base Definition Nach Brönsted

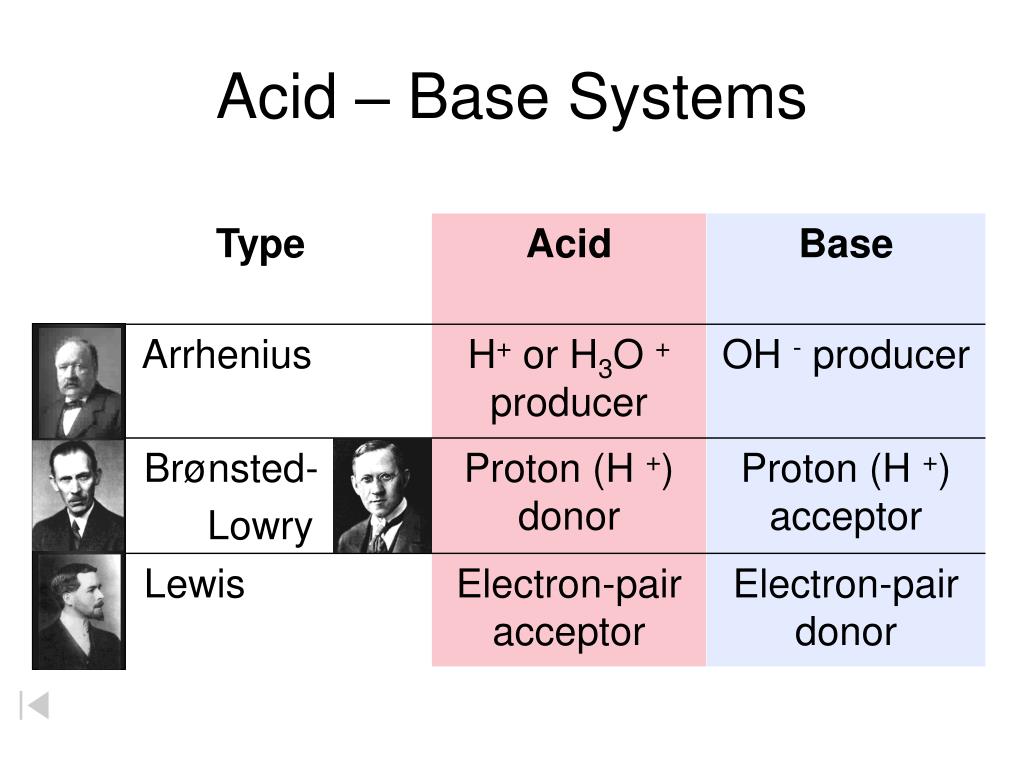
Die Brönsted-Definition von Säuren und Basen, eine fundamentale Erweiterung der älteren Arrhenius-Theorie, hat unser Verständnis chemischer Reaktionen revolutioniert. Anstatt sich auf die Anwesenheit von Hydroxidionen (OH⁻) in wässriger Lösung (Arrhenius-Basen) oder Wasserstoffionen (H⁺) in wässriger Lösung (Arrhenius-Säuren) zu beschränken, konzentriert sich Brönsted auf den Transfer von Protonen (H⁺) zwischen Molekülen und Ionen. Dieser Protonentransfer ist das Herzstück der Brönsted-Säure-Base-Theorie und ermöglicht die Beschreibung von Säure-Base-Reaktionen in einer viel breiteren Palette von Lösungsmitteln und sogar in der Gasphase.
Das Brönsted-Konzept: Protonendonatoren und -akzeptoren
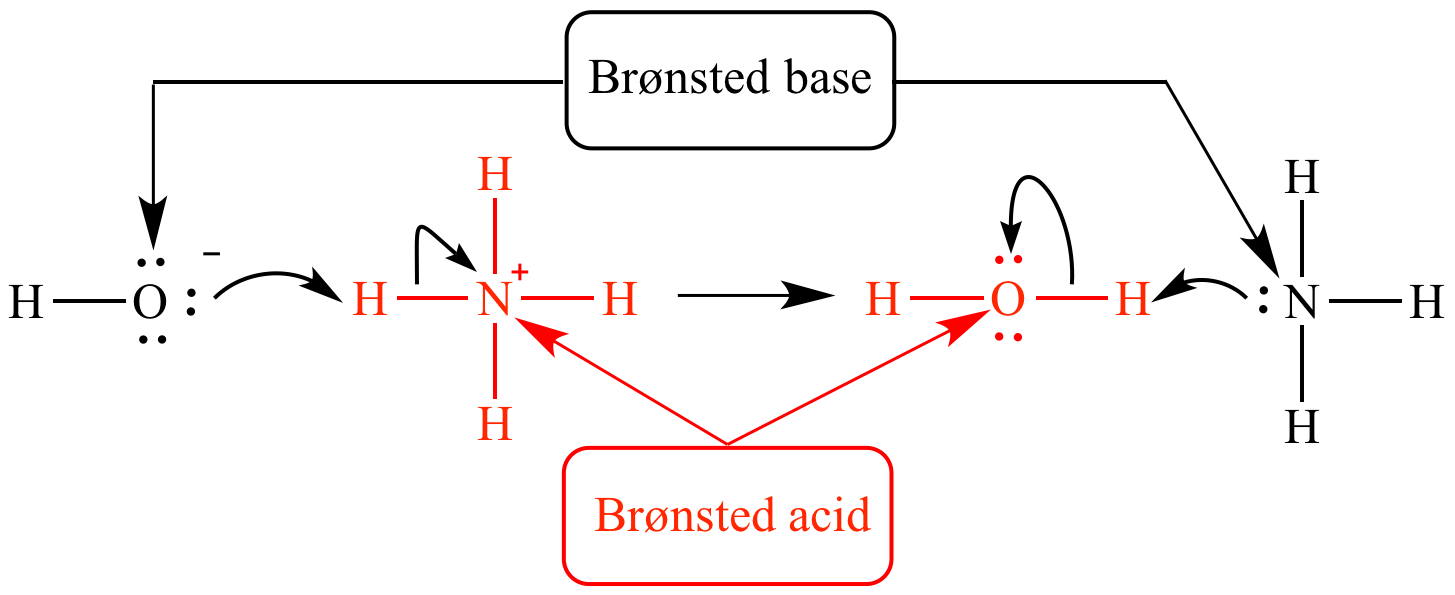
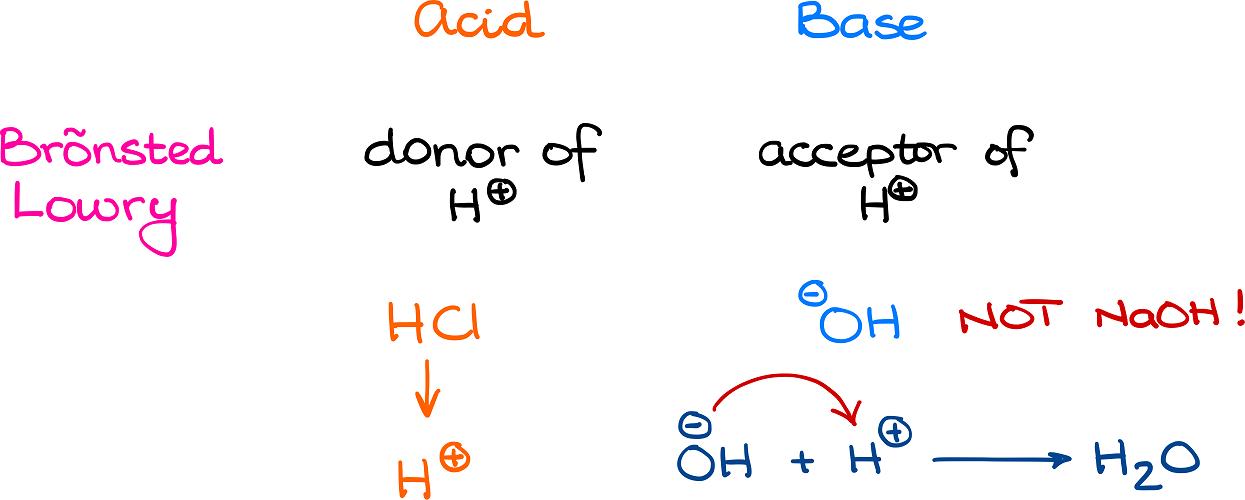
Im Zentrum der Brönsted-Definition steht die Idee, dass eine Säure eine Substanz ist, die ein Proton (H⁺) abgeben kann – ein Protonendonator. Im Gegenzug ist eine Base eine Substanz, die ein Proton aufnehmen kann – ein Protonenakzeptor. Dieser Austausch von Protonen definiert die Säure-Base-Reaktion. Es ist wichtig zu betonen, dass eine Substanz nur dann als Säure oder Base fungieren kann, wenn eine andere Substanz anwesend ist, um entweder das Proton aufzunehmen oder abzugeben. Es handelt sich also immer um ein Wechselspiel zweier Spezies.
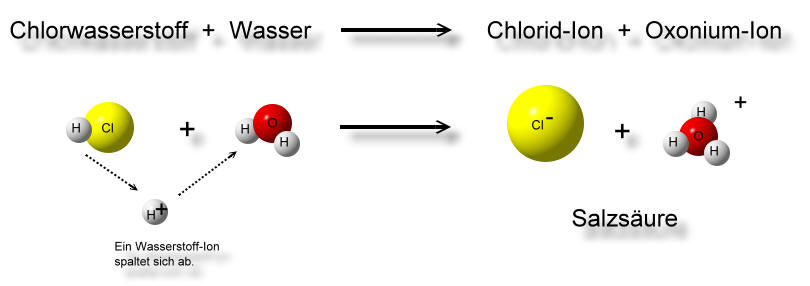
Betrachten wir als Beispiel die Reaktion von Salzsäure (HCl) mit Wasser (H₂O):
HCl(aq) + H₂O(l) ⇌ H₃O⁺(aq) + Cl⁻(aq)
In dieser Reaktion fungiert HCl als Brönsted-Säure, da es ein Proton an Wasser abgibt. Wasser fungiert als Brönsted-Base, da es das Proton von HCl aufnimmt. Das Produkt der Protonierung von Wasser ist das Hydroniumion (H₃O⁺), während das Produkt der Deprotonierung von HCl das Chloridion (Cl⁻) ist. Diese Reaktion verdeutlicht, dass die Brönsted-Theorie nicht auf wässrige Lösungen beschränkt ist, da die eigentliche Definition auf dem Protonentransfer beruht, nicht auf der Anwesenheit von OH⁻- oder H⁺-Ionen.
Korrespondierende Säure-Base-Paare
Ein weiteres Schlüsselelement der Brönsted-Definition ist das Konzept der korrespondierenden Säure-Base-Paare. Jede Säure hat eine korrespondierende Base, die entsteht, wenn die Säure ein Proton abgibt. Umgekehrt hat jede Base eine korrespondierende Säure, die entsteht, wenn die Base ein Proton aufnimmt. In der obigen Reaktion ist HCl die Säure, und Cl⁻ ist ihre korrespondierende Base. H₂O ist die Base, und H₃O⁺ ist ihre korrespondierende Säure. Die Stärke einer Säure und ihrer korrespondierenden Base sind umgekehrt proportional zueinander. Eine starke Säure hat eine schwache korrespondierende Base, und eine schwache Säure hat eine starke korrespondierende Base.
Beispielsweise ist Schwefelsäure (H₂SO₄) eine sehr starke Säure. Ihre korrespondierende Base, das Hydrogensulfation (HSO₄⁻), ist eine viel schwächere Base. Umgekehrt ist Ammoniak (NH₃) eine relativ schwache Base. Seine korrespondierende Säure, das Ammoniumion (NH₄⁺), ist eine viel schwächere Säure.
Amphoterie: Eine Substanz mit Doppelcharakter
Eine besonders interessante Eigenschaft einiger Substanzen ist ihre Fähigkeit, sowohl als Säure als auch als Base zu fungieren. Solche Substanzen werden als amphoter bezeichnet. Wasser ist ein klassisches Beispiel für eine amphotere Substanz. Wie wir bereits gesehen haben, kann Wasser in der Reaktion mit HCl als Base fungieren und ein Proton aufnehmen. Umgekehrt kann Wasser in der Reaktion mit Ammoniak (NH₃) als Säure fungieren und ein Proton abgeben:
NH₃(aq) + H₂O(l) ⇌ NH₄⁺(aq) + OH⁻(aq)
Hier fungiert Wasser als Säure, indem es ein Proton an Ammoniak abgibt. Die Fähigkeit einer Substanz, sowohl als Säure als auch als Base zu agieren, hängt von den Reaktionsbedingungen und der Anwesenheit anderer Spezies ab.
Anwendungen und Bedeutung der Brönsted-Theorie
Die Brönsted-Definition von Säuren und Basen hat weitreichende Anwendungen in vielen Bereichen der Chemie, darunter:
- Analytische Chemie: Die Brönsted-Theorie ist entscheidend für das Verständnis von Titrationen und anderen analytischen Techniken, die auf Säure-Base-Reaktionen basieren.
- Biochemie: Viele biochemische Reaktionen, wie z. B. die Enzymkatalyse, sind Säure-Base-Reaktionen. Das Verständnis des Protonentransfers ist für das Verständnis dieser Reaktionen unerlässlich.
- Umweltchemie: Die Brönsted-Theorie hilft uns, die Säure-Base-Chemie von saurem Regen, Boden und Wasser zu verstehen.
- Organische Chemie: Viele organische Reaktionen werden durch Säuren oder Basen katalysiert. Das Verständnis des Mechanismus dieser Reaktionen erfordert ein tiefes Verständnis der Brönsted-Definition.
Die Erweiterung des Säure-Base-Begriffs durch Brönsted ermöglicht es, chemische Reaktionen in Systemen zu betrachten, in denen keine wässrige Lösung vorliegt. Das ist besonders wichtig in der organischen Chemie und in der Festkörperchemie.
Die Brönsted-Theorie im Vergleich zur Lewis-Theorie
Obwohl die Brönsted-Theorie eine deutliche Verbesserung gegenüber der Arrhenius-Theorie darstellt, ist sie nicht die umfassendste Definition von Säuren und Basen. Die Lewis-Theorie geht noch einen Schritt weiter und definiert eine Säure als eine Substanz, die ein Elektronenpaar akzeptieren kann (Elektronenpaarakzeptor), und eine Base als eine Substanz, die ein Elektronenpaar abgeben kann (Elektronenpaardonator). Die Lewis-Theorie umfasst alle Brönsted-Säuren und -Basen, aber sie umfasst auch Reaktionen, bei denen kein Protonentransfer stattfindet, wie z. B. die Reaktion von Bortrifluorid (BF₃) mit Ammoniak (NH₃).
Obwohl die Lewis-Theorie umfassender ist, ist die Brönsted-Theorie oft praktischer, wenn es um Reaktionen geht, bei denen Protonen beteiligt sind. Beide Theorien sind wertvolle Werkzeuge für das Verständnis chemischer Reaktionen, und die Wahl der Theorie hängt von der jeweiligen Situation ab.
Zusammenfassend lässt sich sagen, dass die Brönsted-Definition von Säuren und Basen ein fundamentales Konzept in der Chemie ist, das unser Verständnis chemischer Reaktionen erheblich erweitert hat. Durch die Konzentration auf den Protonentransfer ermöglicht die Brönsted-Theorie die Beschreibung von Säure-Base-Reaktionen in einer viel breiteren Palette von Umgebungen als die ältere Arrhenius-Theorie. Das Verständnis der Brönsted-Theorie ist für jeden, der Chemie studiert, unerlässlich.
Die Fähigkeit, Säuren und Basen nach Brönsted zu identifizieren, die Bedeutung korrespondierender Säure-Base-Paare zu erkennen und die Amphoterie bestimmter Substanzen zu verstehen, sind wesentliche Fähigkeiten für jeden Chemiker. Obwohl die Lewis-Theorie eine noch umfassendere Definition bietet, bleibt die Brönsted-Theorie ein unverzichtbares Werkzeug im Repertoire des Chemikers, insbesondere im Kontext von Reaktionen, an denen Protonen beteiligt sind.
Die Brönsted-Theorie leistet einen wichtigen Beitrag zum Verständnis komplexer chemischer Prozesse und bildet somit eine solide Grundlage für weiterführende Studien und Anwendungen in verschiedenen chemischen Disziplinen.