Säure Base Theorie Nach Brönsted

Die Brønsted-Theorie der Säuren und Basen, benannt nach dem dänischen Chemiker Johannes Nicolaus Brønsted, revolutionierte unser Verständnis von Säure-Base-Reaktionen. Anstatt sich auf die Anwesenheit von Hydroxidionen (OH⁻) zu beschränken, wie es die Arrhenius-Theorie tat, erweiterte Brønsted das Konzept, indem er die Übertragung von Protonen (H⁺) in den Mittelpunkt stellte. Diese Erweiterung ermöglichte die Erklärung von Säure-Base-Eigenschaften einer viel größeren Bandbreite an Substanzen und Reaktionen, einschließlich solcher in nicht-wässrigen Lösungen.
Kernprinzipien der Brønsted-Theorie
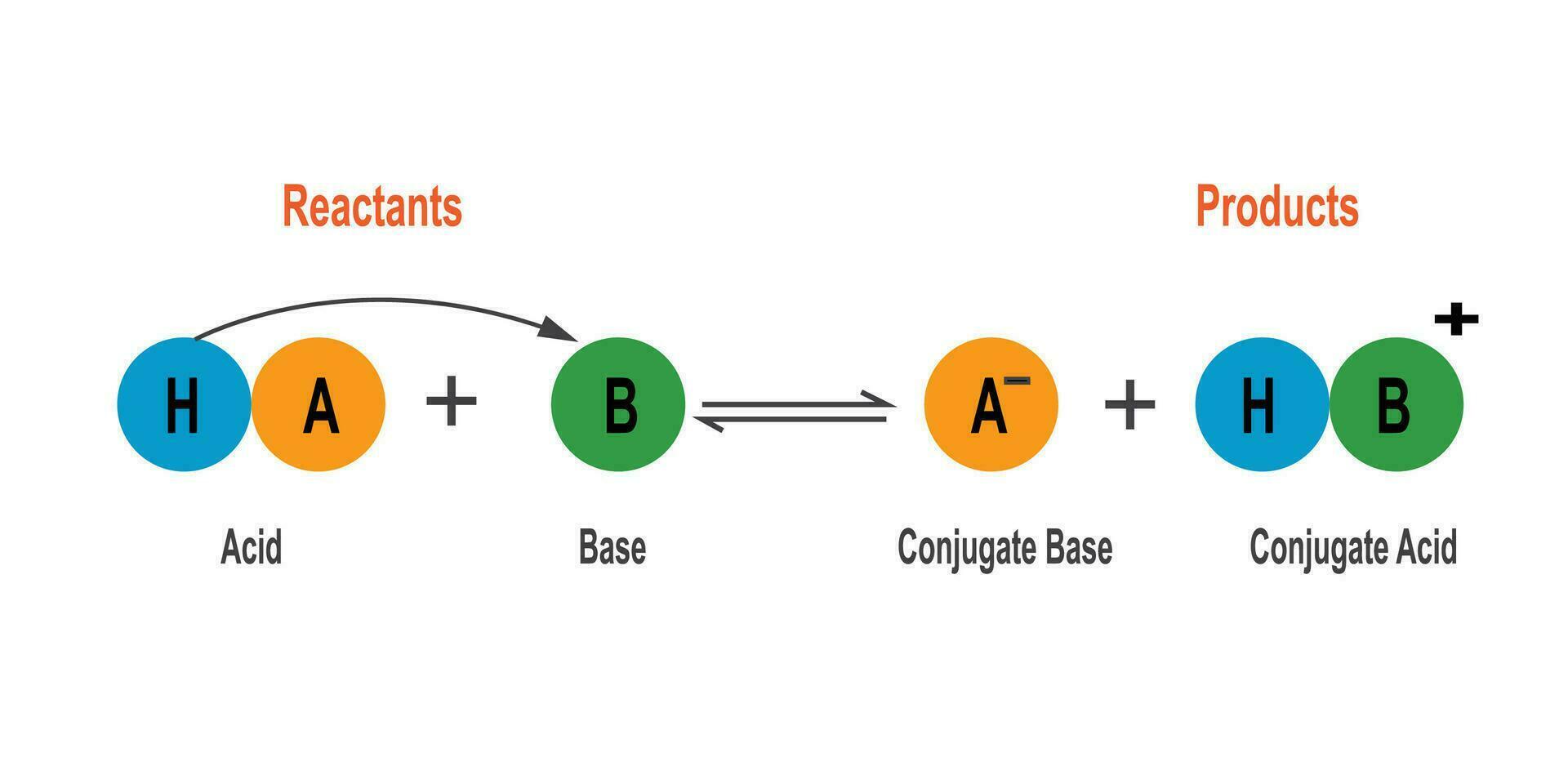
Die Brønsted-Theorie definiert eine Säure als eine Spezies, die Protonen abgeben kann (ein Protonendonator), und eine Base als eine Spezies, die Protonen aufnehmen kann (ein Protonenakzeptor). Eine Säure-Base-Reaktion ist demnach eine Protonenübertragungsreaktion. Das bedeutet, dass es keine Säure ohne eine Base und keine Base ohne eine Säure geben kann, zumindest nicht in einer Brønsted-Reaktion.
Ein zentrales Konzept ist das des konjugierten Säure-Base-Paares. Wenn eine Säure ein Proton abgibt, entsteht ihre konjugierte Base. Umgekehrt entsteht aus einer Base durch Aufnahme eines Protons ihre konjugierte Säure. Beispielsweise ist in der Reaktion:
HCl (aq) + H₂O (l) ⇌ H₃O⁺ (aq) + Cl⁻ (aq)
HCl die Säure, Cl⁻ ihre konjugierte Base, H₂O die Base und H₃O⁺ ihre konjugierte Säure. Die Pfeile in beide Richtungen deuten auf eine Gleichgewichtsreaktion hin, ein weiterer wichtiger Aspekt der Brønsted-Theorie.
Im Vergleich zur Arrhenius-Theorie, die sich auf die Bildung von H⁺ bzw. OH⁻ in wässriger Lösung konzentriert, bietet die Brønsted-Theorie eine viel umfassendere Perspektive. Ammoniak (NH₃) beispielsweise, ist nach Arrhenius keine Base, da es keine OH⁻-Ionen enthält. Nach Brønsted hingegen ist es eindeutig eine Base, da es ein Proton von Wasser aufnehmen kann:
NH₃ (aq) + H₂O (l) ⇌ NH₄⁺ (aq) + OH⁻ (aq)
In diesem Fall fungiert Wasser als Säure und gibt ein Proton an Ammoniak ab, das als Base fungiert.
Die Rolle des Lösungsmittels
Die Brønsted-Theorie betont auch die Rolle des Lösungsmittels bei Säure-Base-Reaktionen. Das Lösungsmittel kann selbst als Säure oder Base fungieren und die Protonenübertragung beeinflussen. Wasser ist ein amphoterisches Lösungsmittel, das sowohl als Säure als auch als Base fungieren kann, wie im obigen Beispiel mit Ammoniak gezeigt wurde.
Bedeutung und Anwendungen
Die Brønsted-Theorie ist nicht nur eine theoretische Grundlage, sondern hat auch weitreichende praktische Anwendungen in verschiedenen Bereichen der Chemie und verwandten Wissenschaften.
- Titrationen: Die Brønsted-Theorie ermöglicht ein genaueres Verständnis von Titrationskurven und der Auswahl geeigneter Indikatoren für Säure-Base-Titrationen.
- Biochemie: Viele biochemische Reaktionen sind Säure-Base-Reaktionen, die durch Enzyme katalysiert werden. Das Verständnis der Brønsted-Theorie ist entscheidend für das Verständnis der Mechanismen dieser Reaktionen. Die Pufferung von biologischen Systemen, wie Blut, ist ein direktes Ergebnis von Säure-Base-Gleichgewichten im Sinne von Brønsted.
- Umweltchemie: Die Versauerung von Seen und Böden durch sauren Regen ist ein wichtiges Umweltproblem. Die Brønsted-Theorie hilft uns, die chemischen Prozesse zu verstehen, die zu dieser Versauerung führen und Strategien zur Bekämpfung zu entwickeln.
- Organische Chemie: Die Brønsted-Theorie ist grundlegend für das Verständnis von Reaktionsmechanismen in der organischen Chemie, insbesondere bei Reaktionen, die Protonenübertragungen beinhalten.
Grenzen der Brønsted-Theorie
Obwohl die Brønsted-Theorie eine bedeutende Erweiterung der Arrhenius-Theorie darstellt, hat sie auch ihre Grenzen. Sie konzentriert sich ausschließlich auf Protonenübertragungen und berücksichtigt keine Reaktionen, bei denen andere Spezies übertragen werden, wie beispielsweise Elektronen. Die Lewis-Theorie der Säuren und Basen, die den Austausch von Elektronenpaaren in den Mittelpunkt stellt, bietet eine noch umfassendere Definition von Säuren und Basen und schließt die Brønsted-Theorie als Sonderfall ein.
Pädagogischer Wert
Die Vermittlung der Brønsted-Theorie ist von entscheidender Bedeutung für ein tiefes Verständnis der Chemie. Sie hilft Studierenden, über die einfache Definition von Säuren als Stoffe, die H⁺-Ionen bilden, hinauszudenken und die dynamische Natur von Säure-Base-Reaktionen zu erkennen.
Durch die Betonung des konjugierten Säure-Base-Paares lernen Studierende, die Wechselwirkungen zwischen Säuren und Basen zu verstehen und die Stärke von Säuren und Basen relativ zueinander zu beurteilen. Dies fördert kritisches Denken und Problemlösungsfähigkeiten.
Die Anwendung der Brønsted-Theorie auf reale Szenarien, wie beispielsweise Titrationen oder die Pufferung von biologischen Systemen, hilft Studierenden, die Relevanz der Chemie für ihr Leben und die Welt um sie herum zu erkennen.
Um die Brønsted-Theorie anschaulich zu vermitteln, eignen sich verschiedene Lehrmethoden:
- Demonstrationsexperimente: Experimente, die die Protonenübertragung in Echtzeit zeigen, wie beispielsweise die Reaktion von Ammoniak mit Salzsäure, können das Konzept greifbarer machen.
- Modelle: Der Einsatz von Modellen, die Protonen und Moleküle darstellen, kann helfen, die dreidimensionale Struktur von Säuren und Basen und die Art und Weise, wie sie miteinander interagieren, zu visualisieren.
- Online-Simulationen: Interaktive Simulationen ermöglichen es Studierenden, mit verschiedenen Säuren und Basen zu experimentieren und die Auswirkungen auf den pH-Wert und die Gleichgewichtslage zu beobachten.
- Fallstudien: Die Analyse realer Fallstudien, wie beispielsweise die Versauerung von Seen, kann helfen, die Brønsted-Theorie in einen größeren Kontext zu stellen und ihre Bedeutung für die Umweltwissenschaften zu verdeutlichen.
Die Brønsted-Theorie: Ein Schlüssel zum Verständnis chemischer Reaktionen
Zusammenfassend lässt sich sagen, dass die Brønsted-Theorie eine grundlegende Grundlage für das Verständnis von Säure-Base-Reaktionen darstellt. Sie bietet eine umfassendere und flexiblere Definition von Säuren und Basen als die Arrhenius-Theorie und ermöglicht es uns, eine größere Bandbreite an Reaktionen zu erklären. Ihre Anwendung reicht von der Biochemie bis zur Umweltchemie, was ihre Bedeutung für verschiedene wissenschaftliche Disziplinen unterstreicht. Die Vermittlung der Brønsted-Theorie ist entscheidend für die Ausbildung kompetenter Chemiker und für das Verständnis der chemischen Prozesse, die unsere Welt prägen. Indem wir die Protonenübertragung in den Mittelpunkt stellen, eröffnet die Brønsted-Theorie ein tieferes Verständnis der chemischen Reaktionen und ihrer Bedeutung für unser Leben.