Säure Base Theorie Von Brönsted

Die Säure-Base-Theorie von Brönsted, oft auch als Brönsted-Lowry-Theorie bezeichnet, ist ein grundlegendes Konzept in der Chemie, das das Verständnis von Säuren und Basen revolutioniert hat. Sie bietet eine breitere Definition als frühere Theorien und ist besonders nützlich, um Reaktionen in wässrigen und nicht-wässrigen Lösungen zu verstehen. Für Neuankömmlinge in Deutschland, die sich mit Chemie oder verwandten Studienfächern beschäftigen, ist ein solides Verständnis dieser Theorie unerlässlich.
Was besagt die Brönsted-Lowry-Theorie?
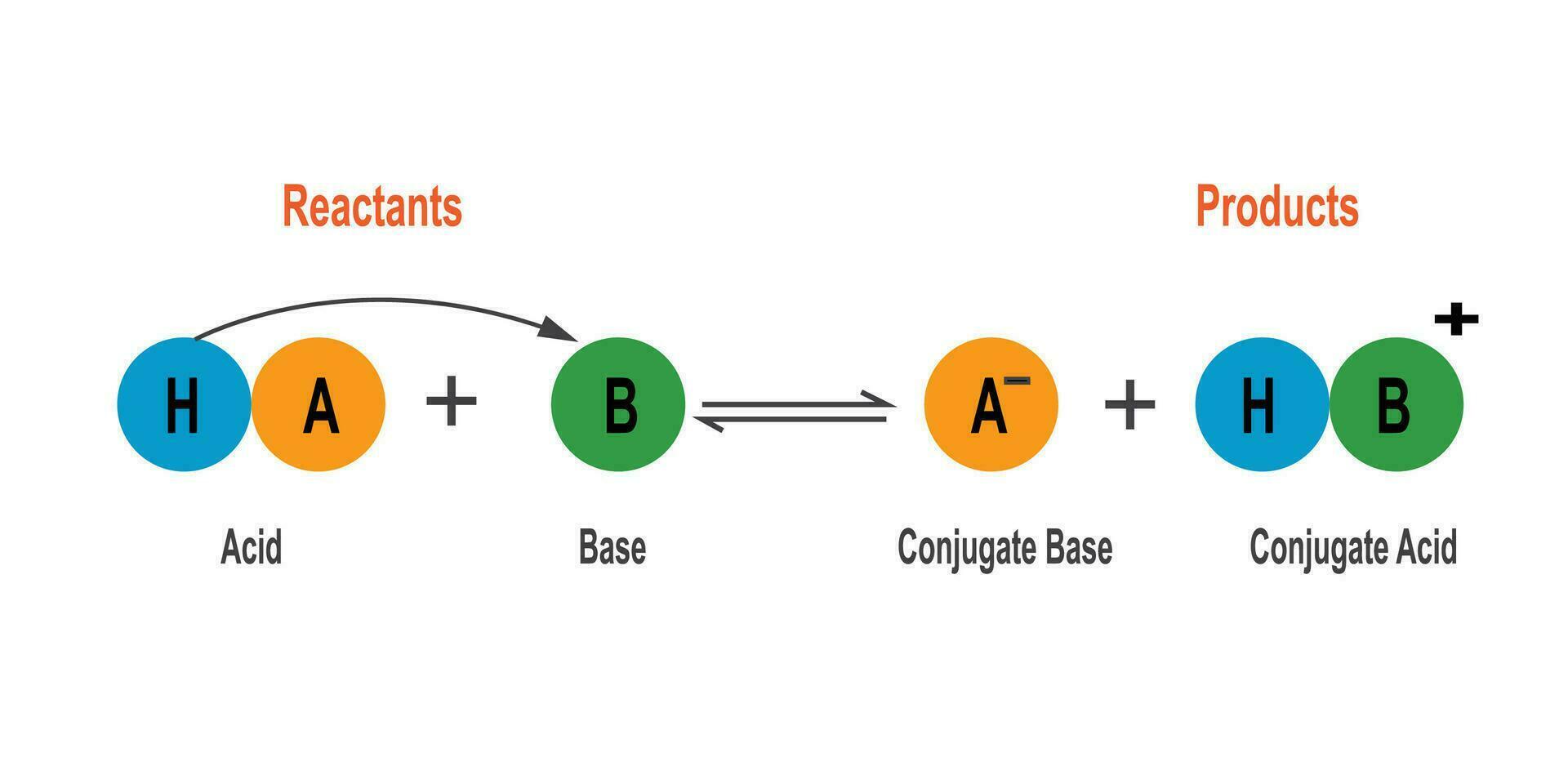
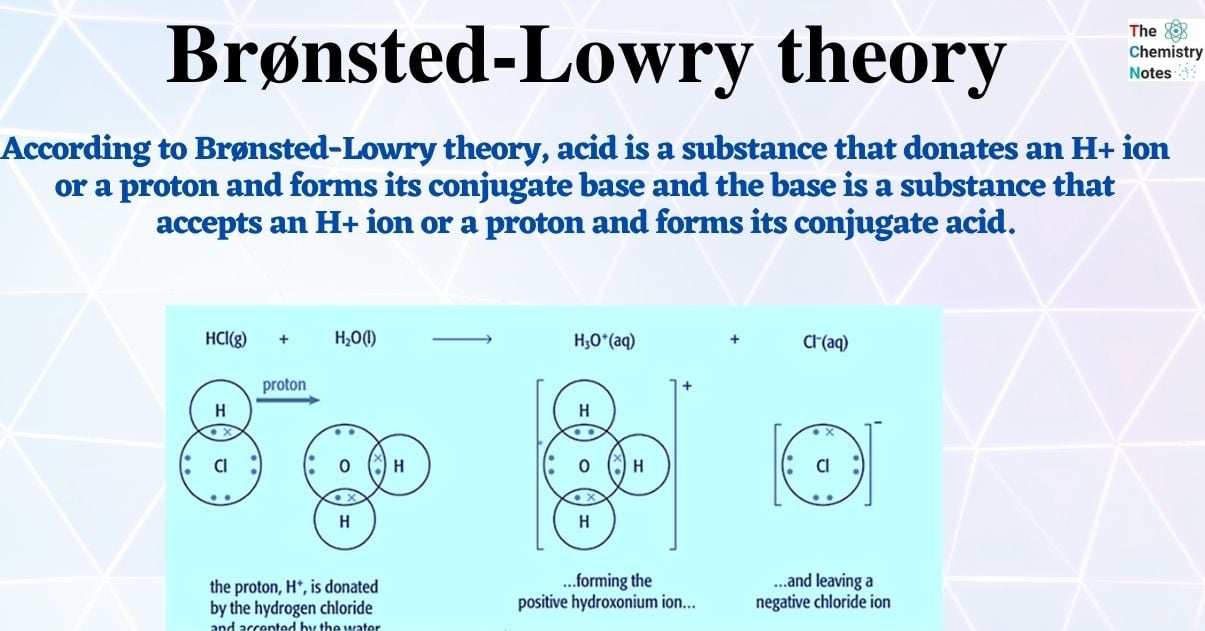
Im Kern besagt die Brönsted-Lowry-Theorie, dass eine Säure eine Substanz ist, die Protonen (H+-Ionen) abgeben kann, während eine Base eine Substanz ist, die Protonen aufnehmen kann. Es geht also um den Austausch von Protonen zwischen Molekülen oder Ionen.
Schlüsselkonzepte im Detail:
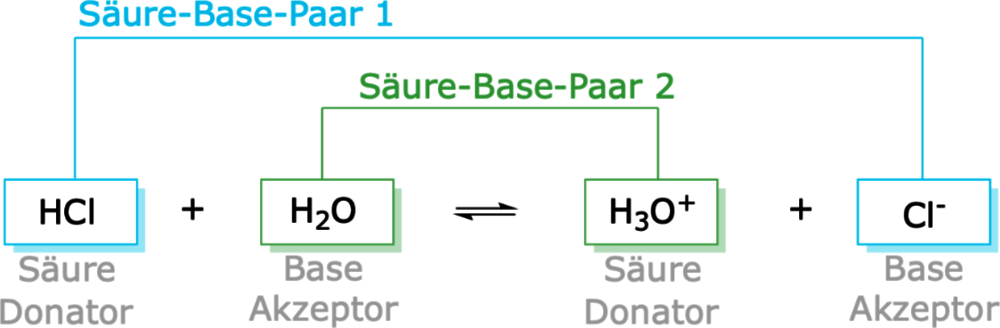
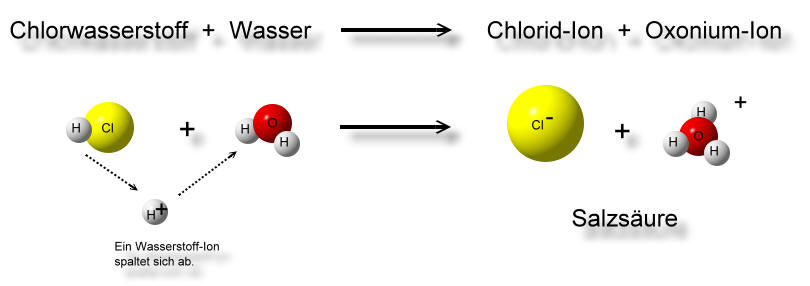
- Protonendonator (Säure): Eine Brönsted-Säure ist jede Spezies, die in der Lage ist, ein Proton (H+) an eine andere Spezies abzugeben. Salzsäure (HCl) ist ein klassisches Beispiel. In Wasser gibt HCl ein Proton an ein Wassermolekül ab und wird zu einem Chlorid-Ion (Cl-).
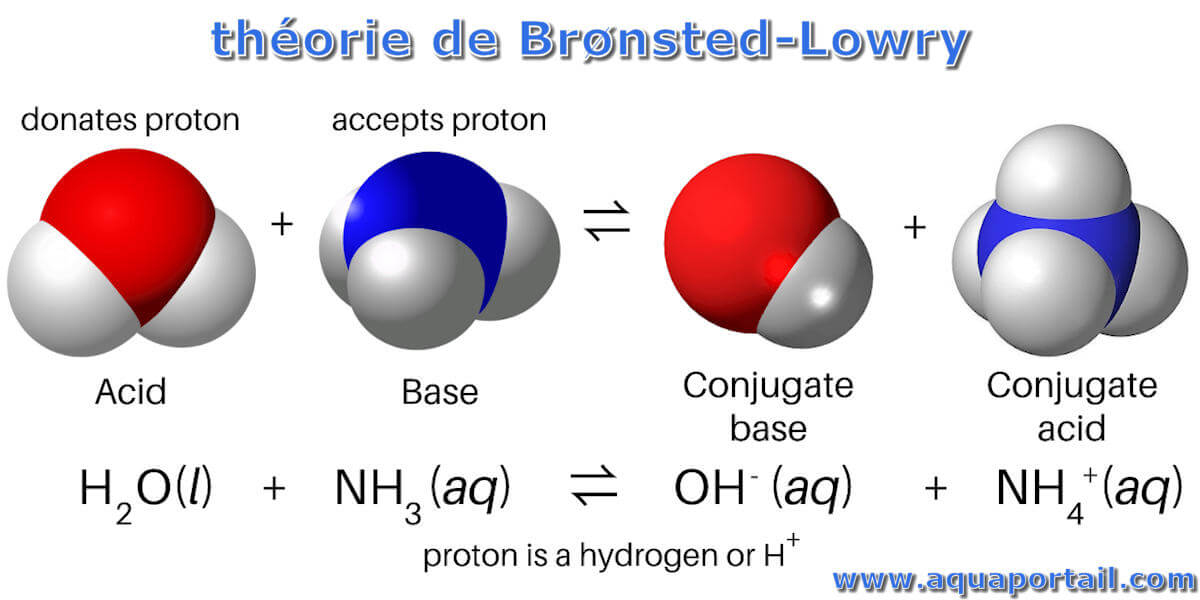
- Protonenakzeptor (Base): Eine Brönsted-Base ist jede Spezies, die in der Lage ist, ein Proton (H+) von einer anderen Spezies aufzunehmen. Ammoniak (NH3) ist ein häufiges Beispiel. In Wasser nimmt NH3 ein Proton von einem Wassermolekül auf und wird zu einem Ammonium-Ion (NH4+).
- Amphoterie: Ein wichtiges Konzept ist die Amphoterie. Amphotere Substanzen können sowohl als Säure als auch als Base reagieren, abhängig von der Reaktionsumgebung. Wasser (H2O) ist das bekannteste Beispiel. Es kann ein Proton abgeben (als Säure reagieren) oder ein Proton aufnehmen (als Base reagieren).
- Korrespondierende Säure-Base-Paare: Eine wichtige Folge der Brönsted-Lowry-Theorie ist das Konzept der korrespondierenden Säure-Base-Paare. Wenn eine Säure ein Proton abgibt, entsteht eine korrespondierende Base. Umgekehrt entsteht aus einer Base, die ein Proton aufnimmt, eine korrespondierende Säure. Zum Beispiel:
- HCl (Säure) ↔ Cl- (korrespondierende Base)
- NH3 (Base) ↔ NH4+ (korrespondierende Säure)
Wie funktioniert die Brönsted-Lowry-Theorie in der Praxis?
Betrachten wir die Reaktion von Salzsäure (HCl) mit Wasser (H2O):
HCl (aq) + H2O (l) → H3O+ (aq) + Cl- (aq)
In dieser Reaktion:
- HCl ist die Brönsted-Säure, da sie ein Proton an das Wasser abgibt.
- H2O ist die Brönsted-Base, da sie ein Proton vom HCl aufnimmt.
- H3O+ (Hydronium-Ion) ist die korrespondierende Säure zur Base H2O.
- Cl- (Chlorid-Ion) ist die korrespondierende Base zur Säure HCl.
Ein weiteres Beispiel ist die Reaktion von Ammoniak (NH3) mit Wasser:
NH3 (aq) + H2O (l) → NH4+ (aq) + OH- (aq)
Hier:
- NH3 ist die Brönsted-Base, da sie ein Proton vom Wasser aufnimmt.
- H2O ist die Brönsted-Säure, da sie ein Proton an den Ammoniak abgibt.
- NH4+ ist die korrespondierende Säure zur Base NH3.
- OH- (Hydroxid-Ion) ist die korrespondierende Base zur Säure H2O.
Vorteile der Brönsted-Lowry-Theorie gegenüber älteren Theorien
Die Brönsted-Lowry-Theorie stellt eine deutliche Verbesserung gegenüber älteren Säure-Base-Theorien dar, insbesondere der Arrhenius-Theorie. Die Arrhenius-Theorie beschränkte Säuren auf Substanzen, die in wässriger Lösung H+-Ionen freisetzen, und Basen auf Substanzen, die OH--Ionen freisetzen. Die Brönsted-Lowry-Theorie ist breiter gefasst und bietet mehrere Vorteile:
- Nicht-wässrige Lösungen: Die Brönsted-Lowry-Theorie kann Säure-Base-Reaktionen in nicht-wässrigen Lösungen erklären. Die Arrhenius-Theorie ist auf wässrige Lösungen beschränkt.
- Reaktionen ohne OH--Ionen: Die Brönsted-Lowry-Theorie kann Reaktionen erklären, bei denen keine OH--Ionen beteiligt sind, aber dennoch Säure-Base-Charakter haben. Zum Beispiel die Reaktion von Ammoniak mit Chlorwasserstoff (HCl) in der Gasphase:
NH3 (g) + HCl (g) → NH4Cl (s)
In dieser Reaktion gibt HCl ein Proton an NH3 ab, ohne dass Wasser beteiligt ist.
- Klare Definition von Säure und Base: Die Brönsted-Lowry-Theorie liefert eine klarere und konsistentere Definition von Säuren und Basen, die auf dem Protonentransfer basiert.
Anwendungsbereiche der Brönsted-Lowry-Theorie
Die Brönsted-Lowry-Theorie findet breite Anwendung in verschiedenen Bereichen der Chemie und darüber hinaus:
- Analytische Chemie: Bei Titrationen, der Bestimmung von pH-Werten und anderen analytischen Verfahren ist das Verständnis von Säure-Base-Reaktionen unerlässlich.
- Organische Chemie: Viele organische Reaktionen beinhalten Säure-Base-Mechanismen, die mithilfe der Brönsted-Lowry-Theorie erklärt werden können.
- Biochemie: Enzymatische Reaktionen und andere biochemische Prozesse sind oft pH-abhängig und beinhalten Säure-Base-Gleichgewichte. Die Pufferung von Körperflüssigkeiten, beispielsweise des Blutes, ist ein sehr wichtiger Aspekt.
- Umweltchemie: Die Brönsted-Lowry-Theorie hilft, die Auswirkungen von saurem Regen und die Pufferkapazität von Gewässern zu verstehen.
- Industrielle Chemie: Viele industrielle Prozesse, wie die Herstellung von Düngemitteln und Kunststoffen, basieren auf Säure-Base-Reaktionen.
Wichtige Überlegungen und Tipps
Hier sind einige wichtige Überlegungen und Tipps für das Verständnis und die Anwendung der Brönsted-Lowry-Theorie:
- Identifizieren Sie Säure und Base: Achten Sie darauf, welche Substanz ein Proton abgibt (Säure) und welche ein Proton aufnimmt (Base).
- Korrespondierende Paare: Erkennen Sie die korrespondierenden Säure-Base-Paare in einer Reaktion. Dies hilft beim Verständnis des Reaktionsmechanismus.
- Amphoterie: Denken Sie daran, dass einige Substanzen amphoter sind und sowohl als Säure als auch als Base reagieren können.
- Säurestärke: Berücksichtigen Sie die relative Stärke von Säuren und Basen. Starke Säuren und Basen dissoziieren vollständig in Wasser, während schwache Säuren und Basen nur teilweise dissoziieren.
- Gleichgewichte: Säure-Base-Reaktionen sind Gleichgewichtsreaktionen. Die Lage des Gleichgewichts hängt von der relativen Stärke der Säure und Base ab.
- pH-Wert: Der pH-Wert ist ein Maß für die Acidität oder Basizität einer Lösung. Ein niedriger pH-Wert bedeutet eine saure Lösung, ein hoher pH-Wert bedeutet eine basische Lösung.
Üben Sie! Das beste Verständnis der Brönsted-Lowry-Theorie erlangt man durch Übung. Lösen Sie Aufgaben, analysieren Sie Reaktionen und diskutieren Sie Konzepte mit anderen.
Zusammenfassend lässt sich sagen, dass die Brönsted-Lowry-Theorie ein unverzichtbares Werkzeug für Chemiker und Studierende ist. Sie bietet ein umfassendes und flexibles Framework für das Verständnis von Säure-Base-Reaktionen in verschiedenen Umgebungen. Indem Sie die Grundprinzipien verstehen und üben, können Sie Ihr Wissen in vielen Bereichen der Chemie und verwandten Disziplinen vertiefen.










![Säure Base Theorie Von Brönsted Basen • Definition und Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/04/WP_BasenUe_Broensted-Base-1024x576.png)