Säure Basen Definition Nach Brönsted
Hallo liebe Reisefreunde und Wissenshungrige! Eure Reisebloggerin Lisa hier, zurück von einem spannenden Ausflug in die faszinierende Welt der Chemie. Ja, ihr habt richtig gelesen! Ich weiß, Chemie klingt erstmal nicht so aufregend wie ein Sonnenuntergang am Strand oder ein belebter Marktplatz in Marrakesch, aber glaubt mir, es lohnt sich, einen Blick darauf zu werfen. Besonders, wenn man verstehen will, warum das Meer salzig ist oder warum der Kuchen im Ofen aufgeht. Heute nehme ich euch mit auf eine kleine Entdeckungstour zur Säure-Base-Definition nach Brönsted. Keine Angst, es wird nicht langweilig und wir brauchen auch keinen Kittel!
Die Brönsted-Theorie: Eine Revolution in der Chemie
Stellt euch vor, ihr seid auf einem Basar in Istanbul. Überall Händler, die Waren anbieten und tauschen. Die Brönsted-Theorie, formuliert von Johannes Nicolaus Brønsted und Thomas Martin Lowry im Jahr 1923, beschreibt Säuren und Basen im Grunde auch als Tauschpartner – allerdings nicht von Gold oder Gewürzen, sondern von Protonen, also positiv geladenen Wasserstoffionen (H+). Das klingt erstmal kompliziert, aber lasst uns das mal aufdröseln:
Säuren: Die Protonen-Spender
Eine Brönsted-Säure ist wie ein großzügiger Händler, der bereitwillig ein Proton abgibt. Denkt an Zitronensaft. Der saure Geschmack kommt von der Zitronensäure (ja, Überraschung!), die eben Protonen abgibt. Diese Protonen sind dafür verantwortlich, dass sich unser Geschmackssinn meldet und "Sauer!" schreit. Ein anderes Beispiel ist Salzsäure (HCl), die im Magen zur Verdauung beiträgt. Auch sie ist eine fleißige Protonen-Spenderin.
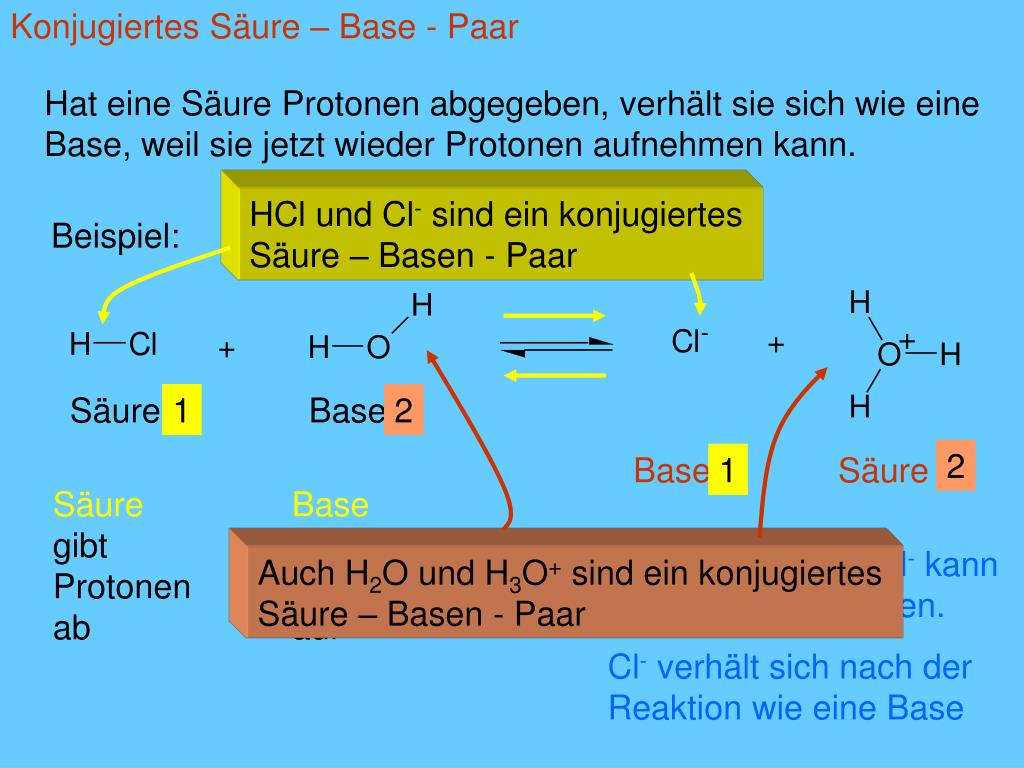
Chemisch ausgedrückt bedeutet das: Eine Säure (HA) reagiert, indem sie ein Proton (H+) abgibt und dabei zu ihrer konjugierten Base (A-) wird. Das ist wie beim Basar: Der Händler gibt die Ware ab und erhält im Gegenzug… nun ja, in diesem Fall nichts. Aber die Ware (das Proton) geht ja nicht verloren!
Wichtige Merkmale einer Brönsted-Säure:
- Sie hat die Fähigkeit, ein Proton (H+) abzugeben.
- Je leichter sie das Proton abgibt, desto stärker ist die Säure.
- Nach der Protonenabgabe entsteht eine konjugierte Base.
Basen: Die Protonen-Empfänger
Eine Brönsted-Base ist das Gegenstück: Sie ist der dankbare Abnehmer der Protonen. Sie nimmt Protonen auf, wie ein durstiger Wanderer eine Flasche Wasser. Ein gutes Beispiel ist Ammoniak (NH3), das in vielen Reinigungsmitteln vorkommt. Ammoniak hat ein freies Elektronenpaar und kann damit ein Proton "an sich ziehen".
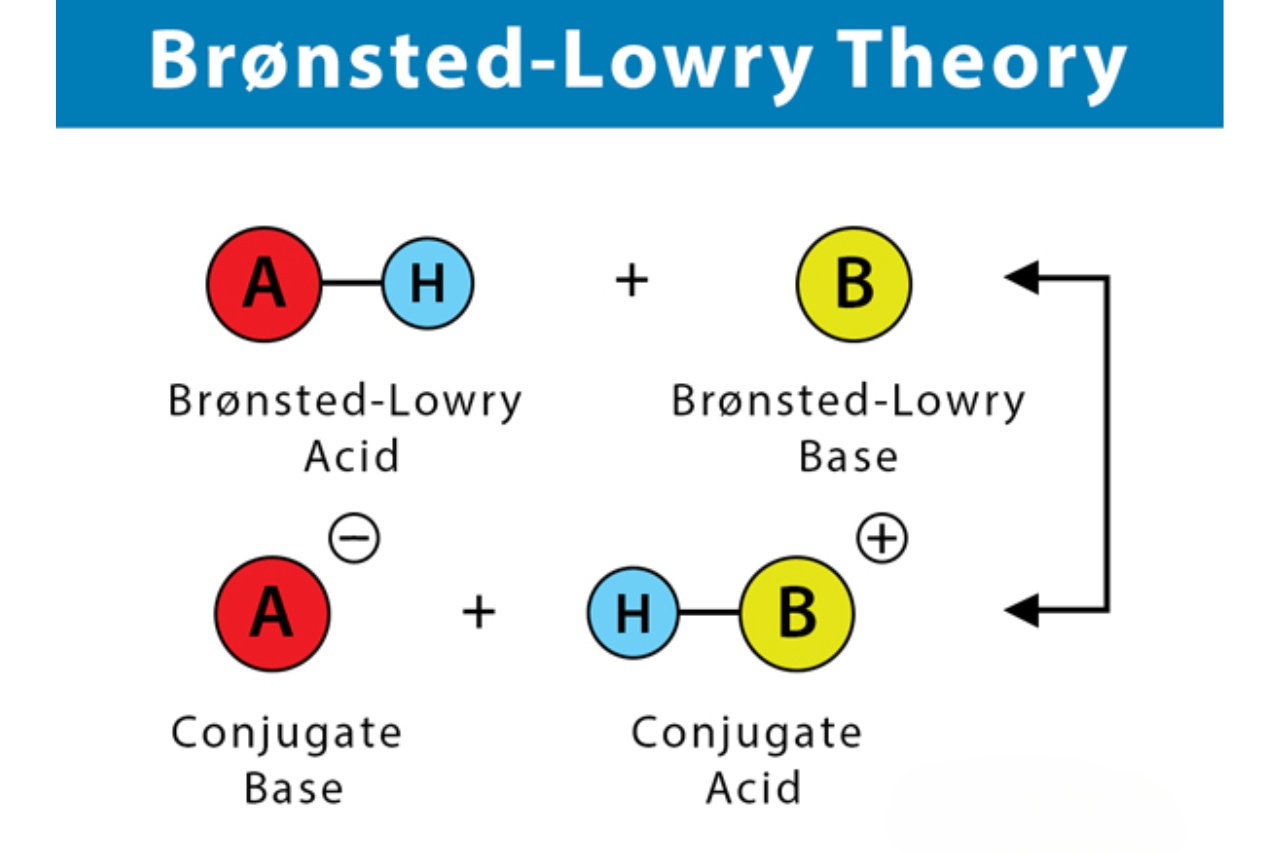
Chemisch gesehen reagiert eine Base (B) mit einem Proton (H+) und wird dabei zu ihrer konjugierten Säure (BH+). Auch hier gilt das Basar-Prinzip: Die Base nimmt das Proton auf und wird dadurch zu etwas Neuem – ihrer konjugierten Säure.
Wichtige Merkmale einer Brönsted-Base:
- Sie hat die Fähigkeit, ein Proton (H+) aufzunehmen.
- Je stärker sie das Proton anzieht, desto stärker ist die Base.
- Nach der Protonenaufnahme entsteht eine konjugierte Säure.
Das Zusammenspiel: Säure-Base-Reaktionen
Und jetzt kommt der Clou: Säuren und Basen spielen nicht alleine! Eine Säure-Base-Reaktion nach Brönsted ist immer ein Protonentransfer. Die Säure gibt ein Proton ab, und die Base nimmt es auf. Das ist wie ein Tanz, bei dem die Säure und die Base miteinander agieren und sich verändern.
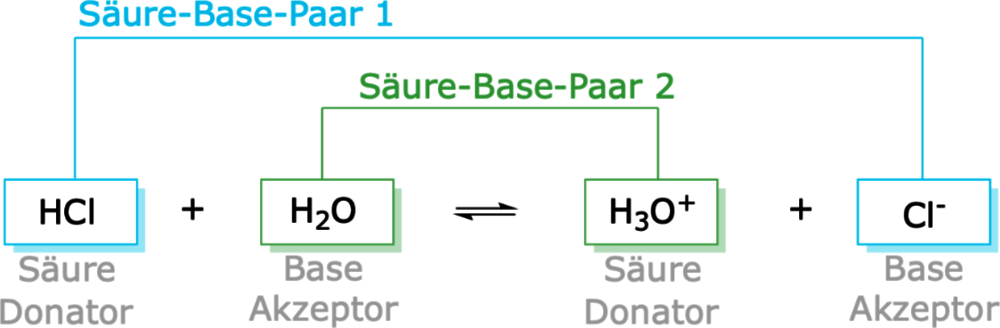
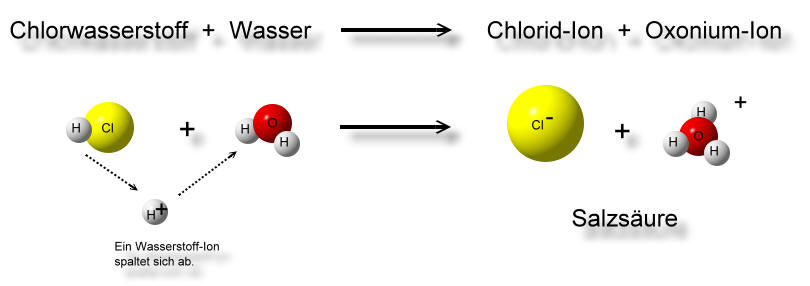
Ein einfaches Beispiel ist die Reaktion von Salzsäure (HCl) mit Wasser (H2O):
HCl (Säure) + H2O (Base) → H3O+ (konjugierte Säure) + Cl- (konjugierte Base)
Hier gibt die Salzsäure ein Proton an das Wasser ab. Das Wasser wird dadurch zum Hydronium-Ion (H3O+), der eigentlichen "sauren" Komponente in wässrigen Lösungen. Die Salzsäure wird zum Chlorid-Ion (Cl-), ihrer konjugierten Base.
Merke: Jede Säure-Base-Reaktion nach Brönsted beinhaltet immer zwei Säure-Base-Paare: Das ursprüngliche Säure-Base-Paar (HCl/Cl-) und das konjugierte Säure-Base-Paar (H3O+/H2O).
Ampholyte: Die Chamäleons unter den Molekülen
Manche Moleküle können sowohl als Säure als auch als Base reagieren – sie sind sozusagen die Chamäleons der Chemie. Solche Stoffe nennt man Ampholyte. Das bekannteste Beispiel ist wieder einmal Wasser (H2O). Wir haben ja schon gesehen, dass Wasser in der Reaktion mit Salzsäure als Base fungiert. Aber Wasser kann auch als Säure reagieren, zum Beispiel in der Reaktion mit Ammoniak (NH3):
NH3 (Base) + H2O (Säure) → NH4+ (konjugierte Säure) + OH- (konjugierte Base)
Hier gibt Wasser ein Proton an Ammoniak ab und wird dadurch zum Hydroxid-Ion (OH-), der "basischen" Komponente in wässrigen Lösungen. Ammoniak wird zum Ammonium-Ion (NH4+), seiner konjugierten Säure.
Die Fähigkeit von Ampholyten, sowohl als Säure als auch als Base zu reagieren, ist entscheidend für viele chemische und biologische Prozesse.
Warum ist das wichtig für Reisende?
Ihr fragt euch jetzt vielleicht: "Lisa, das ist ja alles ganz interessant, aber was hat das mit meinen Reisen zu tun?" Eine ganze Menge! Das Verständnis von Säuren und Basen hilft euch, die Welt um euch herum besser zu verstehen:
- Kulinarische Genüsse: Warum schmeckt Joghurt säuerlich? Warum geht ein Kuchen im Ofen auf? Säure-Base-Reaktionen spielen eine Schlüsselrolle bei der Herstellung und dem Geschmack vieler Lebensmittel.
- Umweltbewusstsein: Warum ist saurer Regen schädlich? Wie beeinflusst die Verschmutzung von Gewässern den pH-Wert? Das Verständnis von Säure-Base-Chemie hilft euch, die Auswirkungen menschlichen Handelns auf die Umwelt besser zu verstehen.
- Gesundheit und Wohlbefinden: Wie funktioniert die Verdauung im Magen? Warum ist ein ausgeglichener Säure-Basen-Haushalt im Körper wichtig? Die Kenntnis der Säure-Base-Chemie kann euch helfen, informierte Entscheidungen für eure Gesundheit zu treffen.
Und ganz ehrlich: Es ist doch auch einfach cool, ein bisschen mehr über die Welt zu wissen! Wenn ihr das nächste Mal an einem Strand steht und die salzige Meeresluft einatmet, könnt ihr euch denken: "Ah, das ist auch eine Säure-Base-Reaktion, die da passiert!" (Na gut, vielleicht nicht laut aussprechen, sonst haltet man euch für verrückt... 😉)
Ich hoffe, dieser kleine Ausflug in die Welt der Brönsted-Theorie hat euch gefallen. Lasst mich wissen, wenn ihr Fragen habt oder weitere Themenvorschläge für zukünftige Reise- und Wissensabenteuer! Bis zum nächsten Mal, eure Lisa.



![Säure Basen Definition Nach Brönsted Basen • Definition und Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/04/WP_BasenUe_Broensted-Base-1024x576.png)





![Säure Basen Definition Nach Brönsted Ampholyte • Eigenschaften einfach erklärt · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/05/WP_Ampholyte-1-1024x576.jpg)



