Säure Und Basen Nach Brönsted

In der Chemie spielen Säuren und Basen eine fundamentale Rolle. Es gibt verschiedene Definitionen von Säuren und Basen, aber die nach Johannes Nicolaus Brønsted und Martin Lowry ist besonders nützlich und weit verbreitet, da sie sich auf den Transfer von Protonen (H+-Ionen) konzentriert. Dieses Konzept ist als die Brønsted-Theorie bekannt.
Was ist die Brønsted-Theorie?
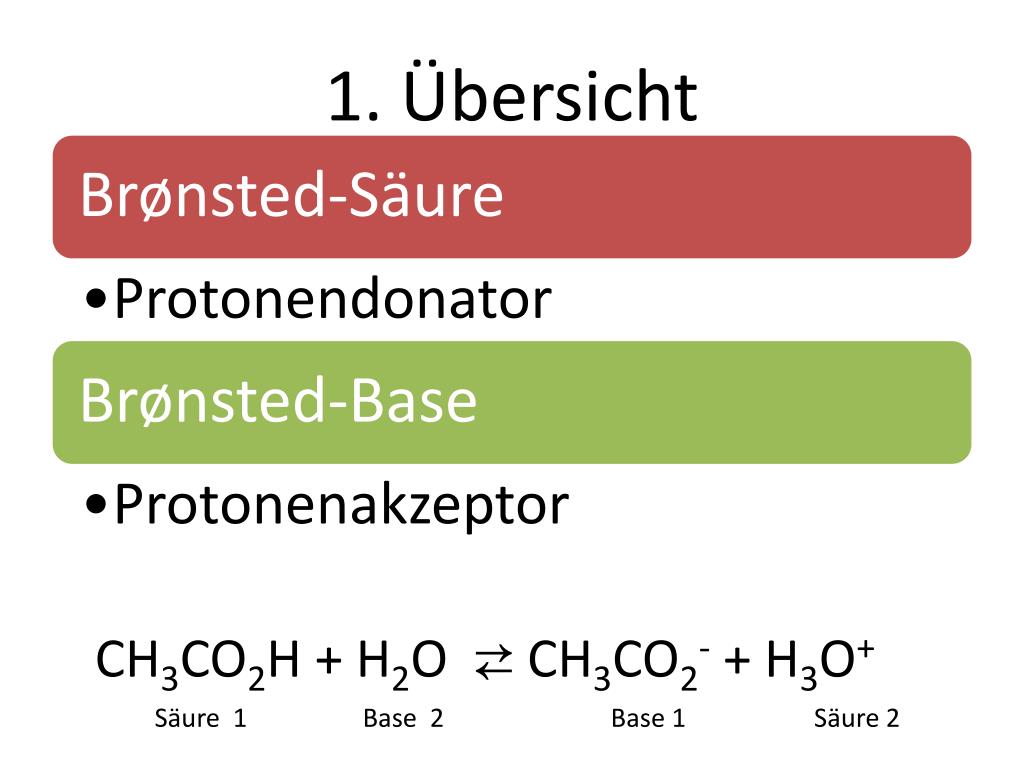
Die Brønsted-Theorie, auch bekannt als Protonentheorie, besagt, dass:
- Eine Brønsted-Säure ist eine Substanz, die Protonen (H+) abgeben kann. Sie wird auch als Protonendonator bezeichnet.
- Eine Brønsted-Base ist eine Substanz, die Protonen (H+) aufnehmen kann. Sie wird auch als Protonenakzeptor bezeichnet.
Im Wesentlichen beschreibt die Brønsted-Theorie Säure-Base-Reaktionen als Protonenübertragungsreaktionen. Eine Säure gibt ein Proton ab, und eine Base nimmt dieses Proton auf. Dies geschieht gleichzeitig; eine Säure kann kein Proton abgeben, ohne dass eine Base vorhanden ist, die es aufnimmt, und umgekehrt.
Beispiele für Brønsted-Säuren und -Basen
Hier sind einige Beispiele, um das Konzept zu verdeutlichen:
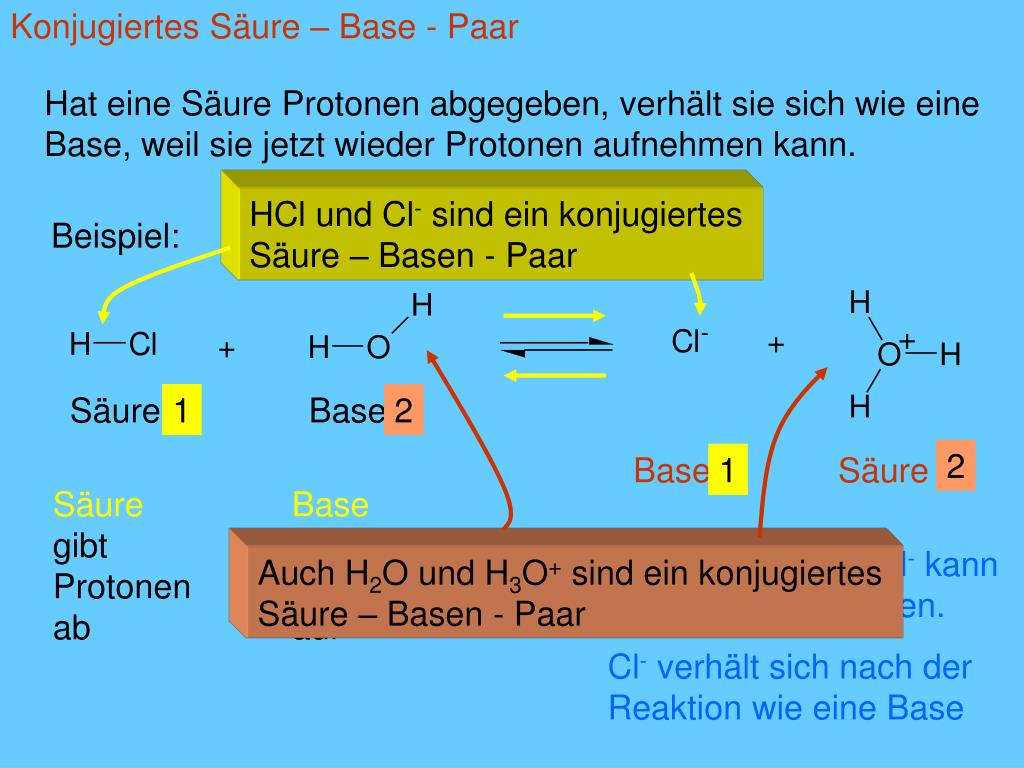
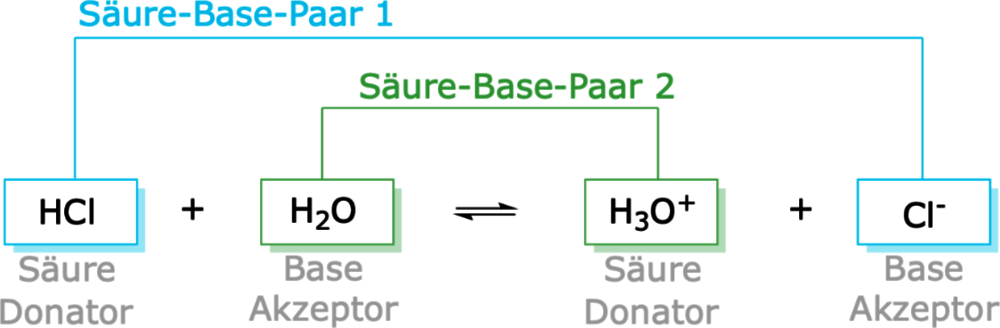
- Salzsäure (HCl): HCl ist eine starke Brønsted-Säure. In Wasser löst sie sich auf und gibt ein Proton (H+) an ein Wassermolekül (H2O) ab, wobei ein Chlorid-Ion (Cl-) und ein Hydronium-Ion (H3O+) entstehen.
Gleichung: HCl + H2O → H3O+ + Cl- In diesem Fall ist HCl die Säure (Protonendonator) und H2O die Base (Protonenakzeptor). - Ammoniak (NH3): NH3 ist eine Brønsted-Base. In Wasser nimmt es ein Proton von einem Wassermolekül auf und bildet ein Ammonium-Ion (NH4+) und ein Hydroxid-Ion (OH-).
Gleichung: NH3 + H2O → NH4+ + OH- Hier ist NH3 die Base (Protonenakzeptor) und H2O die Säure (Protonendonator). - Essigsäure (CH3COOH): Essigsäure ist eine schwache Brønsted-Säure. Sie gibt in Wasser nur teilweise Protonen ab.
Gleichung: CH3COOH + H2O ⇌ H3O+ + CH3COO- (Das ⇌ Zeichen deutet auf eine reversible Reaktion hin.) - Hydroxid-Ion (OH-): Das Hydroxid-Ion ist eine starke Brønsted-Base und ein sehr gutes Protonenakzeptor.
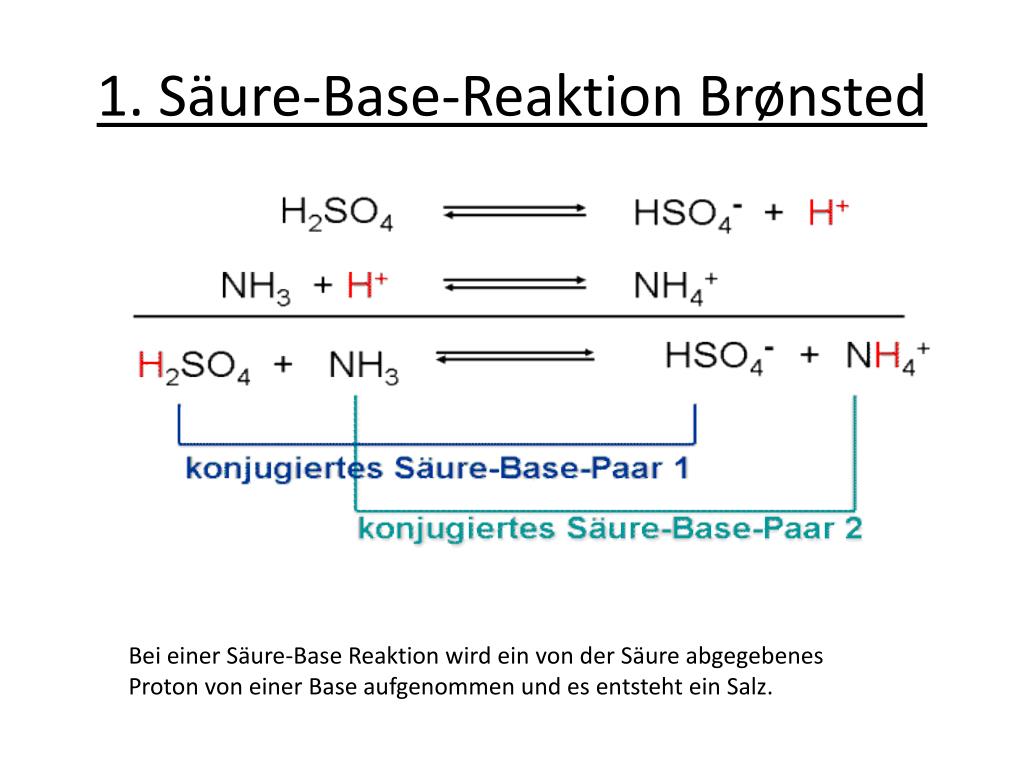
Konjugierte Säure-Base-Paare
Ein wichtiges Konzept im Zusammenhang mit der Brønsted-Theorie ist das Konzept der konjugierten Säure-Base-Paare. Wenn eine Säure ein Proton abgibt, bildet sie eine konjugierte Base. Wenn eine Base ein Proton aufnimmt, bildet sie eine konjugierte Säure.
Betrachten wir wieder die Reaktion von Salzsäure mit Wasser: HCl + H2O → H3O+ + Cl-
- HCl (Säure) und Cl- (konjugierte Base) bilden ein konjugiertes Säure-Base-Paar. Cl- kann potenziell ein Proton aufnehmen, um wieder HCl zu bilden, obwohl dies in dieser Reaktion nur sehr wenig passiert.
- H2O (Base) und H3O+ (konjugierte Säure) bilden ein konjugiertes Säure-Base-Paar. H3O+ kann ein Proton abgeben, um wieder H2O zu bilden.
Allgemein gilt: Säure ⇌ konjugierte Base + H+ Base + H+ ⇌ konjugierte Säure
Amphotere Substanzen
Einige Substanzen können sowohl als Säure als auch als Base fungieren, je nachdem, mit welcher anderen Substanz sie reagieren. Diese Substanzen werden als amphoter oder amphiprotisch bezeichnet. Das bekannteste Beispiel ist Wasser (H2O).
Wie bereits gezeigt, kann Wasser als Base reagieren, wenn es ein Proton von HCl aufnimmt. Es kann aber auch als Säure reagieren, wenn es ein Proton an NH3 abgibt. Die Fähigkeit, sowohl als Säure als auch als Base zu fungieren, macht Wasser zu einem wichtigen Lösungsmittel für viele chemische Reaktionen.
Stärke von Säuren und Basen
Die Stärke einer Säure oder Base bezieht sich auf ihre Fähigkeit, Protonen abzugeben bzw. aufzunehmen. Starke Säuren dissoziieren in Wasser vollständig und geben fast alle ihre Protonen ab. Starke Basen reagieren vollständig mit Wasser und nehmen fast alle verfügbaren Protonen auf. Schwache Säuren und Basen dissoziieren bzw. reagieren nur teilweise.
Die Stärke einer Säure wird oft durch ihre Säurekonstante (Ka) quantifiziert. Je größer der Ka-Wert, desto stärker die Säure. Analog dazu wird die Stärke einer Base durch ihre Basenkonstante (Kb) quantifiziert. Je größer der Kb-Wert, desto stärker die Base. Häufig wird auch der pKa-Wert verwendet (pKa = -log Ka). Ein kleinerer pKa-Wert entspricht einer stärkeren Säure.
Die Stärke einer Säure und ihrer konjugierten Base stehen in einer inversen Beziehung zueinander. Eine starke Säure hat eine schwache konjugierte Base, und eine schwache Säure hat eine starke konjugierte Base.
Bedeutung der Brønsted-Theorie
Die Brønsted-Theorie ist in vielen Bereichen der Chemie von Bedeutung, einschließlich:
- Organische Chemie: Viele organische Reaktionen beinhalten Säure-Base-Katalyse.
- Biochemie: Enzymatische Reaktionen sind oft pH-abhängig, da die Protonierung oder Deprotonierung von Molekülen die Reaktivität beeinflussen kann.
- Analytische Chemie: Die Titration von Säuren und Basen ist eine wichtige analytische Technik.
- Umweltchemie: Die Brønsted-Theorie ist wichtig für das Verständnis von Säure-Regen, der Wasserchemie und anderen Umweltprozessen.
- Industrielle Chemie: Viele industrielle Prozesse, wie z.B. die Herstellung von Düngemitteln und Kunststoffen, beinhalten Säure-Base-Reaktionen.
Die Brønsted-Theorie bietet ein klares und nützliches Modell, um Säure-Base-Reaktionen zu verstehen und vorherzusagen. Durch die Konzentration auf den Protonentransfer ermöglicht sie es uns, das Verhalten von Säuren und Basen in verschiedenen Systemen zu erklären und zu manipulieren.
Unterschiede zur Arrhenius-Theorie
Es ist wichtig zu beachten, dass es noch eine andere, ältere Definition von Säuren und Basen gibt: die Arrhenius-Theorie. Nach Arrhenius sind Säuren Substanzen, die in Wasser H+-Ionen freisetzen, und Basen sind Substanzen, die in Wasser OH--Ionen freisetzen. Während die Arrhenius-Theorie für wässrige Lösungen nützlich ist, ist sie weniger allgemein als die Brønsted-Theorie.
Die Brønsted-Theorie hat folgende Vorteile gegenüber der Arrhenius-Theorie:
- Sie ist nicht auf wässrige Lösungen beschränkt. Säure-Base-Reaktionen können auch in anderen Lösungsmitteln oder sogar in der Gasphase stattfinden.
- Sie erklärt das basische Verhalten von Substanzen wie Ammoniak (NH3), die keine OH--Ionen enthalten.
Obwohl die Arrhenius-Theorie eine gute Grundlage bietet, ist die Brønsted-Theorie umfassender und relevanter für eine breitere Palette chemischer Reaktionen.
Zusammenfassung
Die Brønsted-Theorie definiert Säuren als Protonendonatoren und Basen als Protonenakzeptoren. Säure-Base-Reaktionen sind Protonenübertragungsreaktionen. Das Konzept der konjugierten Säure-Base-Paare und amphoterer Substanzen ist eng mit dieser Theorie verbunden. Die Brønsted-Theorie ist ein grundlegendes Konzept in der Chemie und hat zahlreiche Anwendungen in verschiedenen Bereichen, von der organischen Chemie bis zur Umweltchemie. Sie ist eine Erweiterung der Arrhenius-Theorie und bietet ein umfassenderes Verständnis von Säure-Base-Verhalten.
Das Verständnis der Brønsted-Theorie ist für jeden, der sich mit Chemie beschäftigt, unerlässlich und bietet eine solide Grundlage für das Verständnis komplexerer chemischer Prozesse.


![Säure Und Basen Nach Brönsted Ampholyte • Eigenschaften einfach erklärt · [mit Video]](https://blog.assets.studyflix.de/wp-content/uploads/2023/05/WP_Ampholyte-1-1024x576.jpg)


![Säure Und Basen Nach Brönsted Basen • Definition und Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/04/WP_BasenUe_Broensted-Base-1024x576.png)


![Säure Und Basen Nach Brönsted Brönsted Säure • Brönsted/Brønsted Säure-Base-Theorie · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/06/Säure-Thumbnail-1024x576.png)





