Säuren Und Basen Nach Brönsted

Willkommen! In diesem Artikel werden wir das Konzept von Säuren und Basen nach Brönsted erläutern. Dieses Modell ist ein grundlegendes Konzept in der Chemie und hilft uns zu verstehen, wie Substanzen miteinander reagieren und Protonen (H+-Ionen) austauschen.
Was ist die Brönsted-Theorie?
Die Brönsted-Theorie, auch bekannt als die Brönsted-Lowry-Theorie, wurde 1923 unabhängig voneinander von Johannes Nicolaus Brønsted und Thomas Martin Lowry vorgeschlagen. Sie definiert Säuren und Basen anhand ihrer Fähigkeit, Protonen (H+-Ionen) abzugeben oder aufzunehmen.
Brönsted-Säuren
Eine Brönsted-Säure ist eine Substanz, die in der Lage ist, ein Proton (H+-Ion) an eine andere Substanz abzugeben. Sie ist also ein Protonendonator. Betrachten wir die folgende Reaktion:
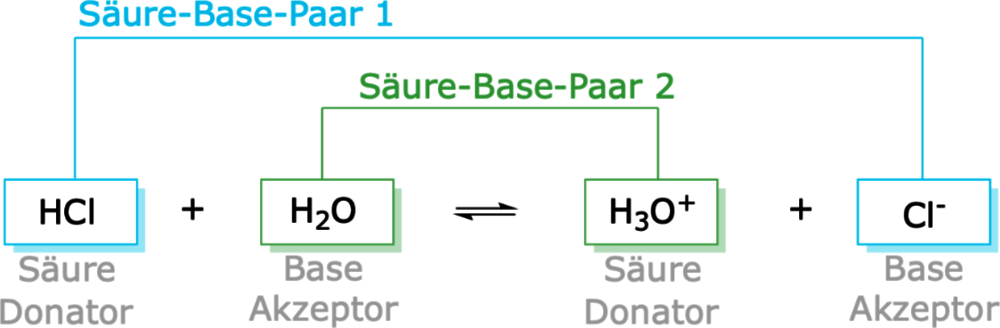
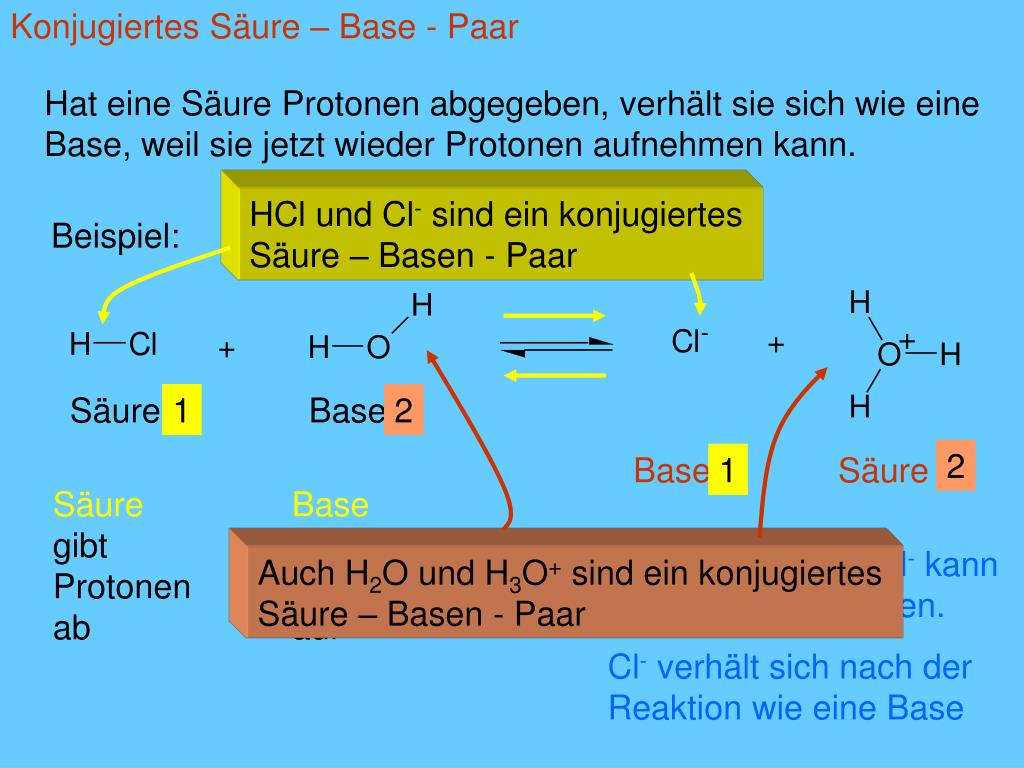
HCl (aq) + H2O (l) → H3O+ (aq) + Cl- (aq)
In dieser Reaktion gibt Chlorwasserstoff (HCl) ein Proton an Wasser (H2O) ab. Daher ist HCl eine Brönsted-Säure.
Brönsted-Basen
Eine Brönsted-Base ist eine Substanz, die in der Lage ist, ein Proton (H+-Ion) von einer anderen Substanz aufzunehmen. Sie ist also ein Protonenakzeptor. Im obigen Beispiel ist Wasser (H2O) eine Brönsted-Base, da es ein Proton von HCl aufnimmt und zum Hydronium-Ion (H3O+) wird.
Konjugierte Säure-Base-Paare
Eine wichtige Konsequenz der Brönsted-Theorie ist das Konzept der konjugierten Säure-Base-Paare. Wenn eine Säure ein Proton abgibt, entsteht eine Base. Diese Base wird als die konjugierte Base der ursprünglichen Säure bezeichnet. Umgekehrt entsteht beim Aufnehmen eines Protons durch eine Base eine Säure, die als die konjugierte Säure der ursprünglichen Base bezeichnet wird.
Betrachten wir noch einmal die obige Reaktion:
HCl (aq) + H2O (l) → H3O+ (aq) + Cl- (aq)
Hier sind die konjugierten Säure-Base-Paare:
- HCl (Säure) / Cl- (konjugierte Base)
- H2O (Base) / H3O+ (konjugierte Säure)
Das bedeutet, dass Chlorid-Ion (Cl-) die konjugierte Base der Salzsäure (HCl) ist, und Hydronium-Ion (H3O+) die konjugierte Säure von Wasser (H2O) ist.
Stärke von Säuren und Basen
Die Stärke einer Säure oder Base bezieht sich auf ihre Tendenz, ein Proton abzugeben oder aufzunehmen. Starke Säuren und Basen dissoziieren (zerfallen) in wässriger Lösung vollständig in Ionen, während schwache Säuren und Basen nur teilweise dissoziieren.
Starke Säuren
Starke Säuren geben ihre Protonen leicht ab und dissoziieren in Wasser vollständig. Einige Beispiele für starke Säuren sind:
- Salzsäure (HCl)
- Schwefelsäure (H2SO4)
- Salpetersäure (HNO3)
- Perchlorsäure (HClO4)
- Bromwasserstoffsäure (HBr)
- Iodwasserstoffsäure (HI)
Wenn eine starke Säure in Wasser gelöst wird, reagiert sie vollständig, um Hydronium-Ionen (H3O+) und ihre konjugierte Base zu bilden. Beispielsweise:
HCl (aq) + H2O (l) → H3O+ (aq) + Cl- (aq) (vollständig)
Starke Basen
Starke Basen nehmen Protonen leicht auf und dissoziieren in Wasser vollständig in Ionen. Einige Beispiele für starke Basen sind:
- Natriumhydroxid (NaOH)
- Kaliumhydroxid (KOH)
- Calciumhydroxid (Ca(OH)2)
- Bariumhydroxid (Ba(OH)2)
Wenn eine starke Base in Wasser gelöst wird, reagiert sie vollständig, um Hydroxid-Ionen (OH-) zu bilden. Beispielsweise:
NaOH (s) → Na+ (aq) + OH- (aq) (vollständig)
Schwache Säuren und Basen
Schwache Säuren und schwache Basen dissoziieren in Wasser nur teilweise. Dies bedeutet, dass in einer Lösung einer schwachen Säure oder Base sowohl die undissoziierte Säure/Base als auch ihre konjugierte Base/Säure vorhanden sind.
Ein Beispiel für eine schwache Säure ist Essigsäure (CH3COOH):
CH3COOH (aq) + H2O (l) ⇌ H3O+ (aq) + CH3COO- (aq) (Gleichgewicht)
Hier ist das Gleichgewicht stark auf der Seite der undissoziierten Essigsäure, was bedeutet, dass nur ein kleiner Teil der Essigsäure Protonen an Wasser abgibt.
Ein Beispiel für eine schwache Base ist Ammoniak (NH3):
NH3 (aq) + H2O (l) ⇌ NH4+ (aq) + OH- (aq) (Gleichgewicht)
Auch hier liegt das Gleichgewicht stark auf der Seite des undissoziierten Ammoniaks.
Amphoterie
Einige Substanzen können sowohl als Säure als auch als Base fungieren. Diese Substanzen werden als amphoter bezeichnet. Wasser ist ein klassisches Beispiel für eine amphotere Substanz.
Wasser kann als Säure fungieren und ein Proton an eine Base abgeben:
H2O (l) + NH3 (aq) ⇌ OH- (aq) + NH4+ (aq) (Wasser fungiert als Säure)
Wasser kann auch als Base fungieren und ein Proton von einer Säure aufnehmen:
H2O (l) + HCl (aq) → H3O+ (aq) + Cl- (aq) (Wasser fungiert als Base)
Bedeutung der Brönsted-Theorie
Die Brönsted-Theorie ist ein äußerst nützliches Konzept, da sie eine breitere Definition von Säuren und Basen bietet als frühere Theorien, wie z.B. die Arrhenius-Theorie. Die Brönsted-Theorie beschränkt sich nicht auf wässrige Lösungen und kann Reaktionen in verschiedenen Lösungsmitteln erklären. Sie ist besonders wichtig, um Reaktionen zu verstehen, bei denen Protonen übertragen werden, z. B. bei der Neutralisation, Titration und vielen organischen Reaktionen.
Zusammenfassung
Die Brönsted-Theorie definiert Säuren als Protonendonatoren und Basen als Protonenakzeptoren. Jede Säure hat eine konjugierte Base, und jede Base hat eine konjugierte Säure. Die Stärke einer Säure oder Base bestimmt, wie leicht sie ein Proton abgibt oder aufnimmt. Amphoterie beschreibt Substanzen, die sowohl als Säure als auch als Base fungieren können. Das Verständnis der Brönsted-Theorie ist entscheidend für das Verständnis chemischer Reaktionen, insbesondere in der organischen Chemie und Biochemie.





![Säuren Und Basen Nach Brönsted Ampholyte • Eigenschaften einfach erklärt · [mit Video]](https://blog.assets.studyflix.de/wp-content/uploads/2023/05/WP_Ampholyte-1-1024x576.jpg)







![Säuren Und Basen Nach Brönsted Basen • Definition und Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/04/WP_BasenUe_Basen-als-Protonenakzeptoren-1024x576.png)