Titrationskurve Schwache Säure Starke Base

Titrationskurven sind grafische Darstellungen, die den pH-Wert einer Lösung während einer Titration gegen das hinzugefügte Volumen einer Titrationslösung aufzeigen. Eine Titrationskurve für eine schwache Säure mit einer starken Base hat spezifische Merkmale, die sie von anderen Titrationskurven unterscheiden. Das Verständnis dieser Merkmale ist entscheidend für die korrekte Durchführung und Interpretation von Titrationen.
Grundlagen: Schwache Säuren und Starke Basen
Zuerst ist es wichtig, die Unterschiede zwischen schwachen Säuren und starken Basen zu verstehen:
- Schwache Säuren: Schwache Säuren dissoziieren in Wasser nicht vollständig in ihre Ionen. Das bedeutet, dass nur ein Teil der Säuremoleküle in Wasser ihre Protonen (H+) abgibt. Ein bekanntes Beispiel ist Essigsäure (CH3COOH), die in Essig vorkommt. Die Dissoziation einer schwachen Säure wird durch das Säuredissoziationsgleichgewicht und die Säurekonstante (Ka) beschrieben. Je kleiner der Ka-Wert, desto schwächer die Säure.
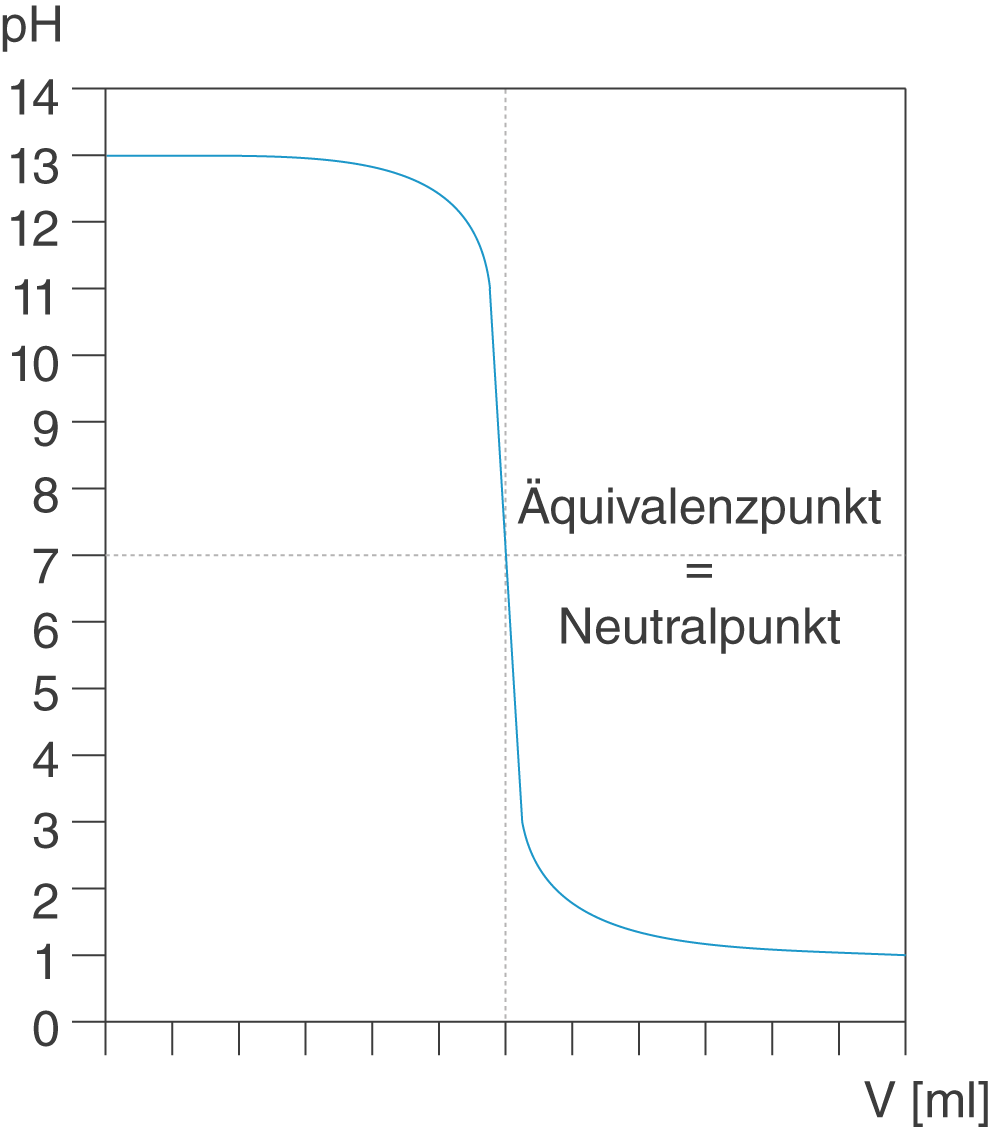
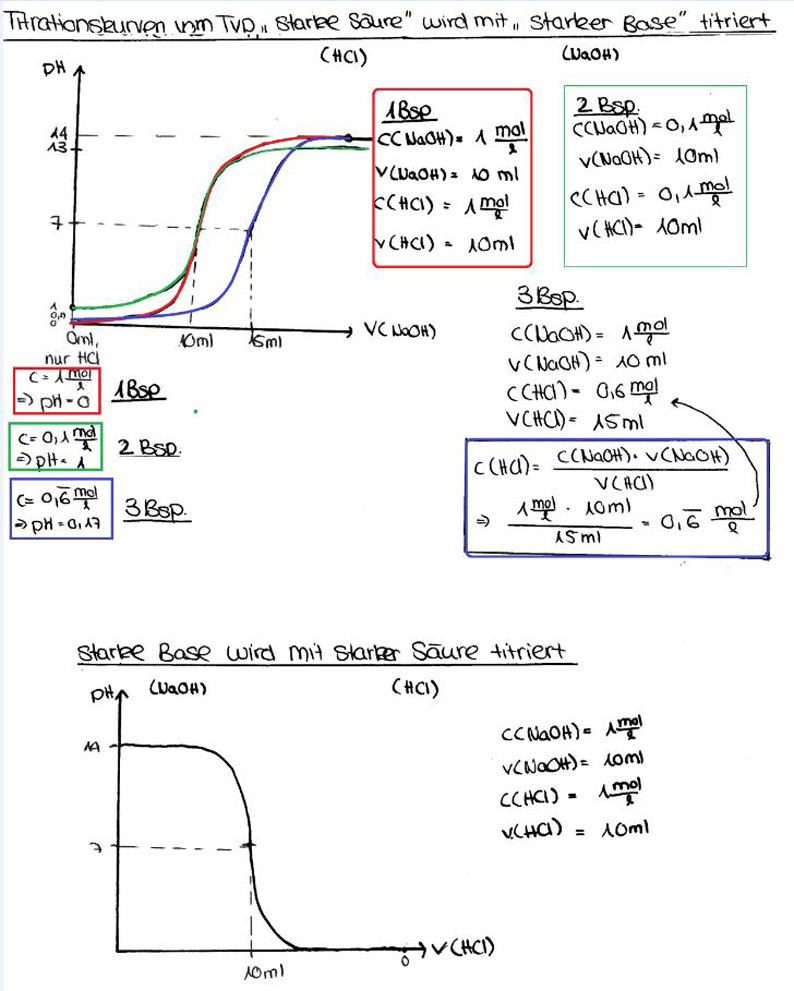
- Starke Basen: Starke Basen dissoziieren in Wasser vollständig in ihre Ionen. Dies bedeutet, dass fast alle Basenmoleküle Hydroxidionen (OH-) freisetzen. Typische Beispiele sind Natriumhydroxid (NaOH) und Kaliumhydroxid (KOH). Da sie vollständig dissoziieren, gibt es keine Gleichgewichtskonstante wie bei schwachen Säuren.
Die Titrationskurve im Detail
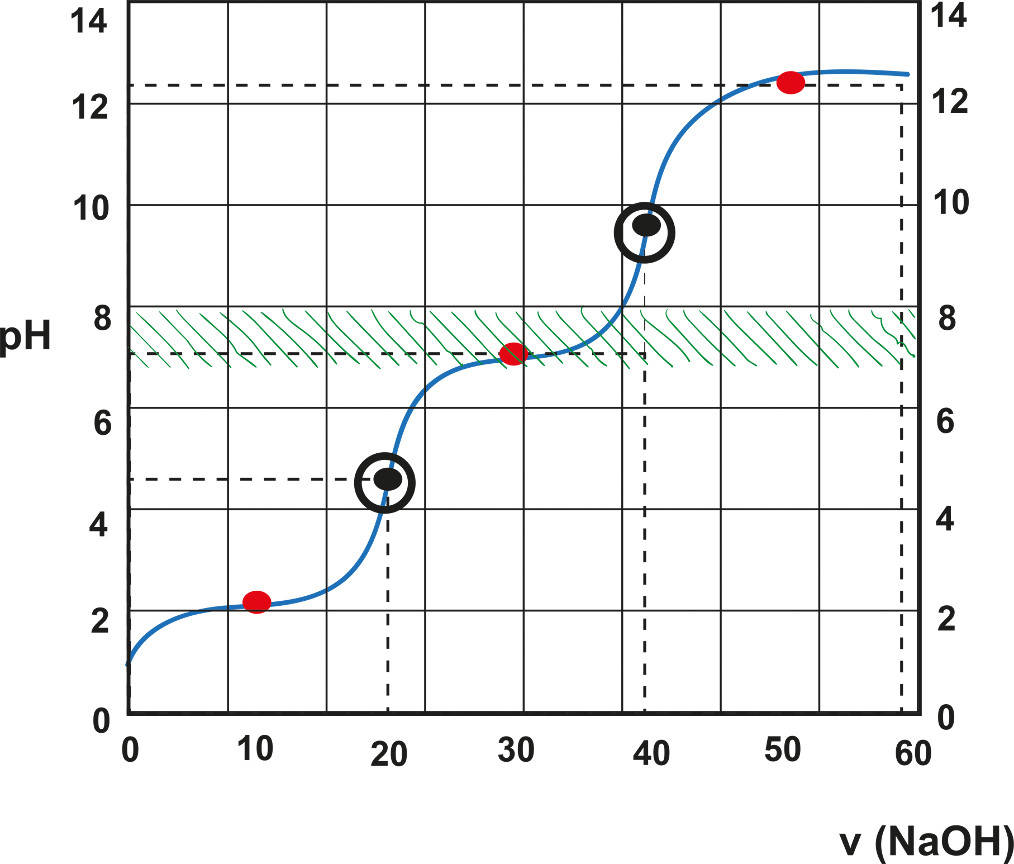
Eine Titrationskurve für eine schwache Säure mit einer starken Base hat im Wesentlichen drei charakteristische Abschnitte:
1. Anfangs-pH-Wert
Der pH-Wert zu Beginn der Titration ist nicht so niedrig wie bei einer starken Säure. Da die schwache Säure nur teilweise dissoziiert, ist die Konzentration an H+-Ionen geringer. Der genaue pH-Wert hängt von der Konzentration der schwachen Säure und ihrem Ka-Wert ab. Er kann mit der folgenden Formel näherungsweise berechnet werden:
pH = -log(√(Ka * C))
wobei C die anfängliche Konzentration der schwachen Säure ist.
2. Der Pufferbereich
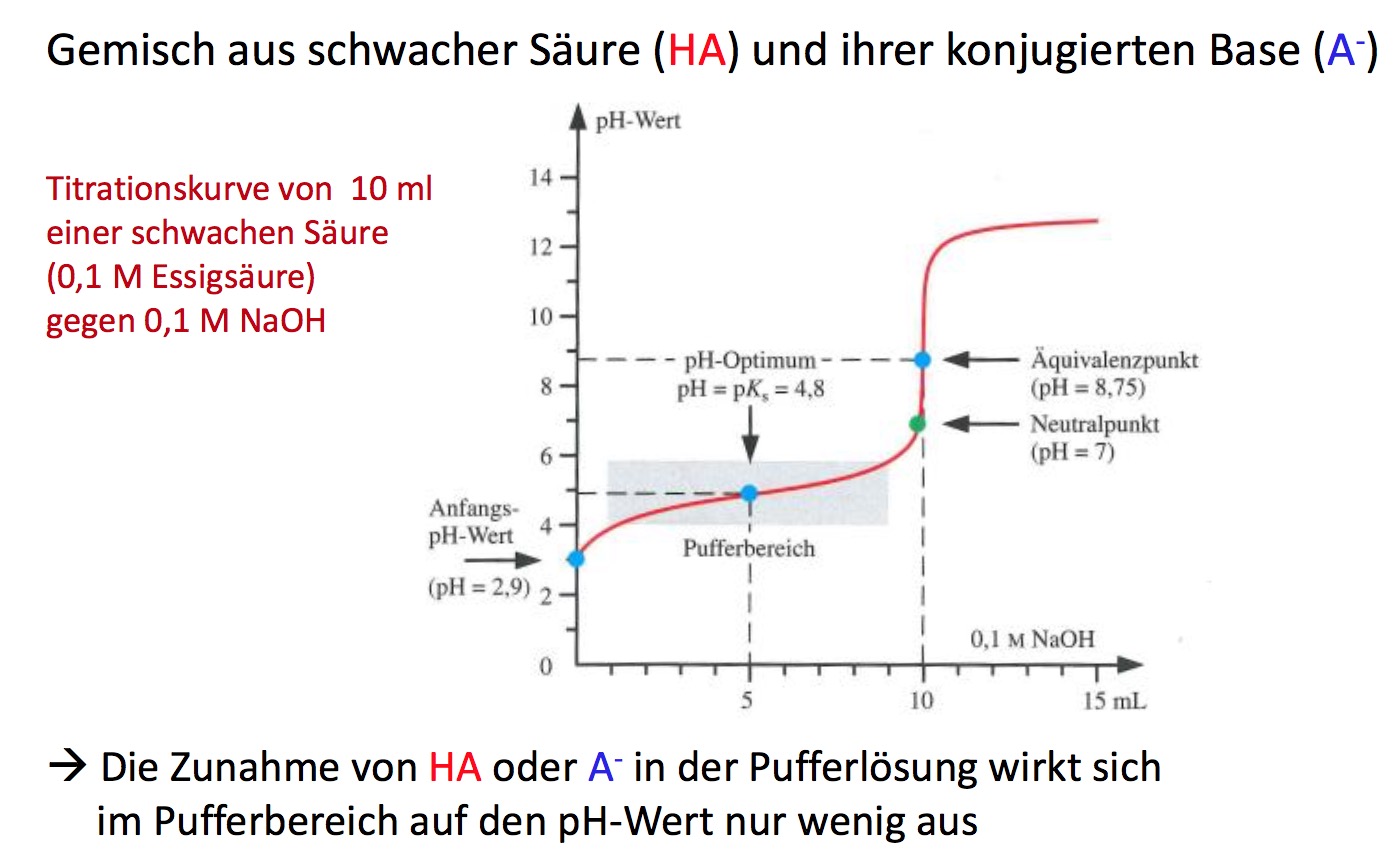
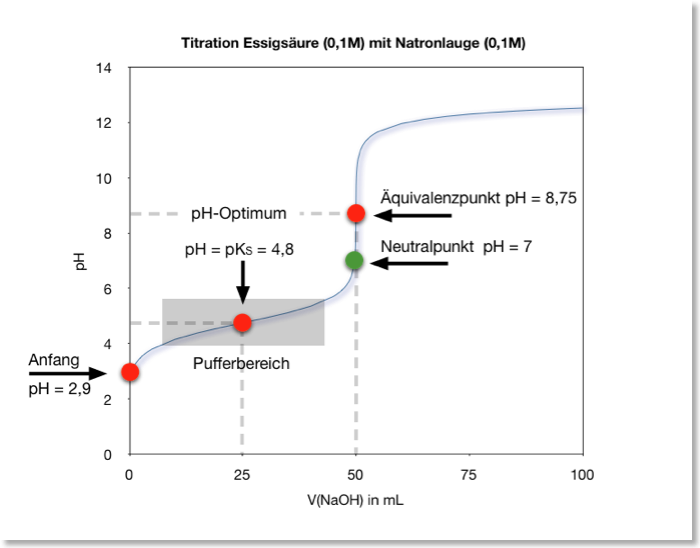
Dies ist der wichtigste Abschnitt der Titrationskurve. Während der Zugabe der starken Base reagiert diese mit der schwachen Säure. Es entsteht das korrespondierende Salz der schwachen Säure (ihre konjugierte Base) und Wasser. In diesem Bereich entsteht eine Pufferlösung, die aus der schwachen Säure und ihrer konjugierten Base besteht. Ein Puffer ist eine Lösung, die sich pH-Wert-Änderungen bei Zugabe von Säuren oder Basen widersetzt.
Der pH-Wert in diesem Bereich ändert sich nur langsam, weil die zugegebene Base bevorzugt mit der schwachen Säure reagiert, anstatt den pH-Wert direkt zu beeinflussen. Die Pufferwirkung ist am stärksten, wenn die Konzentration der schwachen Säure und ihrer konjugierten Base gleich sind. Dieser Punkt wird als Halbäquivalenzpunkt bezeichnet. Am Halbäquivalenzpunkt gilt:
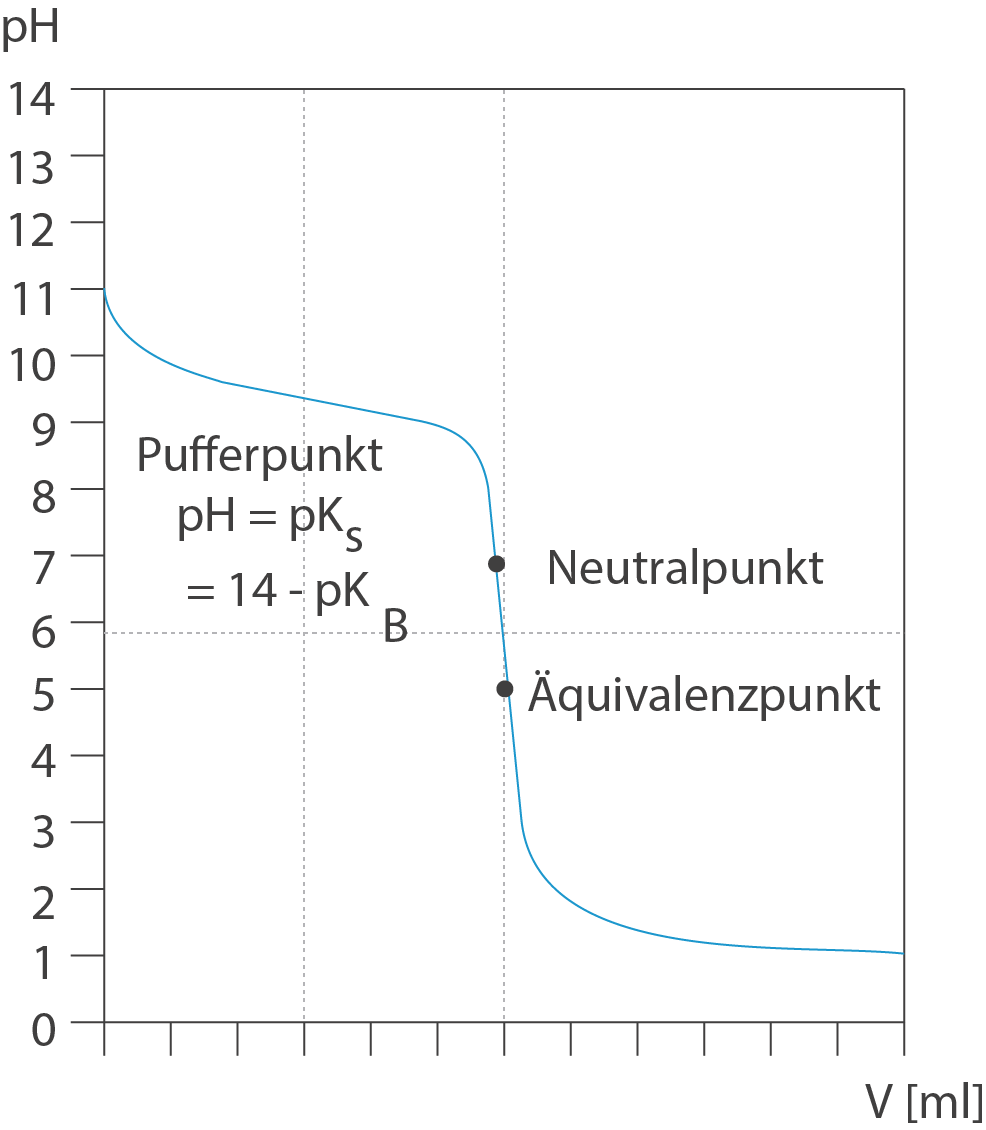
pH = pKa
Der pKa-Wert ist der negative dekadische Logarithmus des Ka-Wertes (pKa = -log(Ka)). Der pKa-Wert ist ein Maß für die Säurestärke. Je kleiner der pKa-Wert, desto stärker die Säure. Der Halbäquivalenzpunkt ist also eine sehr nützliche Information, um den pKa-Wert der schwachen Säure direkt aus der Titrationskurve abzulesen.
Die Henderson-Hasselbalch-Gleichung beschreibt den pH-Wert in einem Pufferbereich genauer:
pH = pKa + log([A-]/[HA])
wobei [A-] die Konzentration der konjugierten Base und [HA] die Konzentration der schwachen Säure ist. Diese Gleichung zeigt, dass der pH-Wert hauptsächlich vom Verhältnis der Konzentrationen von Base und Säure abhängt.
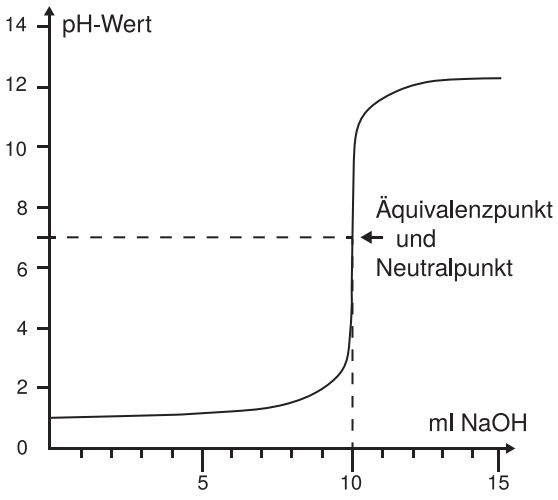
3. Der Äquivalenzpunkt
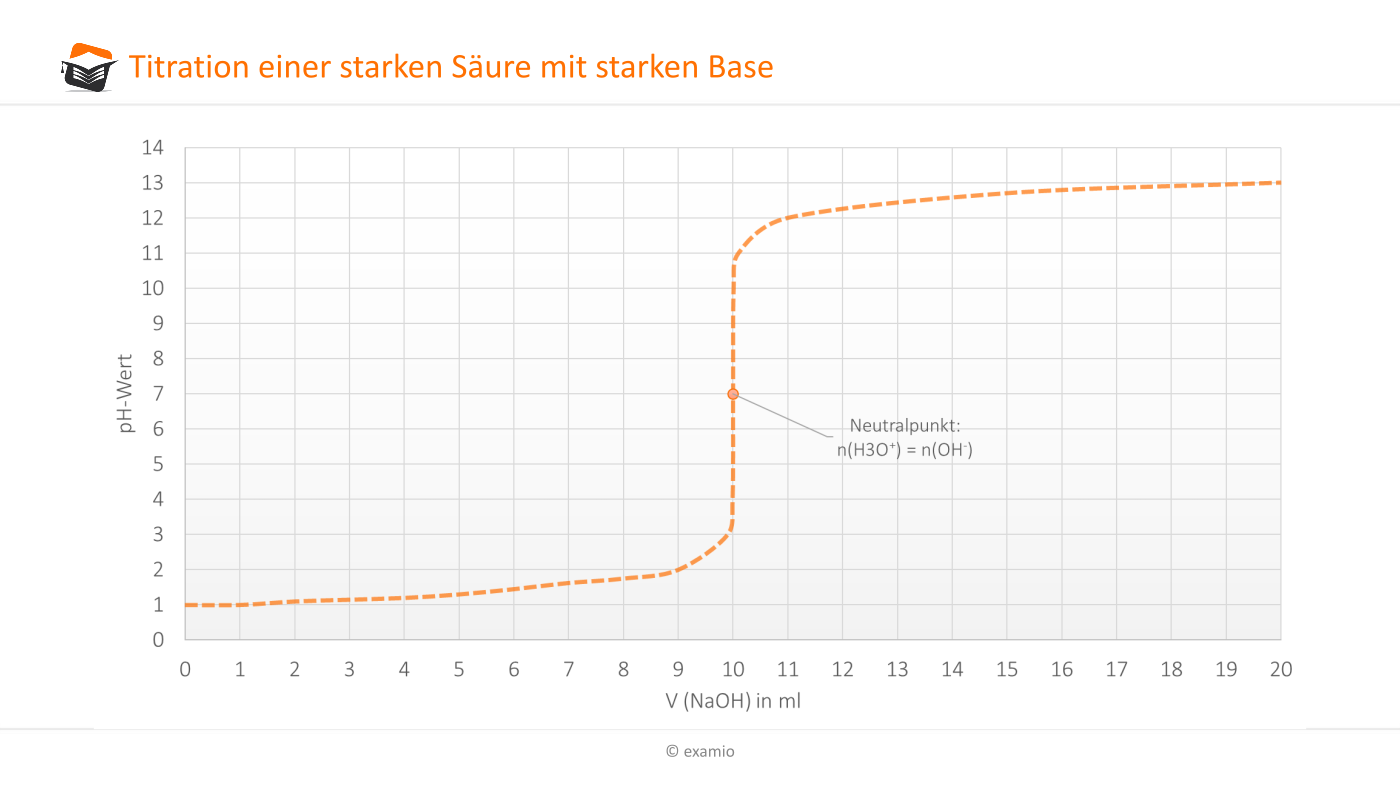
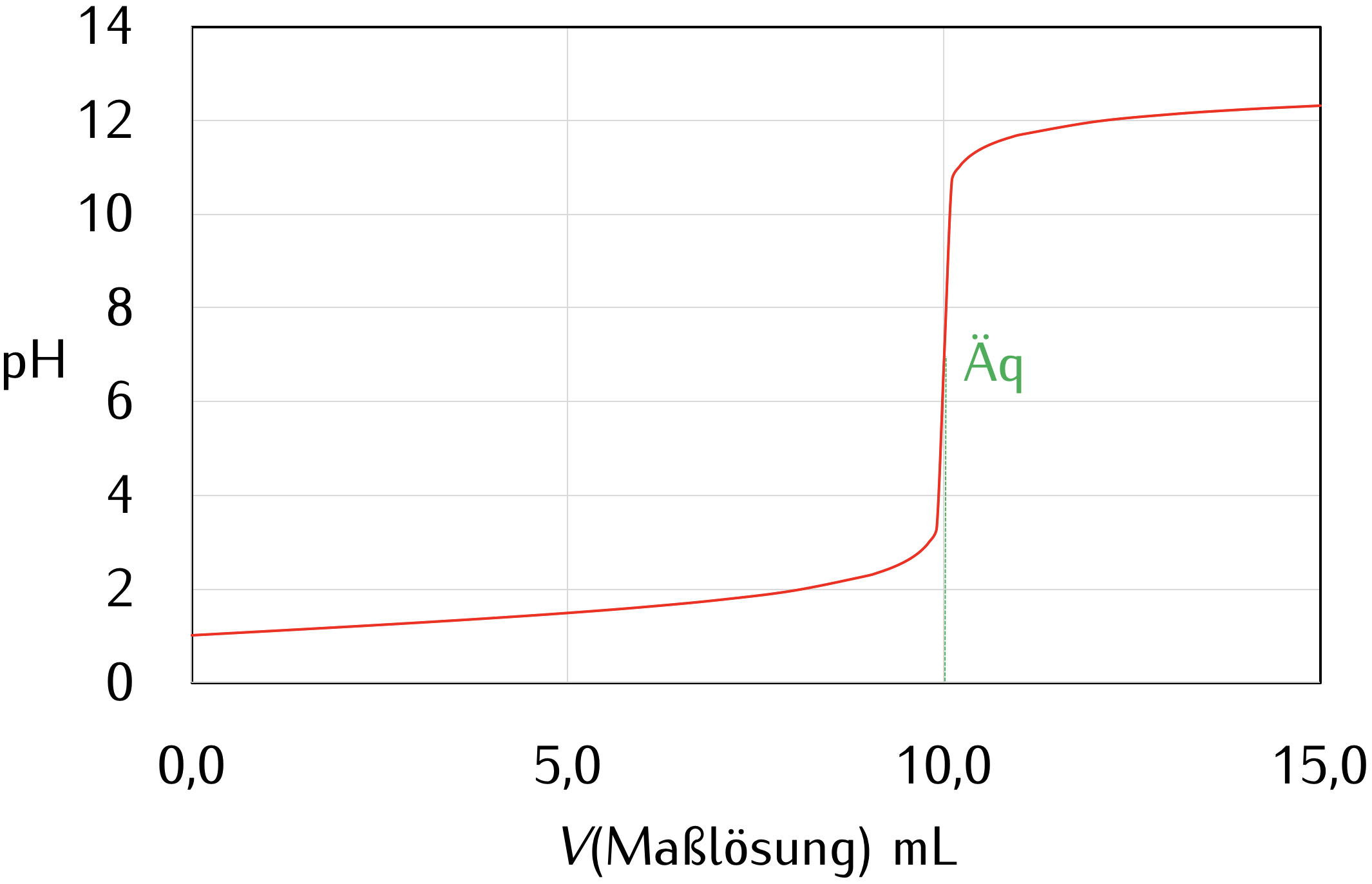
Der Äquivalenzpunkt ist der Punkt, an dem die Stoffmenge der zugegebenen Base genau der Stoffmenge der ursprünglich vorhandenen schwachen Säure entspricht. Es ist wichtig zu beachten, dass der pH-Wert am Äquivalenzpunkt nicht 7,0 ist, wie es bei der Titration einer starken Säure mit einer starken Base der Fall wäre. Stattdessen liegt der pH-Wert am Äquivalenzpunkt über 7,0. Das liegt daran, dass die konjugierte Base der schwachen Säure in Wasser hydrolysiert und Hydroxidionen (OH-) bildet, was den pH-Wert erhöht.
Die genaue pH-Wert am Äquivalenzpunkt hängt von der Konzentration der konjugierten Base und ihrer Basenstärke (Kb) ab. Die Berechnung des pH-Wertes am Äquivalenzpunkt ist komplexer und erfordert die Berücksichtigung des Hydrolysegleichgewichts der konjugierten Base.
Nach dem Äquivalenzpunkt wird die Titrationskurve steiler, da die Zugabe von weiterem OH- den pH-Wert schnell erhöht. Der pH-Wert nähert sich schließlich dem pH-Wert der starken Base.
Die Titrationskurve graphisch
Eine typische Titrationskurve für eine schwache Säure mit einer starken Base hat folgende Form:
- Sie beginnt mit einem relativ höheren pH-Wert im Vergleich zu einer starken Säure.
- Es folgt ein flacher Bereich, der den Pufferbereich darstellt.
- Der pH-Wert ändert sich langsam im Pufferbereich.
- In der Mitte des Pufferbereichs liegt der Halbäquivalenzpunkt (pH = pKa).
- Am Äquivalenzpunkt steigt der pH-Wert steil an, jedoch nicht so steil wie bei einer starken Säure.
- Der pH-Wert am Äquivalenzpunkt liegt über 7.
- Nach dem Äquivalenzpunkt steigt der pH-Wert allmählich an und nähert sich dem pH-Wert der starken Base.
Anwendungen und Bedeutung
Titrationskurven für schwache Säuren mit starken Basen sind aus verschiedenen Gründen wichtig:
- Bestimmung des pKa-Wertes: Wie bereits erwähnt, kann der pKa-Wert einer schwachen Säure einfach durch Ablesen des pH-Wertes am Halbäquivalenzpunkt bestimmt werden. Dies ist eine sehr nützliche Methode zur Charakterisierung von Säuren.
- Auswahl geeigneter Indikatoren: Indikatoren sind Substanzen, die ihre Farbe in Abhängigkeit vom pH-Wert ändern. Für eine Titration muss ein Indikator ausgewählt werden, dessen Farbumschlag im Bereich des steilen pH-Wert-Anstiegs um den Äquivalenzpunkt liegt. Das Verständnis der Titrationskurve hilft bei der Auswahl des am besten geeigneten Indikators.
- Quantitative Analyse: Titrationen werden verwendet, um die Konzentration einer unbekannten Säurelösung zu bestimmen. Die Kenntnis der Reaktionsstöchiometrie und die genaue Messung des Volumens der zugegebenen Base ermöglichen die Berechnung der Konzentration der Säure.
- Pufferherstellung: Die Henderson-Hasselbalch-Gleichung und die Kenntnis des pKa-Wertes ermöglichen die gezielte Herstellung von Pufferlösungen mit einem bestimmten pH-Wert.
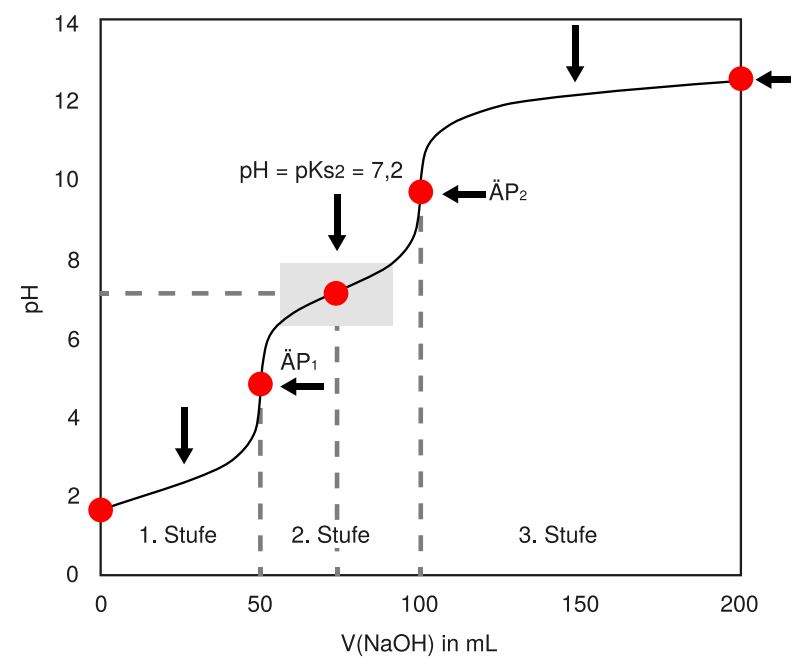
- Verständnis biologischer Systeme: Viele biologische Systeme sind durch Pufferwirkung gekennzeichnet. Das Verständnis der Titrationskurven und Puffer ist essenziell, um die komplexen chemischen Prozesse in lebenden Organismen zu verstehen.
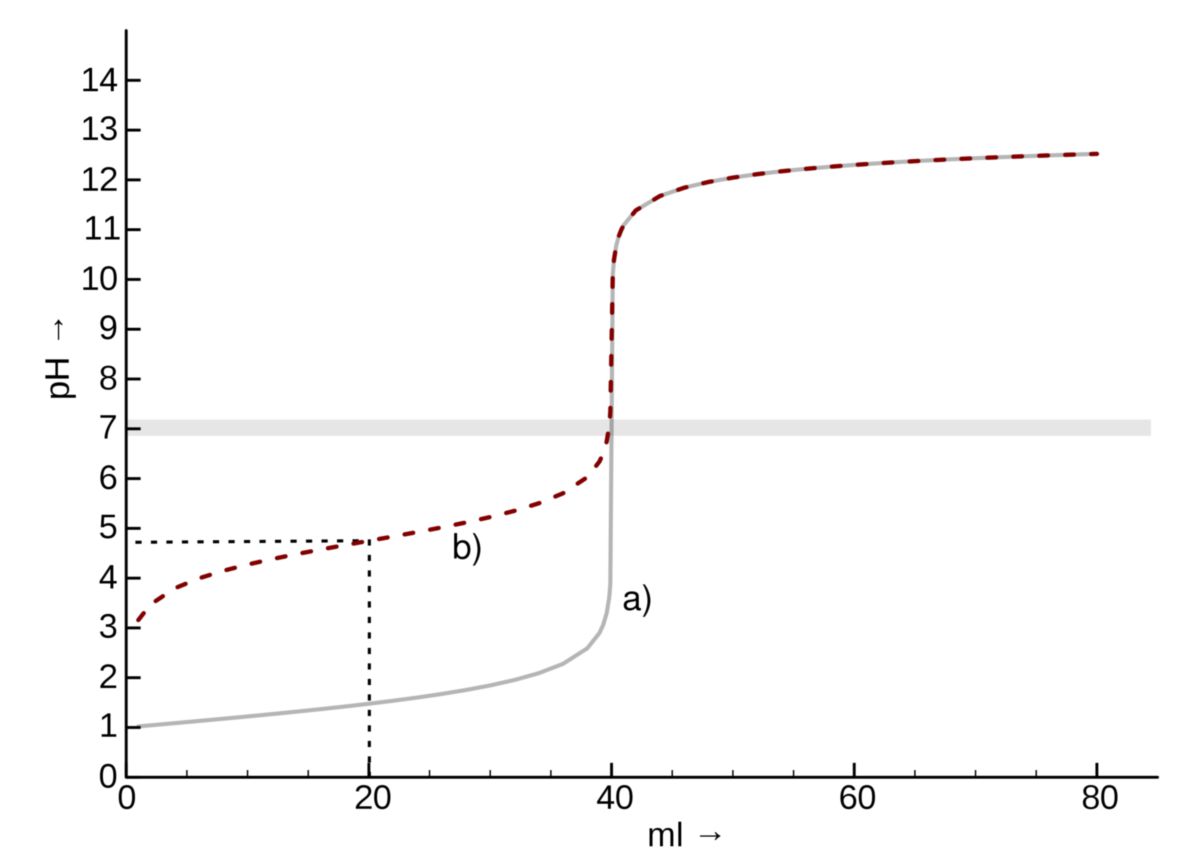
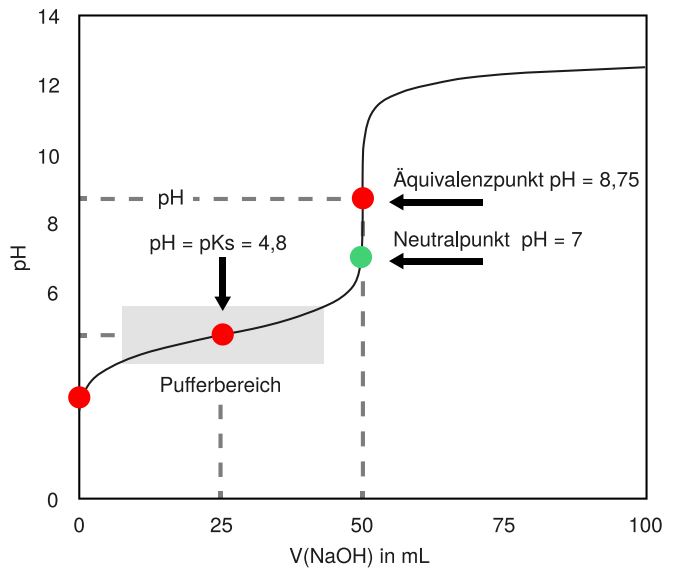
Beispiel: Titration von Essigsäure mit Natriumhydroxid
Nehmen wir an, wir titrieren 25 ml einer 0,1 M Essigsäurelösung (CH3COOH) mit einer 0,1 M Natriumhydroxidlösung (NaOH). Der Ka-Wert der Essigsäure beträgt etwa 1,8 x 10-5 (pKa ≈ 4,74).
- Anfangs-pH-Wert: Der anfängliche pH-Wert der Essigsäurelösung kann mit der oben genannten Formel berechnet werden: pH = -log(√(1,8 x 10-5 * 0,1)) ≈ 2,87.
- Pufferbereich: Während der Zugabe von NaOH reagiert diese mit der Essigsäure und bildet Acetat (CH3COO-). Im Pufferbereich ändert sich der pH-Wert nur langsam.
- Halbäquivalenzpunkt: Am Halbäquivalenzpunkt (wenn die Hälfte der Essigsäure neutralisiert wurde) gilt pH = pKa = 4,74.
- Äquivalenzpunkt: Der Äquivalenzpunkt wird erreicht, wenn 25 ml NaOH hinzugefügt wurden (da die Konzentrationen gleich sind). Der pH-Wert am Äquivalenzpunkt liegt über 7,0. Die genaue Berechnung erfordert die Berücksichtigung der Hydrolyse von Acetat. Der pH-Wert beträgt etwa 8,72.
- Nach dem Äquivalenzpunkt: Nach dem Äquivalenzpunkt steigt der pH-Wert schnell an, da die Zugabe von überschüssigem NaOH den pH-Wert direkt bestimmt.
Diese Titrationskurve würde einen flachen Pufferbereich um pH 4,74 und einen steilen Anstieg um pH 8,72 zeigen. Ein Indikator wie Phenolphthalein, der bei pH 8,3-10,0 umschlägt, wäre für diese Titration geeignet.
Fazit
Das Verständnis der Titrationskurve für eine schwache Säure mit einer starken Base ist essentiell für die korrekte Durchführung und Interpretation von Titrationen. Die Kenntnis der charakteristischen Abschnitte der Kurve, insbesondere des Pufferbereichs und des Äquivalenzpunktes, ermöglicht die Bestimmung des pKa-Wertes, die Auswahl geeigneter Indikatoren und die Durchführung quantitativer Analysen. Die Anwendung der Henderson-Hasselbalch-Gleichung ist hier von zentraler Bedeutung. Die Fähigkeit, eine solche Titrationskurve zu analysieren, ist eine wichtige Grundlage für viele Bereiche der Chemie, Biochemie und Pharmazie.
![Titrationskurve Schwache Säure Starke Base Säure Base Titration • Aufbau, Titrationskurven, Berechnung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/04/02_Titrationskurve-starke-Säure-mit-starker-Base-2-1024x576.jpg)

![Titrationskurve Schwache Säure Starke Base Säure Base Titration • Aufbau, Titrationskurven, Berechnung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/04/04_Titrationskurve-mehrprotoniger-Säuren-1-1024x576.jpg)