Van Der Waals Kräfte Beispiel
Die Welt um uns herum, in ihrer scheinbaren Festigkeit und Beständigkeit, ist ein faszinierendes Zusammenspiel atomarer und molekularer Kräfte. Während starke Bindungen wie kovalente oder ionische Bindungen die Bausteine der Materie fest zusammenhalten, sind es die subtileren, aber allgegenwärtigen Van-der-Waals-Kräfte, die die Feinheiten der Wechselwirkungen zwischen Molekülen bestimmen. Ein besonderes Augenmerk verdient dabei die Art und Weise, wie diese Kräfte in Ausstellungen und Bildungsangeboten vermittelt werden können, um das Verständnis für ihre Bedeutung zu fördern.
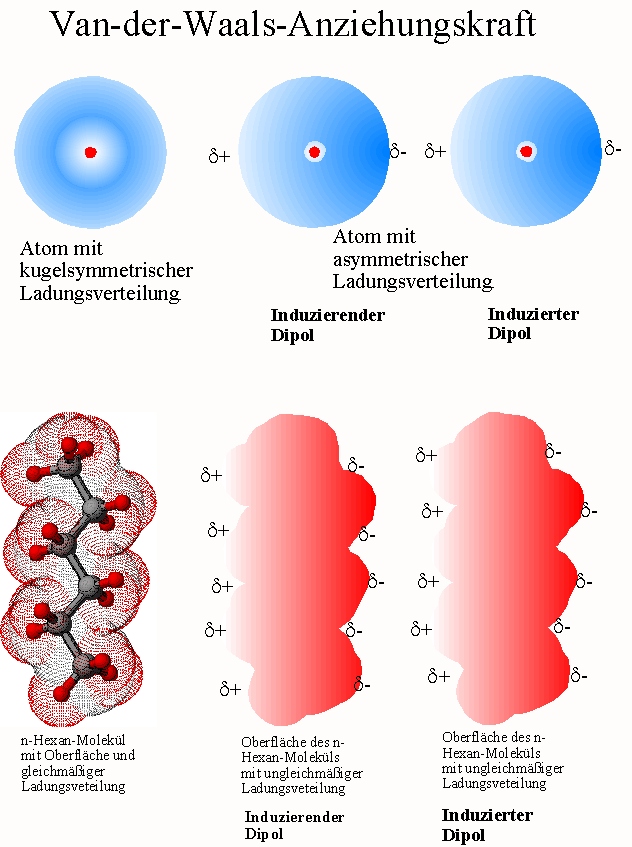
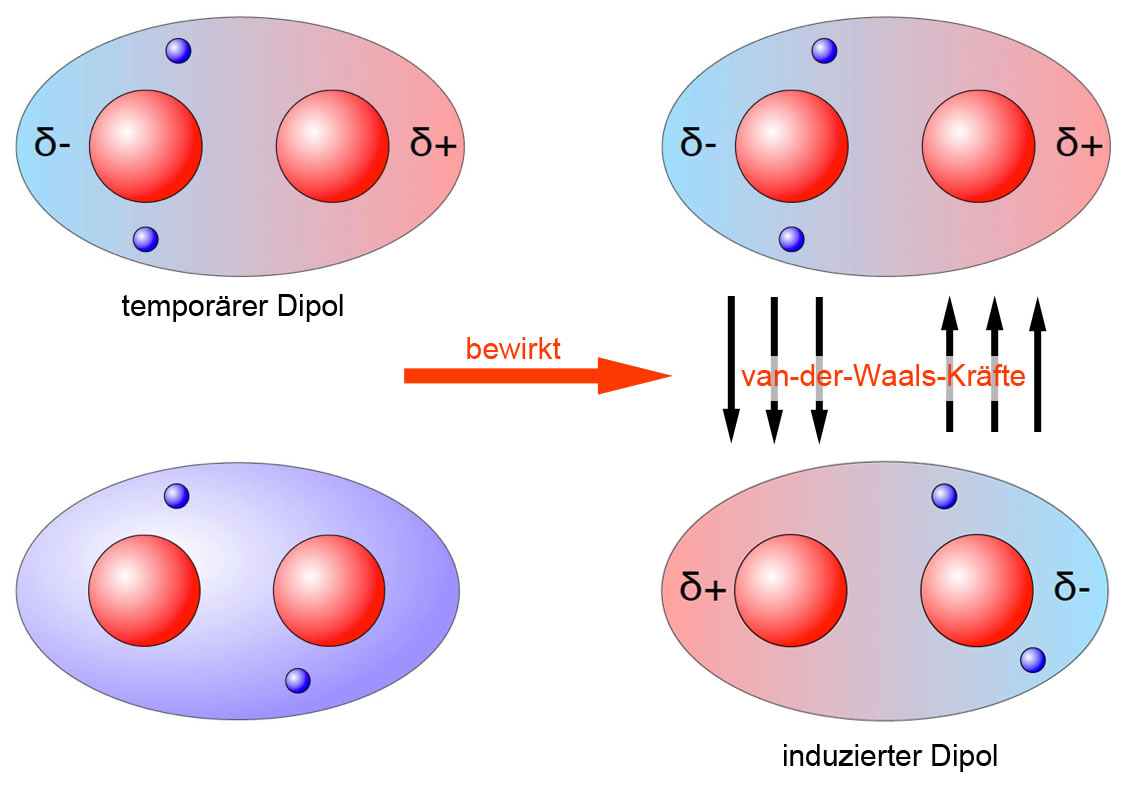
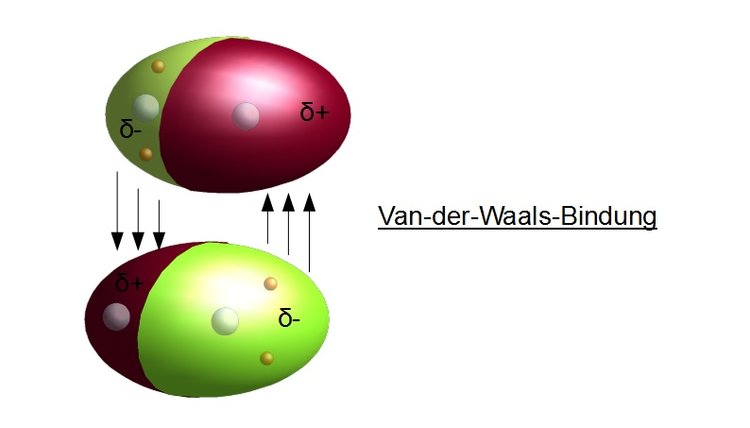
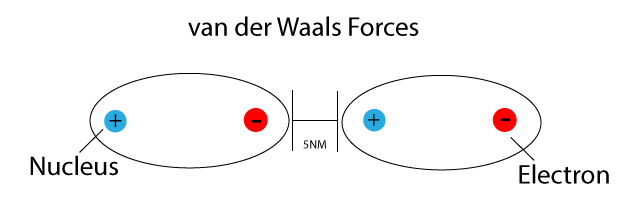
Die Natur der Van-der-Waals-Kräfte
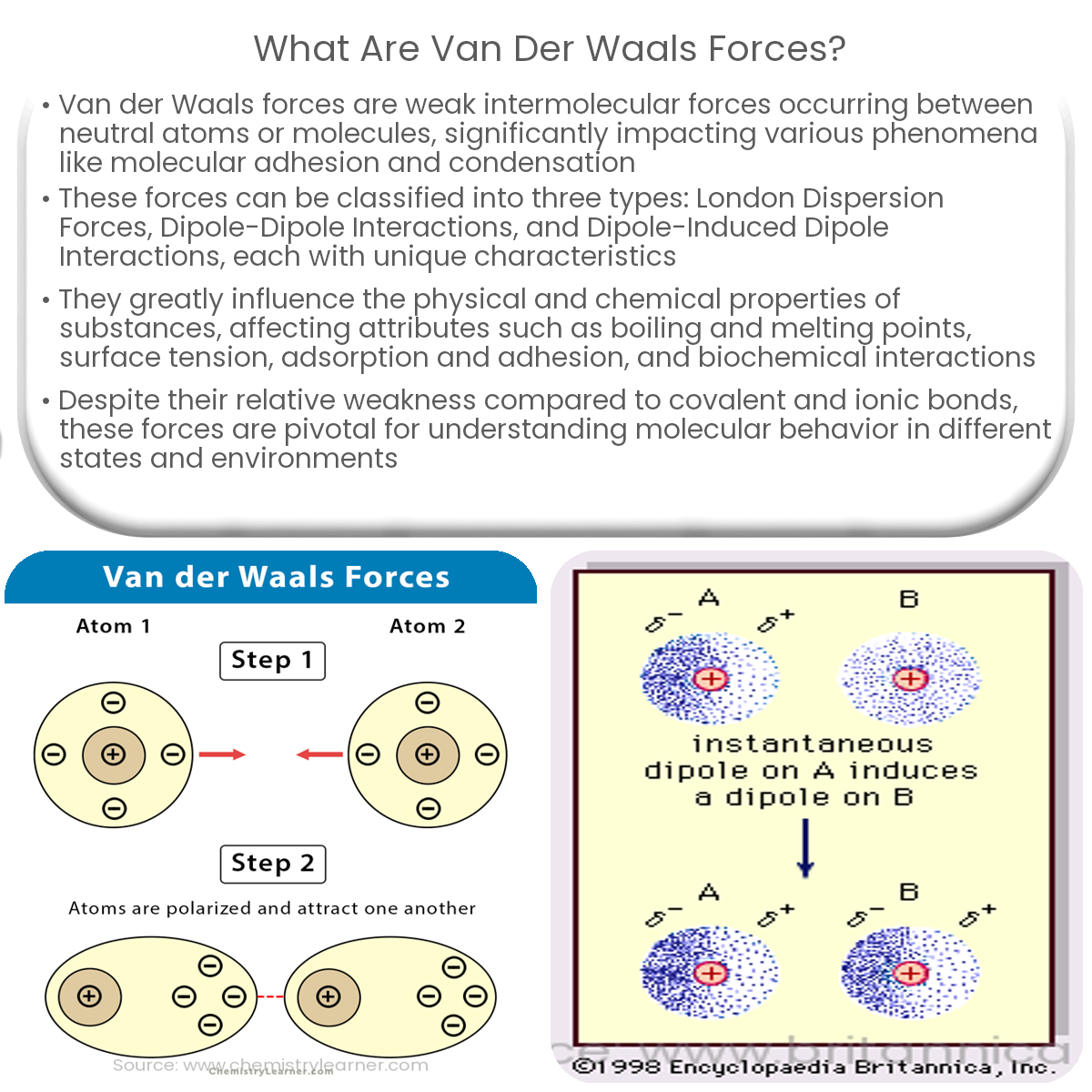
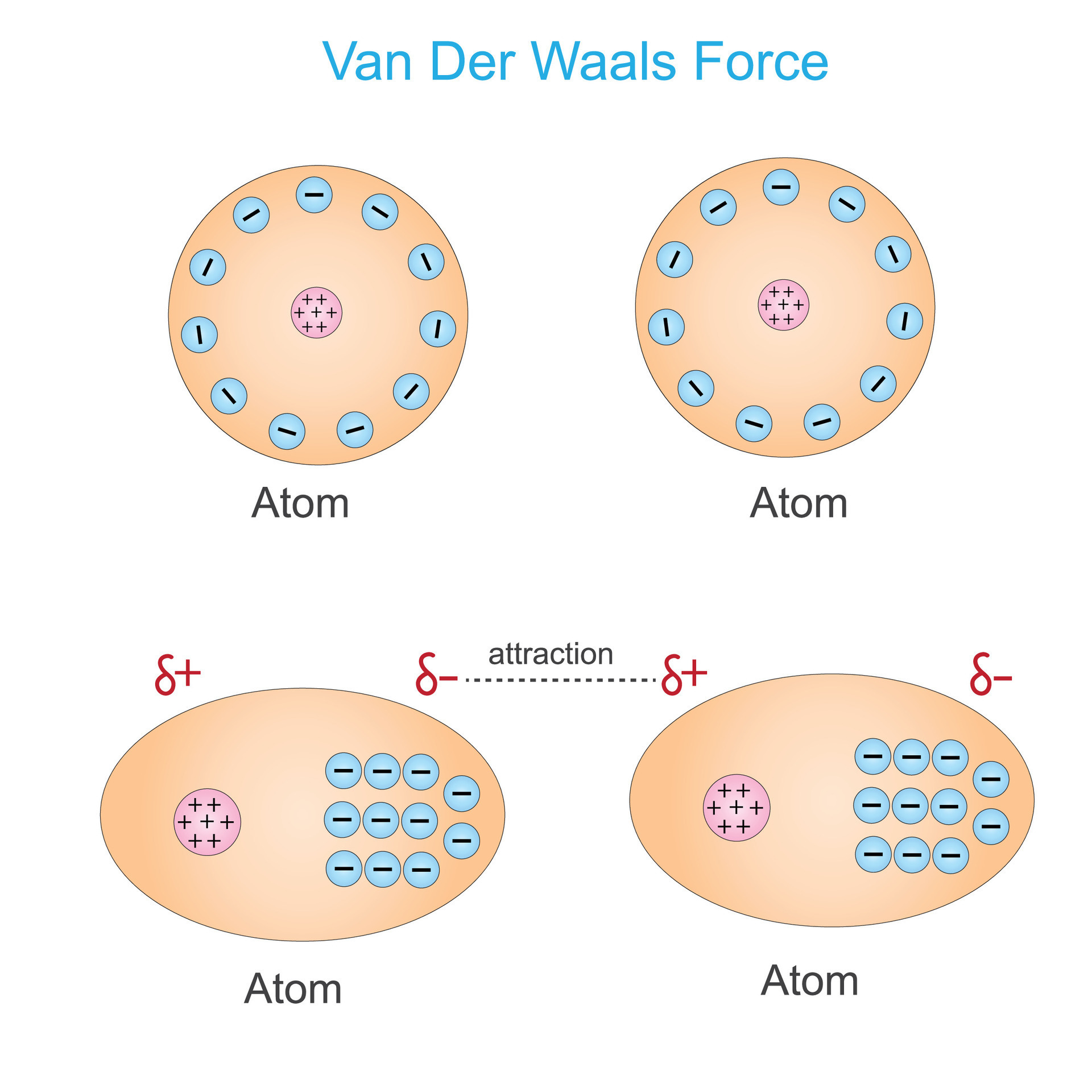
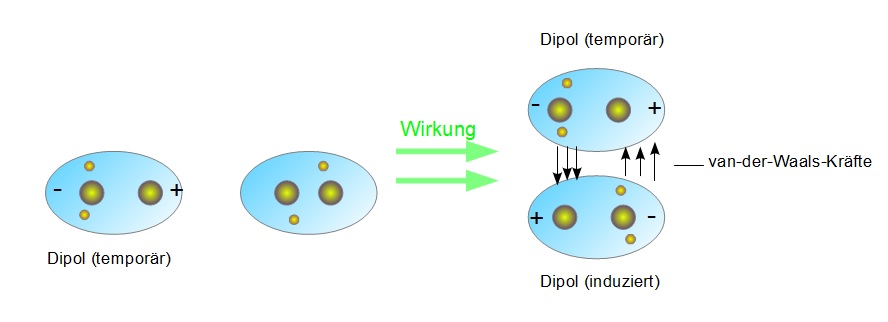
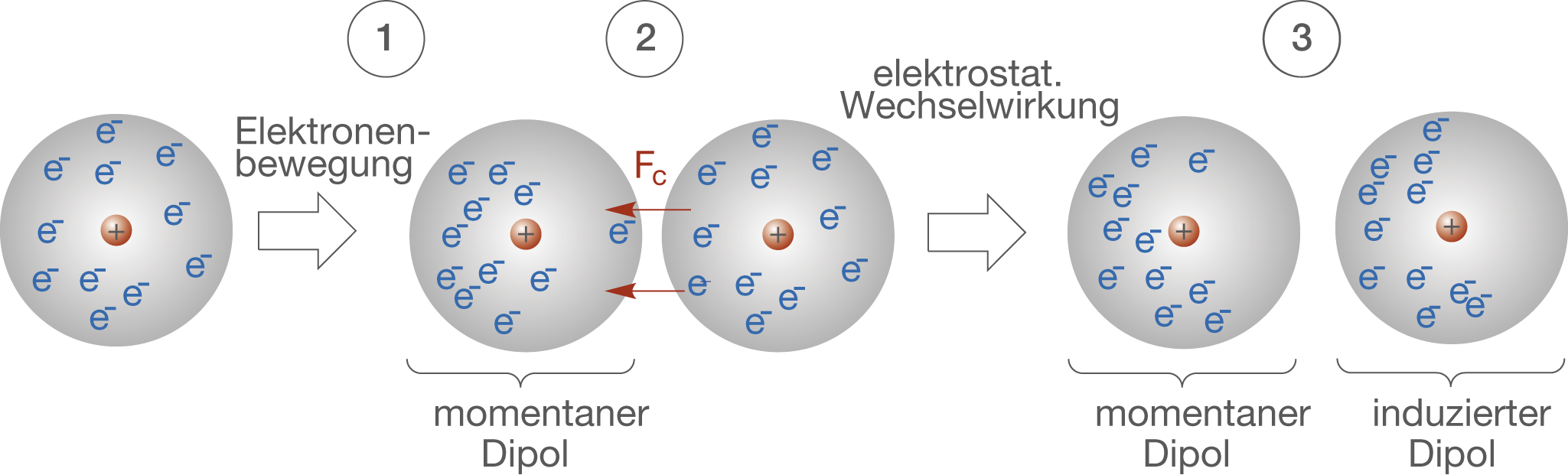
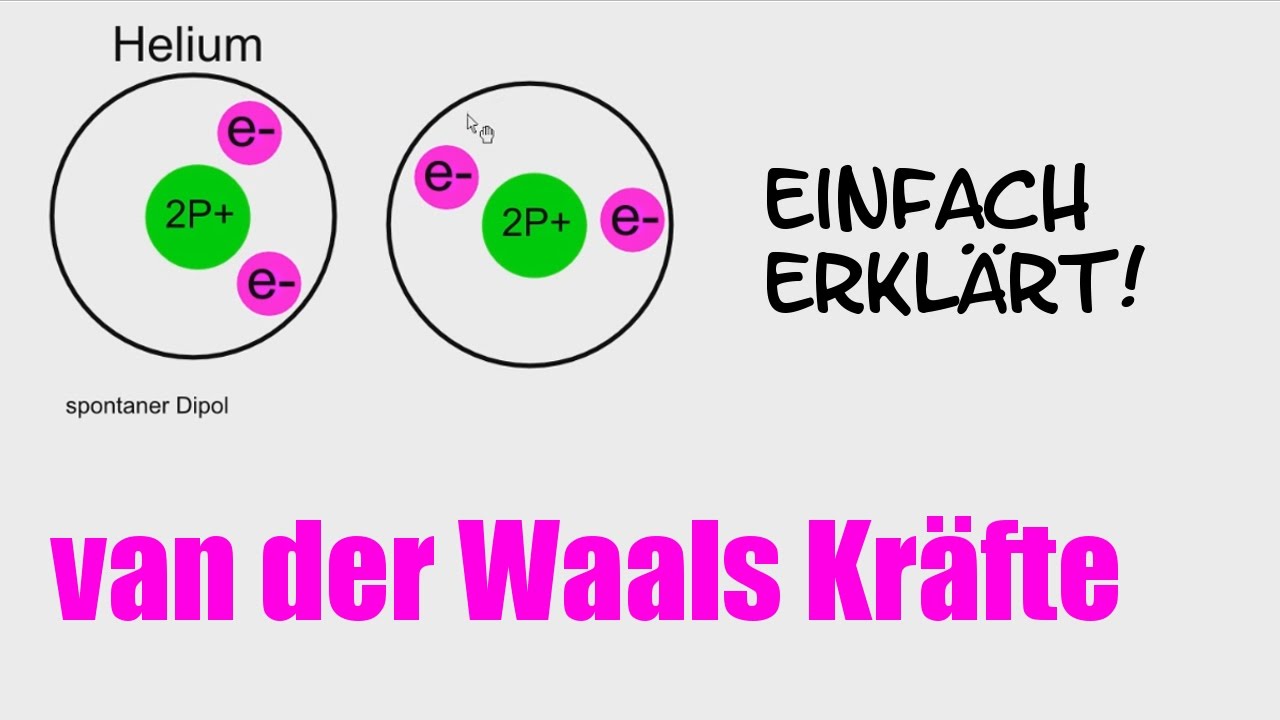
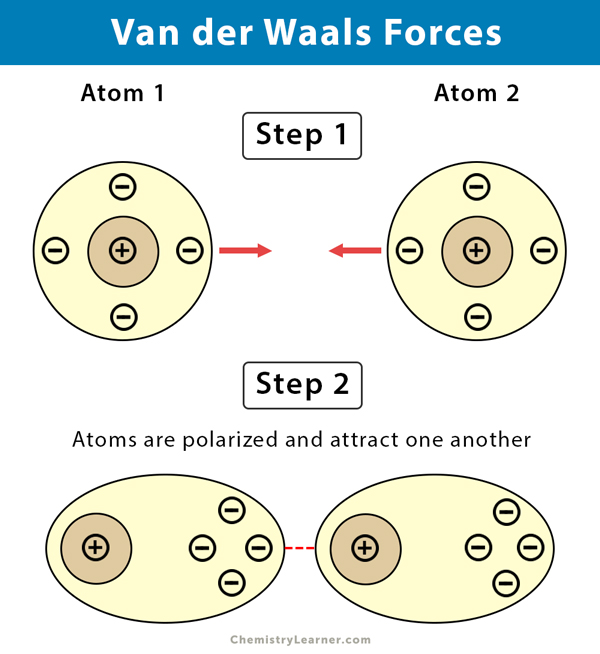
Bevor wir uns den Beispielen und ihrer didaktischen Aufbereitung zuwenden, ist ein kurzes Verständnis der Van-der-Waals-Kräfte essenziell. Im Wesentlichen handelt es sich um schwache, nicht-kovalente Anziehungskräfte zwischen Atomen oder Molekülen. Diese Kräfte entstehen durch temporäre, fluktuierende Ladungsungleichgewichte, die zu induzierten Dipolen führen. Es gibt drei Haupttypen von Van-der-Waals-Kräften:
- Keesom-Kräfte (Dipol-Dipol-Kräfte): Treten zwischen Molekülen mit permanenten Dipolmomenten auf.
- Debye-Kräfte (Dipol-induzierte-Dipol-Kräfte): Ein permanenter Dipol in einem Molekül induziert einen Dipol in einem benachbarten, nicht-polaren Molekül.
- London-Dispersionskräfte (induzierte-Dipol-induzierte-Dipol-Kräfte): Diese Kräfte sind allgegenwärtig und entstehen durch spontane, kurzlebige Fluktuationen der Elektronendichte in Atomen und Molekülen, die vorübergehende Dipole erzeugen.
Während die Keesom- und Debye-Kräfte von der Existenz permanenter Dipole abhängen, sind die London-Dispersionskräfte immer vorhanden, da sie auf den fluktuierenden Elektronendichten in allen Atomen und Molekülen basieren. Sie sind oft die dominierenden Van-der-Waals-Kräfte, besonders in unpolaren Substanzen.
Van-der-Waals-Kräfte im Alltag: Beispiele und didaktische Aufbereitung
Die folgenden Beispiele illustrieren die Manifestation von Van-der-Waals-Kräften im Alltag und bieten Anregungen für ihre Vermittlung in Ausstellungen:
1. Der Gecko-Effekt: Adhäsion an glatten Oberflächen
Geckos sind berühmt für ihre Fähigkeit, sich mühelos an glatten Oberflächen zu bewegen, selbst kopfüber. Dieses Phänomen ist auf die Millionen feinen Härchen (Setae) an ihren Füßen zurückzuführen. Jede Seta verzweigt sich in noch feinere Strukturen (Spatulae). Die enorme Oberfläche, die dadurch entsteht, ermöglicht eine große Anzahl von Kontakten mit der Oberfläche. Zwischen den Spatulae und der Oberfläche wirken London-Dispersionskräfte. Die Summe dieser winzigen Kräfte ist ausreichend, um das Gewicht des Geckos zu tragen.
Ausstellungsidee: Eine interaktive Station, in der Besucher die Oberfläche eines Gecko-Fußes unter dem Mikroskop betrachten können (reale oder modellhafte Darstellung). Eine weitere Station könnte die Berechnung der benötigten Kraft pro Spatula ermöglichen, um das Gewicht eines Miniatur-Geckos zu halten. Virtuelle Realität könnte genutzt werden, um die Erfahrung zu simulieren, ein Gecko zu sein und die Welt aus dieser Perspektive zu erleben.
Die didaktische Aufbereitung sollte betonen, dass es sich nicht um Klebstoff oder statische Elektrizität handelt, sondern um die kumulative Wirkung vieler schwacher Kräfte. Die Analogie zu vielen kleinen Fäden, die gemeinsam eine schwere Last tragen, kann hilfreich sein.
2. Der Siedepunkt von Alkanen: Kettenlänge und intermolekulare Kräfte
Alkane sind organische Verbindungen, die ausschließlich aus Kohlenstoff- und Wasserstoffatomen bestehen. Mit zunehmender Kettenlänge (Anzahl der Kohlenstoffatome) steigt der Siedepunkt der Alkane. Dies ist primär auf die Zunahme der London-Dispersionskräfte zurückzuführen. Längere Ketten haben eine größere Oberfläche und somit mehr Möglichkeiten für intermolekulare Wechselwirkungen.
Ausstellungsidee: Eine interaktive Grafik, die den Siedepunkt verschiedener Alkane in Abhängigkeit von ihrer Kettenlänge darstellt. Besucher können verschiedene Alkane auswählen und ihre Molekülstruktur in 3D visualisieren. Ein begleitender Text erklärt den Zusammenhang zwischen Kettenlänge, Oberfläche und Stärke der London-Dispersionskräfte. Eine Analogie könnte das Stapeln von Bauklötzen unterschiedlicher Größe sein – je größer die Kontaktfläche, desto stabiler der Stapel.
Die Herausforderung besteht darin, die abstrakte Natur der intermolekularen Kräfte zu veranschaulichen. Die Verwendung von Modellen und Visualisierungen ist hier entscheidend. Eine Animation, die die fluktuierenden Elektronendichten in den Molekülen darstellt, kann das Verständnis erleichtern.
3. Die Struktur von DNA: Wasserstoffbrücken und Van-der-Waals-Kräfte
Die Doppelhelix-Struktur der DNA wird nicht nur durch kovalente Bindungen innerhalb der Nukleotide, sondern auch durch Wasserstoffbrücken zwischen den Basenpaaren (Adenin-Thymin und Guanin-Cytosin) und durch Van-der-Waals-Kräfte stabilisiert. Die gestapelten Basenpaare interagieren miteinander über London-Dispersionskräfte, was zur Stabilität der DNA-Struktur beiträgt.
Ausstellungsidee: Ein großes, begehbares DNA-Modell, das die Wasserstoffbrücken und die gestapelten Basenpaare hervorhebt. Interaktive Touchscreens könnten detaillierte Informationen über die verschiedenen Kräfte liefern, die die DNA-Struktur stabilisieren. Besucher könnten versuchen, die DNA-Stränge auseinanderzunehmen, um die relative Stärke der verschiedenen Bindungen zu spüren (durch unterschiedlichen Widerstand). Eine Simulation der DNA-Replikation könnte zeigen, wie Enzyme die Wasserstoffbrücken aufbrechen und die DNA duplizieren.
Die Betonung sollte auf der Synergie der verschiedenen Kräfte liegen, die zusammen die komplexe Struktur der DNA stabilisieren. Der Unterschied zwischen den relativ starken Wasserstoffbrücken und den schwächeren Van-der-Waals-Kräften sollte klar herausgestellt werden.
4. Kondensation von Gasen: Übergang vom Gas- zum Flüssigkeitszustand
Gase bestehen aus Molekülen, die sich frei bewegen und wenig miteinander interagieren. Wenn ein Gas abgekühlt wird, verringert sich die kinetische Energie der Moleküle. Bei einer bestimmten Temperatur werden die Van-der-Waals-Kräfte stark genug, um die Moleküle zusammenzuhalten, was zur Kondensation und zur Bildung einer Flüssigkeit führt.
Ausstellungsidee: Eine Vorführung, in der flüssiger Stickstoff verdampft und sich wieder verflüssigt. Sensoren messen die Temperatur und den Druck während des Phasenübergangs. Eine Animation zeigt die Bewegung der Moleküle im Gas- und Flüssigkeitszustand und veranschaulicht, wie die Van-der-Waals-Kräfte bei niedrigeren Temperaturen dominieren. Besucher können an einem interaktiven Spiel teilnehmen, bei dem sie durch Abkühlen oder Erwärmen eines Gases versuchen, es zu verflüssigen oder zu verdampfen.
Die Darstellung sollte die dynamische Natur der intermolekularen Kräfte und ihre Abhängigkeit von der Temperatur verdeutlichen. Die Analogie zu einem Tanzsaal, in dem sich die Tänzer (Moleküle) bei hoher Temperatur wild bewegen und bei niedriger Temperatur in Paaren zusammenfinden, kann hilfreich sein.
Besucherfahrung und Bildungswert
Die Vermittlung von Van-der-Waals-Kräften in Ausstellungen erfordert einen durchdachten Ansatz, der die abstrakte Natur dieser Kräfte berücksichtigt. Interaktive Elemente, Visualisierungen und praktische Beispiele sind entscheidend, um das Verständnis und die Begeisterung der Besucher zu wecken. Die Ausstellung sollte folgende Aspekte berücksichtigen:
- Kontextualisierung: Die Beispiele sollten in einen relevanten Kontext eingebettet werden, z.B. Alltagsphänomene, technologische Anwendungen oder biologische Prozesse.
- Visualisierung: Die unsichtbaren Kräfte sollten durch Modelle, Animationen und interaktive Grafiken visualisiert werden.
- Interaktivität: Besucher sollten die Möglichkeit haben, selbst zu experimentieren, zu manipulieren und zu entdecken.
- Differenzierung: Die Informationen sollten auf unterschiedlichen Niveaus angeboten werden, um den Bedürfnissen verschiedener Besuchergruppen gerecht zu werden.
Durch die Kombination von wissenschaftlicher Genauigkeit, kreativer Gestaltung und interaktiven Elementen können Ausstellungen einen wertvollen Beitrag zum Verständnis der Van-der-Waals-Kräfte leisten und die Faszination für die Welt der Moleküle und Atome wecken. Die Besucher sollen nicht nur Fakten lernen, sondern auch die Bedeutung dieser Kräfte für die Welt um sie herum erkennen. Das Ziel ist es, eine nachhaltige Begeisterung für die Naturwissenschaften zu entfachen.





![Van Der Waals Kräfte Beispiel Van-der-Waals-Kräfte · Entstehung & Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/08/Van-der-Waals-Kräfte_1-1-1024x576.jpg)