Van Der Waals Kräfte Einfach Erklärt
Hallo liebe Reisefreunde und Abenteurer! Habt ihr euch jemals gefragt, warum ein Gecko an einer glatten Wand spazieren kann, oder warum euer Sandwich-Käse so schön an der Scheibe Brot klebt? Nein, es ist keine Magie, sondern eine faszinierende Kraft, die überall um uns herum wirkt: die Van-der-Waals-Kräfte! Klingt kompliziert? Keine Sorge, ich nehme euch mit auf eine kleine Reise in die Welt der Moleküle, ganz ohne Physikstudium und mit vielen anschaulichen Beispielen, die ihr vielleicht schon im Urlaub erlebt habt. Stellt euch vor, ihr sitzt an einem Strand in Griechenland, die Sonne wärmt eure Haut, und ihr nippt an einem eiskalten Frappé. All das hat indirekt mit diesen Kräften zu tun!
Was sind Van-der-Waals-Kräfte überhaupt?
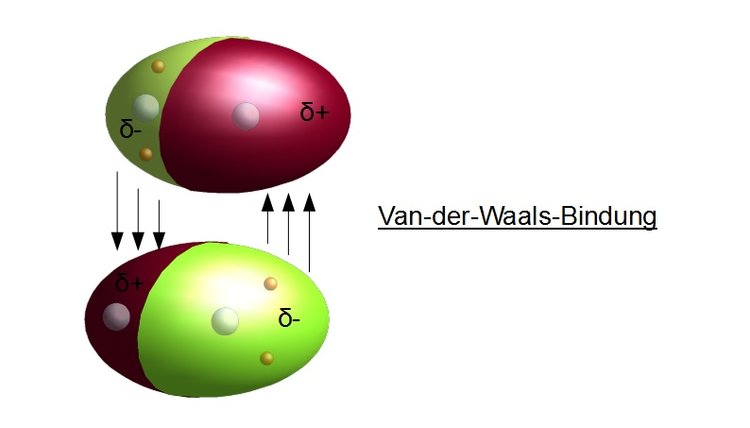
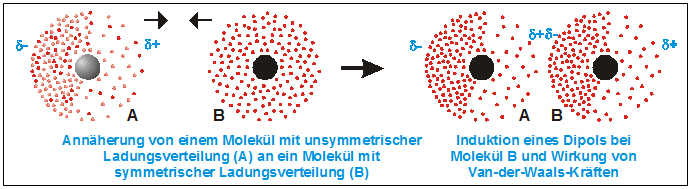
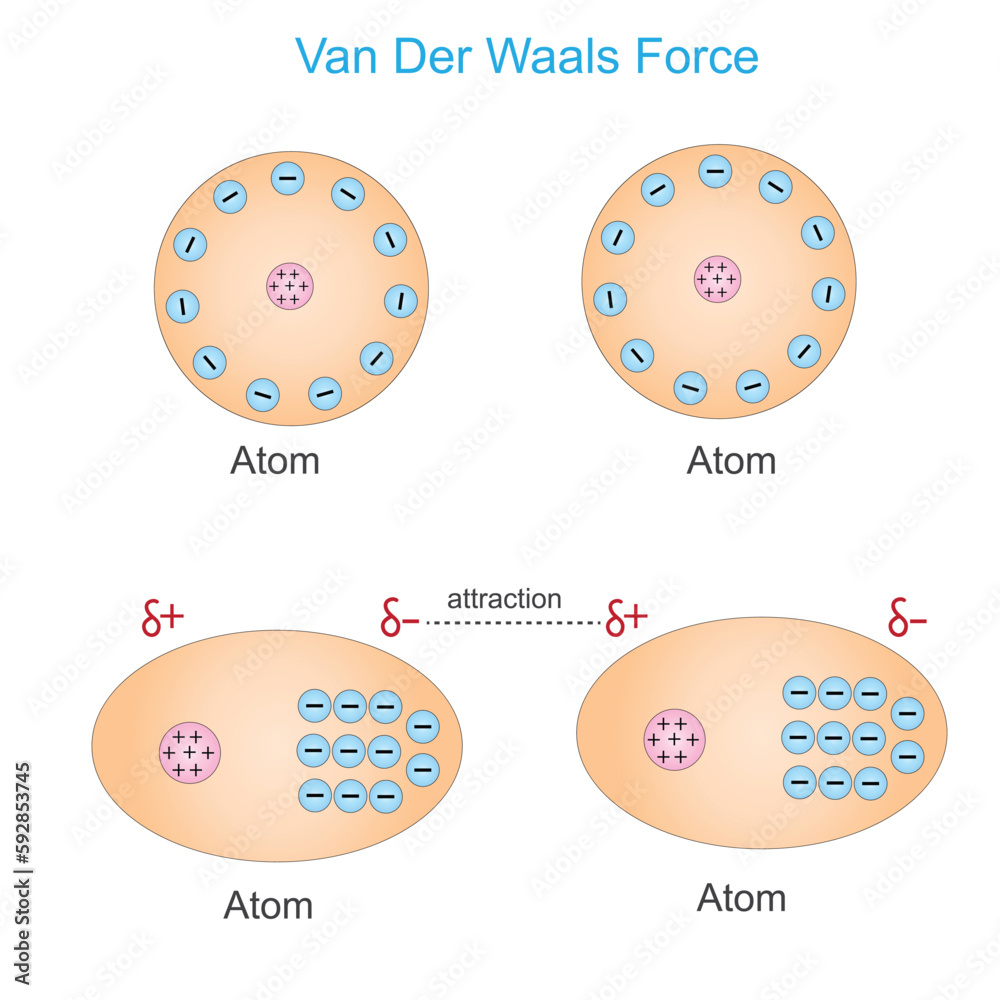
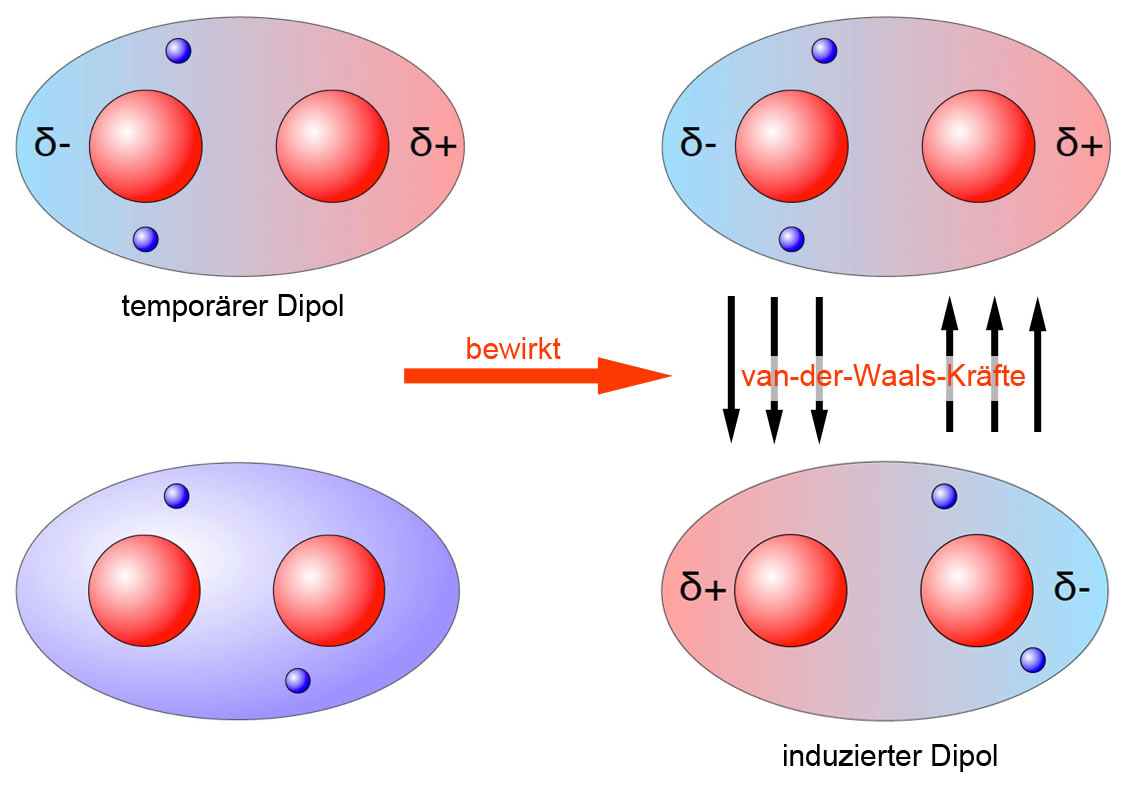
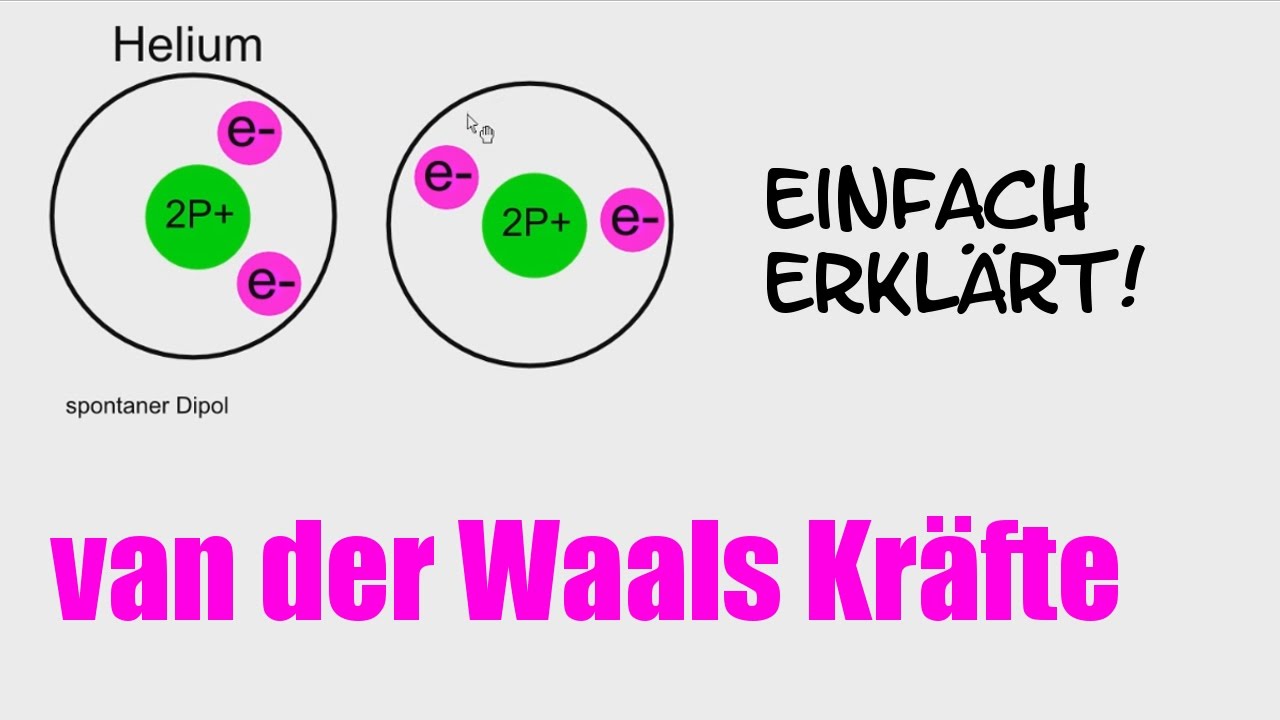
Um es ganz einfach zu sagen: Van-der-Waals-Kräfte sind schwache, anziehende oder abstoßende Kräfte zwischen Atomen und Molekülen. Sie entstehen durch winzige, vorübergehende Ungleichverteilungen von Elektronen innerhalb dieser Teilchen. Stellt euch das so vor: Ein Atom ist wie ein winziges Universum mit einem Kern und Elektronen, die darum herumsausen. Manchmal, ganz kurz, sammeln sich ein paar Elektronen an einer Seite des Atoms. Dadurch entsteht eine leichte negative Ladung auf dieser Seite und eine leichte positive Ladung auf der anderen Seite. Diese vorübergehende Ladungsverschiebung nennt man einen "induzierten Dipol".
Wenn jetzt zwei Atome oder Moleküle nahe genug beieinander sind, kann der Dipol eines Atoms den Dipol des anderen beeinflussen. Die leicht positive Seite des einen Atoms zieht die leicht negative Seite des anderen Atoms an – und voilà, da haben wir unsere Van-der-Waals-Kraft! Es ist wie ein winziger, kurzlebiger Magnet, der ein anderes Teilchen anzieht. Die Kraft ist zwar schwach, aber wenn genügend Atome oder Moleküle beteiligt sind, kann die Wirkung deutlich spürbar sein.
Verschiedene Arten von Van-der-Waals-Kräften
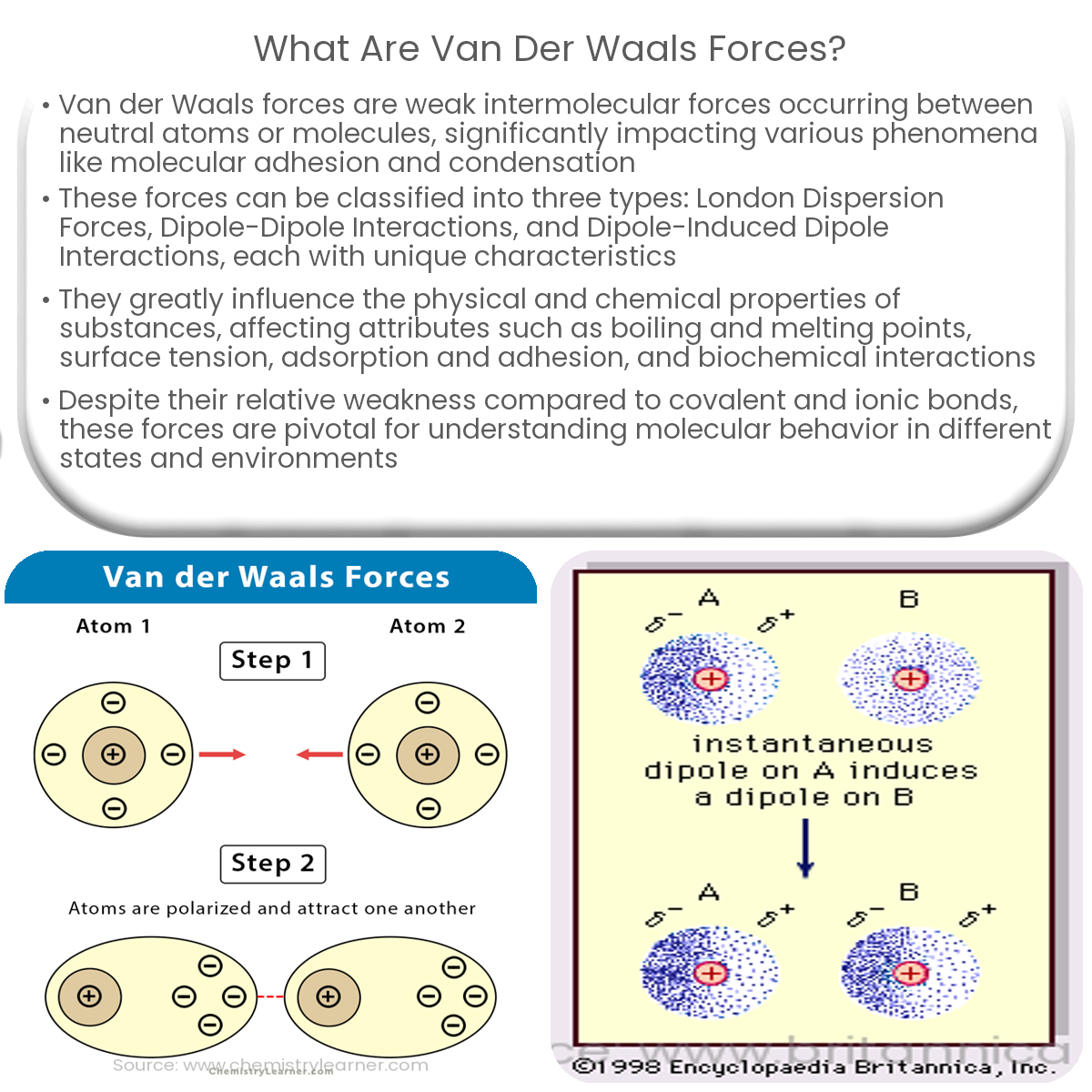
Es gibt verschiedene "Geschmacksrichtungen" von Van-der-Waals-Kräften, abhängig von der Art der Moleküle, die interagieren:
- London-Dispersionskräfte: Das sind die allgemeinsten und immer vorhandenen Kräfte. Sie entstehen durch die beschriebenen vorübergehenden Dipole. Auch unpolare Moleküle, wie Sauerstoff oder Stickstoff in der Luft, ziehen sich durch London-Dispersionskräfte an.
- Debye-Kräfte: Diese Kräfte entstehen zwischen einem Molekül mit einem permanenten Dipol (also einem Molekül, das immer eine ungleichmäßige Ladungsverteilung hat, wie Wasser) und einem Molekül ohne permanenten Dipol. Der permanente Dipol induziert einen Dipol im unpolaren Molekül, wodurch Anziehung entsteht.
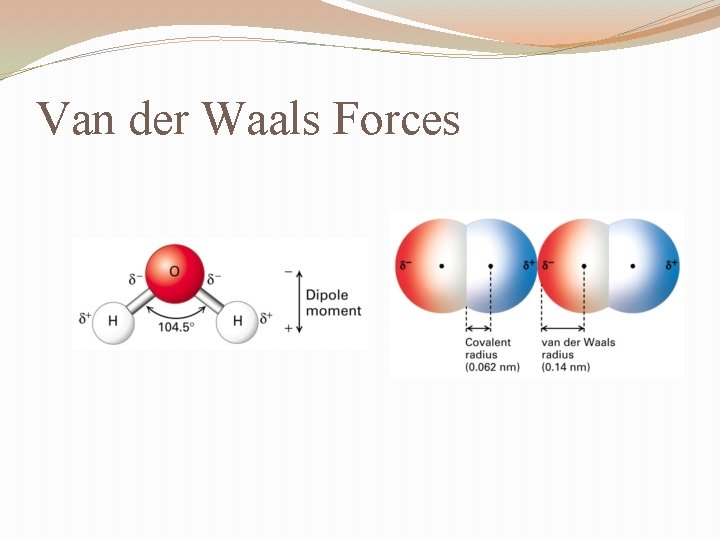
- Keesom-Kräfte: Diese Kräfte wirken zwischen zwei Molekülen mit permanenten Dipolen. Die positiv geladene Seite des einen Moleküls zieht die negativ geladene Seite des anderen Moleküls an.
Die London-Dispersionskräfte sind die wichtigsten, besonders bei unpolaren Substanzen, während die Debye- und Keesom-Kräfte stärker sind, aber nur bei polaren Molekülen auftreten.
Van-der-Waals-Kräfte im Urlaub – Beispiele aus dem echten Leben!
Okay, genug Theorie! Lasst uns schauen, wo ihr diese Kräfte in eurem nächsten Urlaub entdecken könnt:
- Geckos an der Wand: Erinnert ihr euch an den Gecko? Seine Füße sind mit Millionen winziger Härchen bedeckt, sogenannte Setae. Jede Seta teilt sich in noch kleinere Strukturen auf, die Spatulae. Die riesige Anzahl dieser Spatulae sorgt für einen extrem engen Kontakt mit der Oberfläche. Dadurch können die Van-der-Waals-Kräfte zwischen den Molekülen der Spatulae und der Wand wirken. Genial, oder? Wenn ihr also das nächste Mal in Südostasien einen Gecko an der Hotelwand seht, wisst ihr Bescheid!
- Käse auf dem Brot: Warum bleibt der Käse so schön auf dem Brot kleben? Wieder Van-der-Waals-Kräfte! Die Moleküle des Käses und des Brotes ziehen sich gegenseitig an. Je "klebriger" der Käse, desto stärker sind die Kräfte. Probiert mal einen Brie auf einem knusprigen Baguette in Frankreich!
- Flüssigkeiten und Oberflächenspannung: Wenn ihr einen Wassertropfen auf eine glatte Oberfläche tropft, bildet er eine Kugel. Das liegt an der Oberflächenspannung des Wassers. Die Wassermoleküle ziehen sich gegenseitig durch Van-der-Waals-Kräfte an, wodurch die Oberfläche möglichst klein gehalten wird. Beobachtet das mal, wenn ihr in einem Wellnesshotel seid!
- Kleidung und Textilien: Warum knittern manche Stoffe leichter als andere? Die Fasern von Stoffen halten durch Van-der-Waals-Kräfte zusammen. Je stärker diese Kräfte sind, desto weniger knittern sie. Baumwolle knittern zum Beispiel leichter als synthetische Fasern. Denkt daran, wenn ihr eure Reisekleidung packt!
- Gase und Kondensation: Wenn ihr in den Bergen unterwegs seid und es kälter wird, seht ihr vielleicht, wie sich Kondenswasser an Fenstern oder Gräsern bildet. Die Gase in der Luft kühlen ab, und die Van-der-Waals-Kräfte zwischen den Molekülen werden stärker, wodurch sie sich zusammenlagern und kondensieren.
- Kunststoffflaschen: Warum sind Plastikflaschen so widerstandsfähig? Die langen Polymerketten, aus denen Kunststoffe bestehen, werden durch Van-der-Waals-Kräfte zusammengehalten, was ihnen Festigkeit verleiht.
Warum sind Van-der-Waals-Kräfte wichtig?
Obwohl sie schwach sind, spielen Van-der-Waals-Kräfte eine entscheidende Rolle in vielen Bereichen: Sie bestimmen die physikalischen Eigenschaften von Stoffen, wie ihren Schmelz- und Siedepunkt. Je stärker die Kräfte, desto höher sind diese Punkte. Sie sind auch wichtig für die Struktur von Proteinen und DNA in unserem Körper, sowie für viele industrielle Prozesse. Und natürlich, wie wir gesehen haben, für die Fähigkeit von Geckos, an Wänden zu klettern!
Ich hoffe, diese kleine Reise in die Welt der Van-der-Waals-Kräfte hat euch gefallen und euch einen neuen Blickwinkel auf eure Reiseerlebnisse gegeben! Wenn ihr das nächste Mal etwas "Klebt", "Kondensiert" oder "Klettert", denkt an die winzigen Kräfte, die dahinter stecken. Es ist faszinierend, wie die Natur mit solch einfachen Mitteln so komplexe Phänomene ermöglicht. Also, packt eure Koffer, geht auf Entdeckungstour und haltet die Augen offen für die unsichtbaren Kräfte, die unsere Welt zusammenhalten!
Gute Reise und viel Spaß beim Entdecken!





![Van Der Waals Kräfte Einfach Erklärt Van-der-Waals-Kräfte · Entstehung & Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/08/Van-der-Waals-Kräfte_1-1-1024x576.jpg)