Van Der Waals Kräfte Einfache Erklärung

Stell dir vor, du bist auf einer wunderschönen Wanderung in den Alpen. Die Sonne scheint, die Luft ist frisch und klar, und vor dir erstreckt sich eine atemberaubende Landschaft. Du atmest tief ein und spürst, wie sich die kleinen Wassermoleküle in der Luft an deinen Lungenwänden anlagern. Oder du genießt ein kühles Glas Wein in einem charmanten Straßencafé in Paris. Die Flüssigkeit formt Tropfen an der Innenseite des Glases. Was hält diese Moleküle eigentlich zusammen? Die Antwort ist: Van-der-Waals-Kräfte! Klingt kompliziert? Keine Sorge, ich erkläre es dir ganz einfach, so dass du es auf deiner nächsten Reise sogar deinen Mitreisenden erklären kannst.
Was sind Van-der-Waals-Kräfte überhaupt?
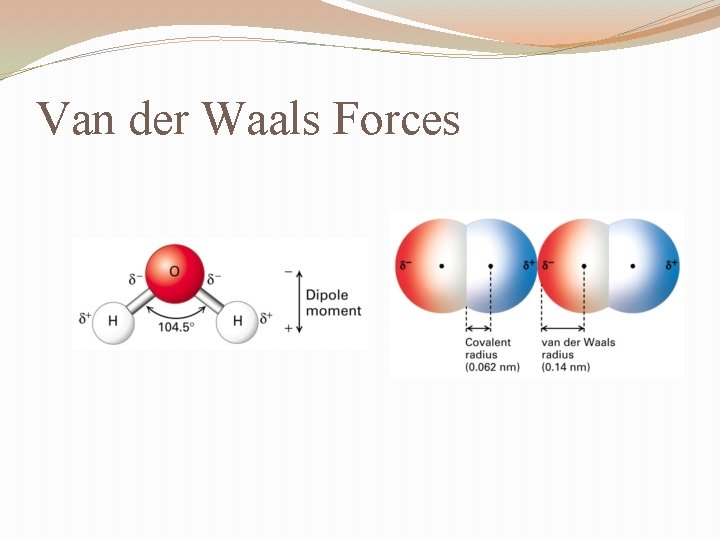
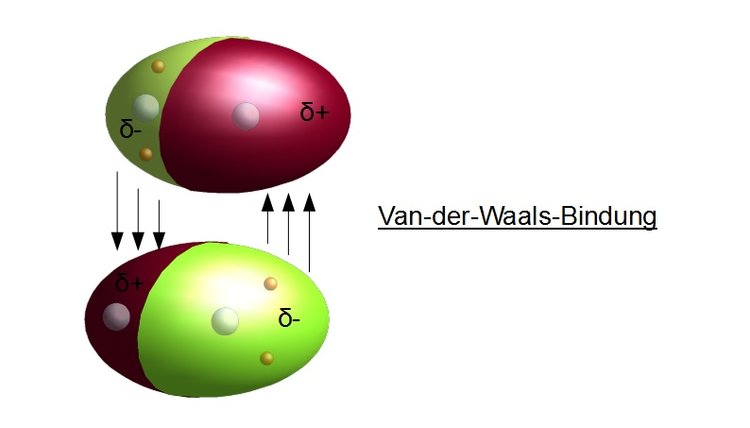
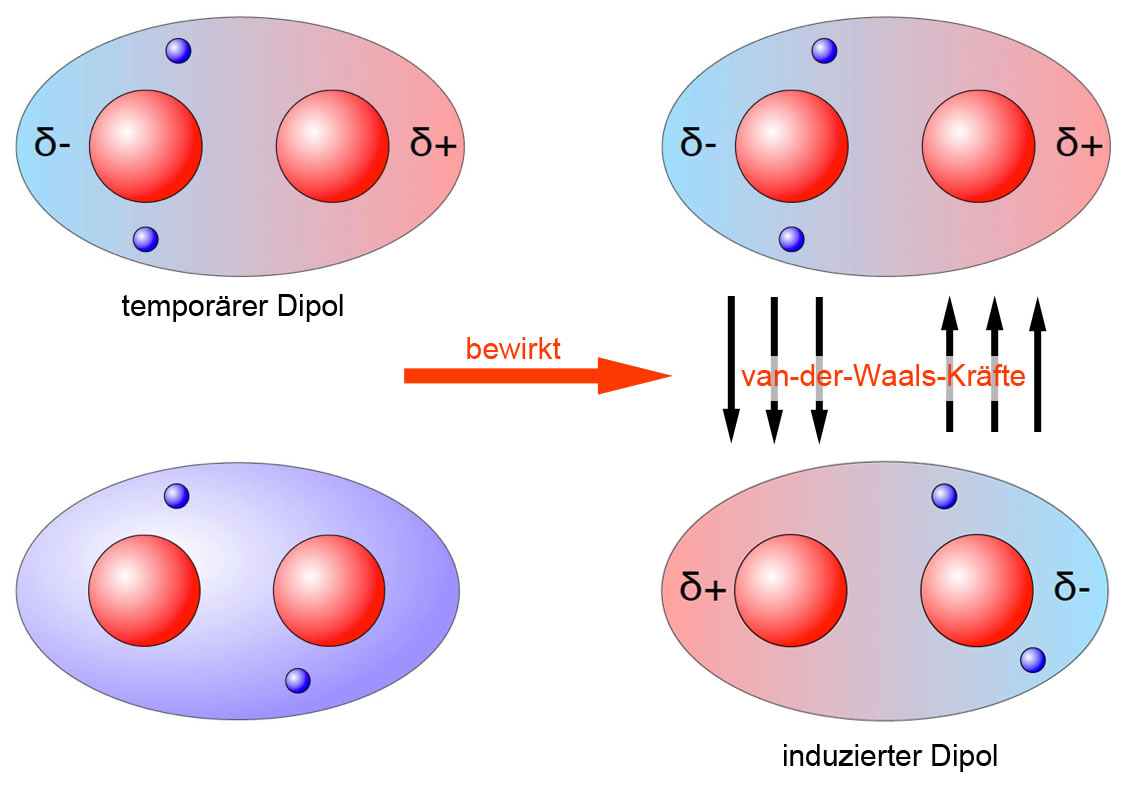
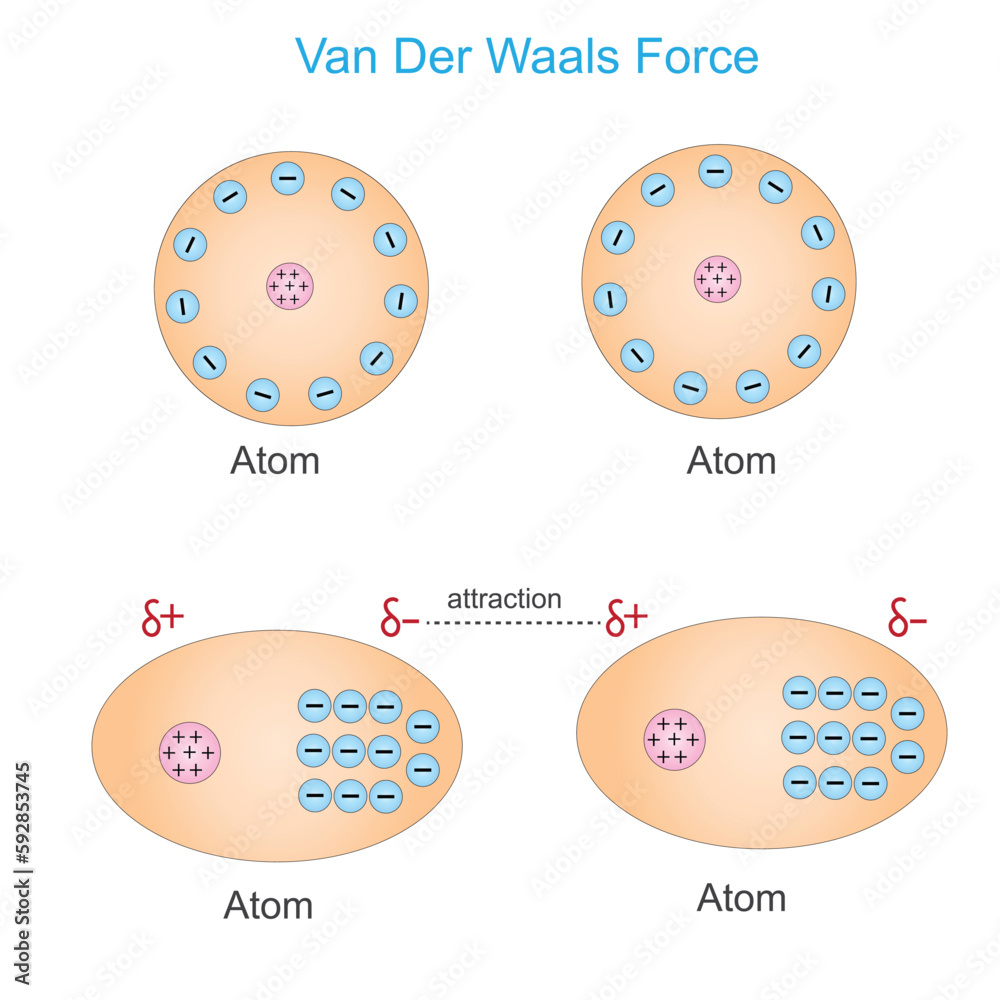
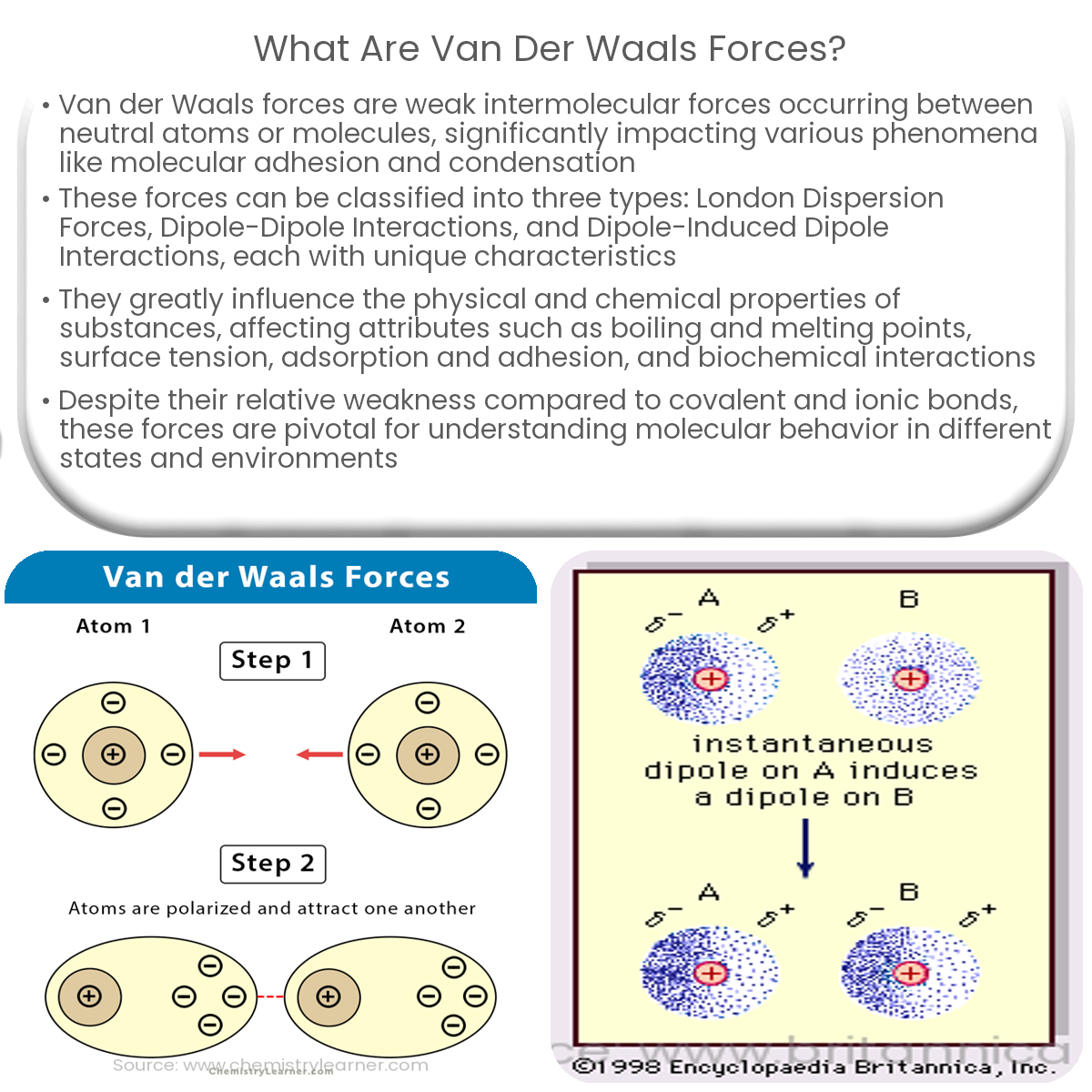
Ich stelle mir Van-der-Waals-Kräfte gerne als die kleinen, schüchternen Flirts zwischen Molekülen vor. Es sind schwache, aber dennoch überall vorhandene Anziehungskräfte, die dafür sorgen, dass Moleküle, die eigentlich gar nicht miteinander reagieren sollten, sich trotzdem kurzzeitig anziehen. Im Gegensatz zu stärkeren Bindungen, wie zum Beispiel den chemischen Bindungen in einem Wassermolekül (H2O), sind Van-der-Waals-Kräfte viel subtiler und entstehen durch temporäre Ladungsverschiebungen innerhalb der Moleküle.
Denk an einen Ballon, den du an deinen Haaren reibst. Plötzlich bleibt er an der Wand kleben, oder deine Haare stehen zu Berge. Das ist im Prinzip das gleiche Prinzip, nur eben auf molekularer Ebene. Durch die Reibung entsteht eine temporäre Ladungsungleichheit, die zu einer Anziehung führt. Bei Molekülen passiert das auch, aber viel, viel schneller und spontaner.
Die drei Geschwister der Van-der-Waals-Familie
Es gibt nicht nur eine Art von Van-der-Waals-Kraft, sondern gleich drei! Stell sie dir wie drei Geschwister vor, die alle ähnlich sind, aber doch unterschiedliche Stärken und Vorlieben haben:
- Dipol-Dipol-Wechselwirkungen: Stell dir vor, du hast zwei Magnete. Beide haben einen Plus- und einen Minuspol. Wenn du die entgegengesetzten Pole aneinanderhältst, ziehen sie sich an. Manche Moleküle sind wie kleine Magnete, weil sie eine ungleichmäßige Verteilung der Elektronen haben. Eine Seite ist leicht negativ geladen (δ-), die andere leicht positiv (δ+). Diese Moleküle nennt man Dipole. Wenn zwei Dipol-Moleküle in die Nähe kommen, richten sie sich so aus, dass die entgegengesetzten Ladungen sich anziehen. Das ist wie bei einem netten Tanzpartner, der sich ganz natürlich deinem Rhythmus anpasst.
- Dipol-induzierte Dipol-Wechselwirkungen: Hier ist es etwas komplizierter. Stell dir vor, ein Magnet (der Dipol) kommt in die Nähe einer unmagnetischen Eisenkugel (ein unpolares Molekül). Der Magnet kann die Elektronen in der Eisenkugel so verschieben, dass auch sie kurzzeitig zu einem kleinen Magneten werden. Jetzt ziehen sich die beiden an! Genauso funktioniert es bei Molekülen. Ein Dipol-Molekül kann in einem unpolaren Molekül eine temporäre Ladungsverschiebung hervorrufen, was zu einer Anziehung führt.
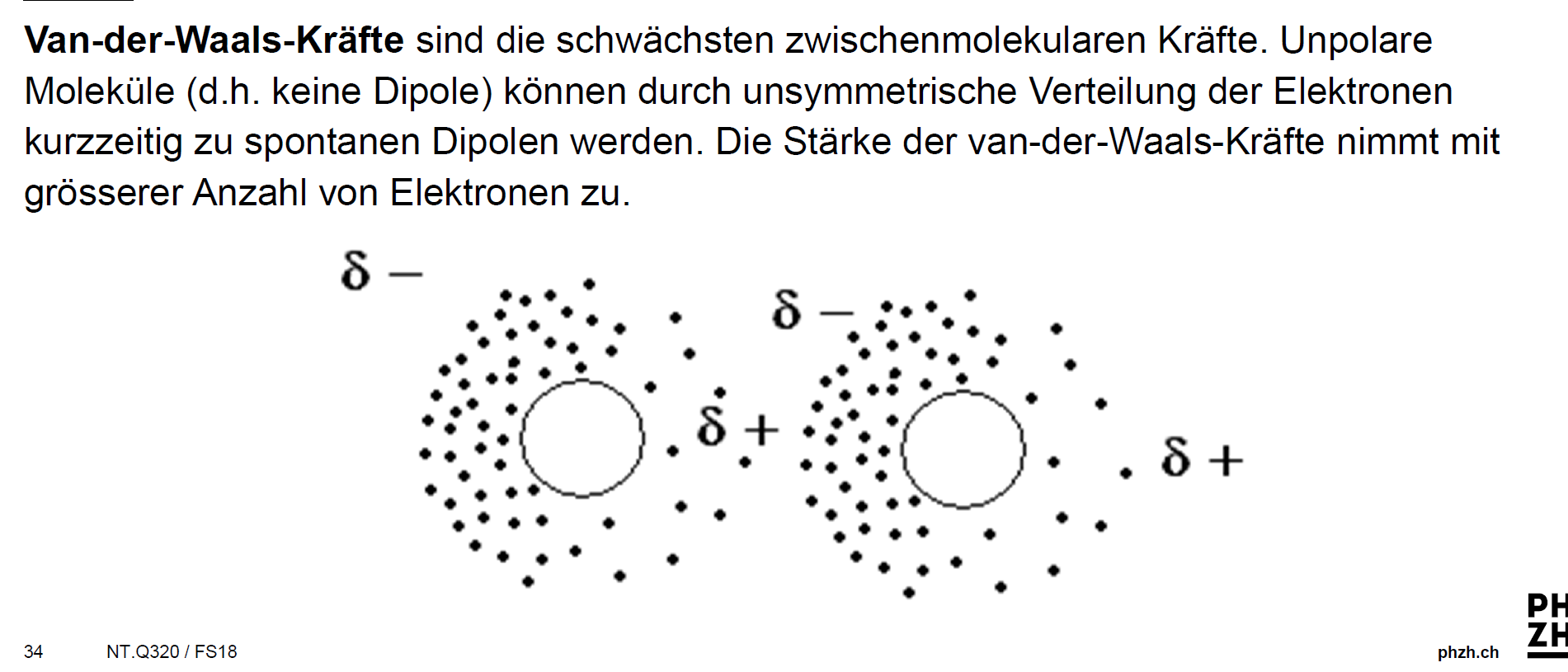
- London-Dispersionskräfte (auch bekannt als induzierte Dipol-induzierte Dipol-Wechselwirkungen): Das ist die interessanteste und gleichzeitig schwächste der drei. Stell dir vor, zwei neutrale, unpolare Moleküle schweben im Raum. Eigentlich sollte gar nichts passieren, oder? Aber selbst in diesen Molekülen bewegen sich die Elektronen ständig. Durch diese Bewegung kann es zu momentanen Ladungsungleichheiten kommen – winzige, flüchtige Dipole entstehen. Diese Dipole können dann in benachbarten Molekülen ebenfalls Dipole induzieren, was zu einer schwachen Anziehung führt. Denk an zwei schüchterne Teenager auf einer Party, die sich nur kurz Blicke zuwerfen.
Die London-Dispersionskräfte sind übrigens immer vorhanden, egal ob ein Molekül polar oder unpolar ist. Sie sind die Allgegenwärtigen unter den Van-der-Waals-Kräften!
Wo begegnen uns Van-der-Waals-Kräfte auf Reisen?
Überall! Sie sind die heimlichen Helden unseres Alltags und spielen eine entscheidende Rolle in vielen Phänomenen, die wir auf Reisen beobachten können:
- Der Gecko an der Wand: Hast du dich jemals gefragt, wie ein Gecko an einer glatten Glaswand hochlaufen kann? Seine Füße sind mit Millionen von winzigen Härchen (Setae) bedeckt, die sich perfekt an die Oberfläche anpassen. Durch die große Anzahl von Kontaktpunkten summieren sich die Van-der-Waals-Kräfte zwischen den Härchen und der Wand, sodass der Gecko problemlos haften bleibt. Ein echtes Wunder der Natur! Beobachte das mal, wenn du in wärmeren Gefilden unterwegs bist.
- Kondensation von Wasser: Nach einem Regenschauer siehst du, wie sich winzige Wassertropfen auf Blättern oder Fensterscheiben bilden. Die Wassermoleküle ziehen sich durch Van-der-Waals-Kräfte gegenseitig an und bilden so die Tropfen. Denk daran, wenn du das nächste Mal durch einen tropischen Regenwald wanderst!
- Die Form von Medikamenten: Die Form eines Medikaments ist entscheidend dafür, wie es im Körper wirkt. Van-der-Waals-Kräfte spielen eine wichtige Rolle bei der Bindung des Medikaments an sein Zielmolekül (z.B. ein Enzym oder ein Rezeptor). Stell dir vor, du nimmst eine Tablette in einem schicken Wellness-Hotel auf Bali – die Van-der-Waals-Kräfte arbeiten im Verborgenen, um deine Gesundheit zu unterstützen.
- Oberflächenspannung: Wenn du einen Insekt über eine Wasseroberfläche laufen siehst, dann dankt er das den Van-der-Waals-Kräften. Sie halten die Wassermoleküle zusammen und erzeugen eine Art "Haut" auf der Wasseroberfläche. Perfekt sichtbar in ruhigen Bergseen oder Flüssen!
- Die Viskosität von Flüssigkeiten: Honig ist dickflüssiger als Wasser. Das liegt daran, dass die Honigmoleküle stärkere Van-der-Waals-Kräfte aufeinander ausüben. Wenn du also auf einer kulinarischen Reise bist und verschiedene regionale Spezialitäten probierst, achte auch mal auf die Konsistenz!
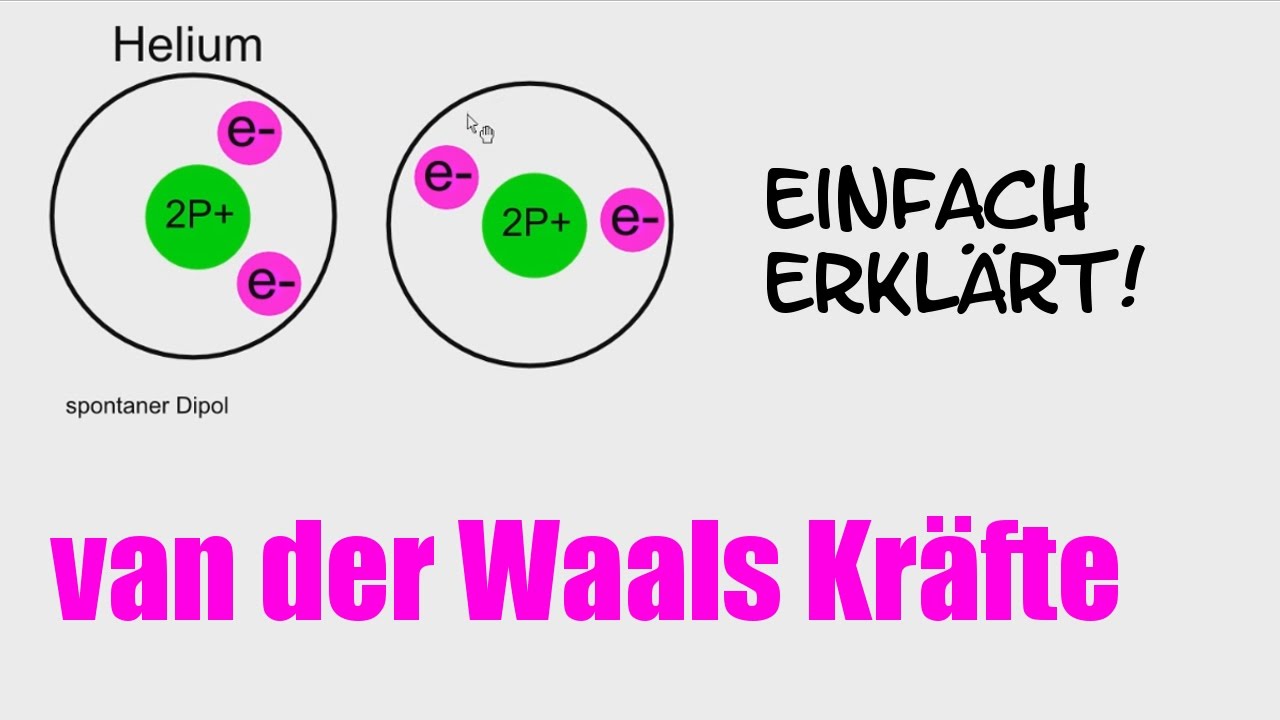
- Warum Helium bei tiefen Temperaturen flüssig wird: Helium ist ein Edelgas und geht eigentlich keine chemischen Verbindungen ein. Aber bei extrem tiefen Temperaturen sind die London-Dispersionskräfte stark genug, um die Heliumatome zusammenzuhalten und eine Flüssigkeit zu bilden. Vielleicht siehst du so etwas in einem wissenschaftlichen Museum, wenn du auf Städtereise bist.
Warum sind Van-der-Waals-Kräfte für uns Reisende wichtig?
Auch wenn du es vielleicht nicht merkst, Van-der-Waals-Kräfte beeinflussen viele Aspekte deiner Reiseerlebnisse. Sie erklären, warum bestimmte Materialien besser kleben, warum bestimmte Flüssigkeiten leichter verdunsten oder warum bestimmte Oberflächen rutschiger sind als andere. Ein besseres Verständnis dieser Kräfte kann dir helfen, die Welt um dich herum bewusster wahrzunehmen und die kleinen Wunder der Natur zu schätzen.
Also, das nächste Mal, wenn du einen Gecko an der Wand siehst, einen Wassertropfen auf einem Blatt bewunderst oder einfach nur ein Glas Wein genießt, denk an die kleinen, schüchternen Van-der-Waals-Kräfte, die im Verborgenen wirken und unsere Welt zusammenhalten. Gute Reise!
"Die Welt ist voller kleiner Wunder, die darauf warten, entdeckt zu werden. Die Van-der-Waals-Kräfte sind nur eines davon!"
Bonus-Tipp: Wenn du tiefer in die Materie eintauchen möchtest, such im Internet nach "Intermolekulare Kräfte". Es gibt viele tolle Animationen und Erklärungen, die das Thema noch anschaulicher machen. Und wer weiß, vielleicht inspirieren dich die Van-der-Waals-Kräfte ja zu deiner nächsten Reise! Entdecke die Welt der Moleküle – es lohnt sich!



![Van Der Waals Kräfte Einfache Erklärung Van-der-Waals-Kräfte · Entstehung & Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/08/Van-der-Waals-Kräfte_1-1-1024x576.jpg)