Wann Ist Ein Molekül Polar

Willkommen in der faszinierenden Welt der Moleküle! Wenn Sie sich jemals gefragt haben, warum sich Wasser und Öl nicht vermischen oder warum manche Materialien elektrisch leitfähig sind, dann sind Sie hier genau richtig. Heute tauchen wir ein in das Konzept der Polarität von Molekülen – ein Schlüsselprinzip, das die Eigenschaften vieler Substanzen um uns herum bestimmt. Keine Sorge, wir machen es leicht verständlich und praxisnah, ideal für alle, die Deutschland erkunden oder sich hier einleben!
Was bedeutet "polar" überhaupt?
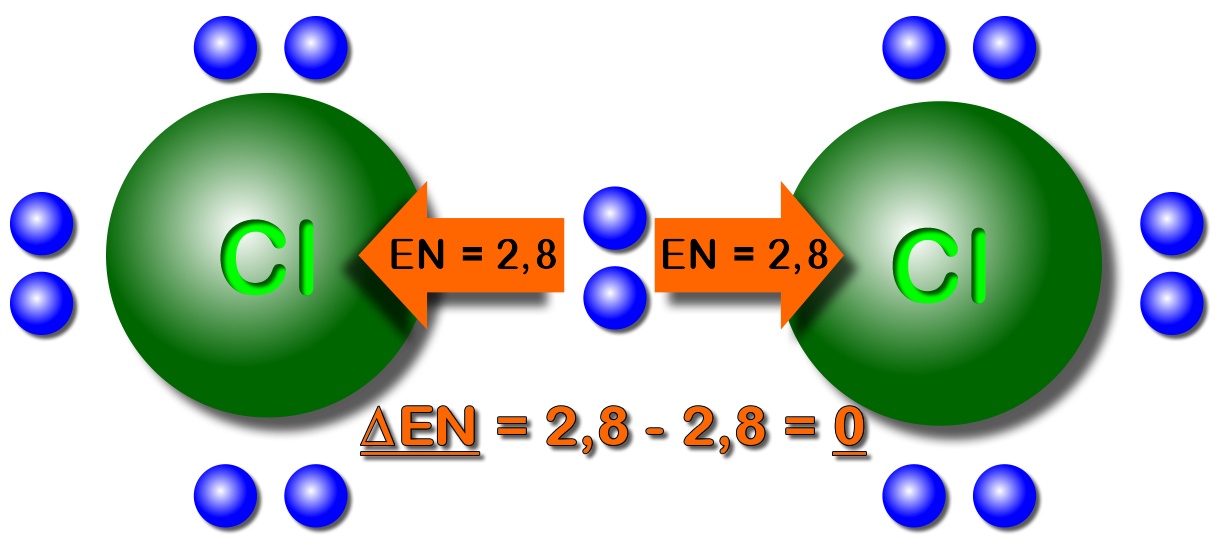
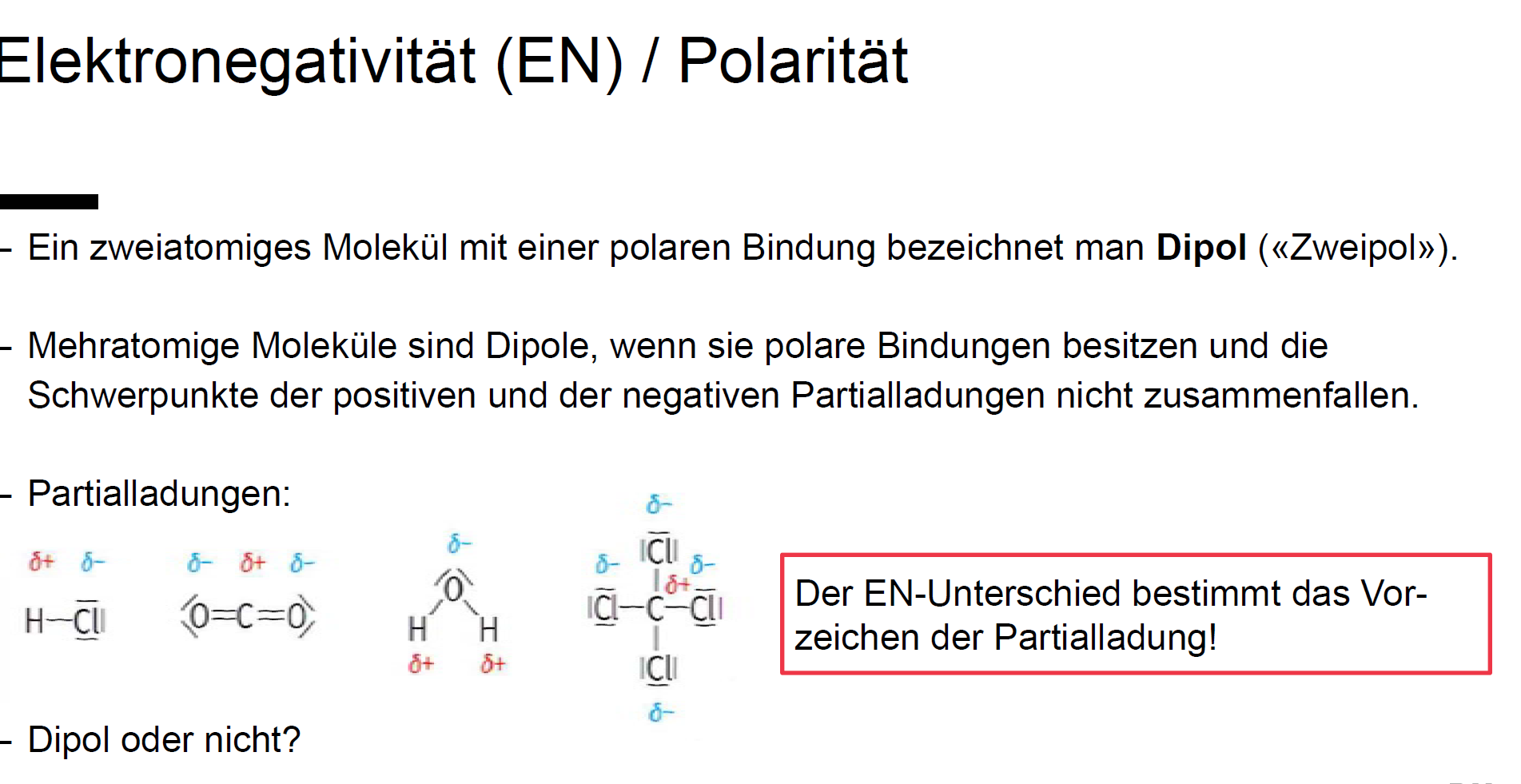
Stellen Sie sich ein Molekül wie ein winziges Hantel vor. Wenn beide Enden gleich stark ziehen, ist die Hantel ausgeglichen. Aber was passiert, wenn ein Ende stärker zieht als das andere? Genau das passiert bei polaren Molekülen. Polarität in der Chemie bedeutet, dass die Elektronen in einem Molekül nicht gleichmäßig verteilt sind. Dies führt zu einer leichten positiven Ladung an einem Ende und einer leichten negativen Ladung am anderen Ende. Es entsteht also ein Dipol – zwei Pole, ähnlich wie bei einem Magneten.
Die Rolle der Elektronegativität
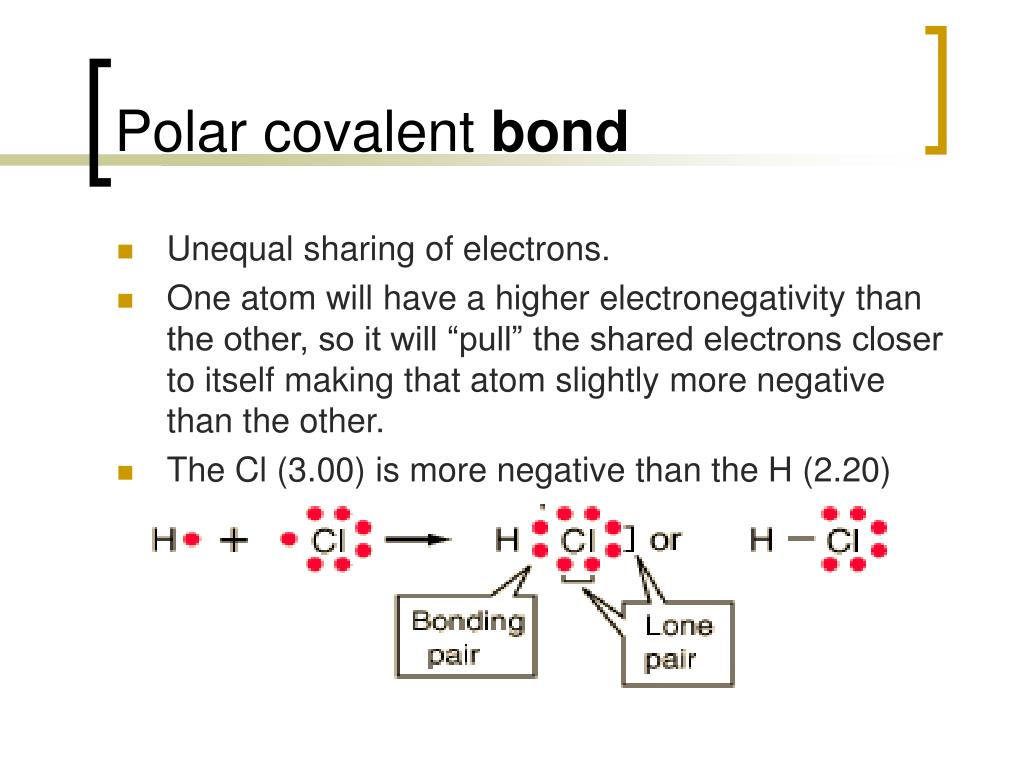
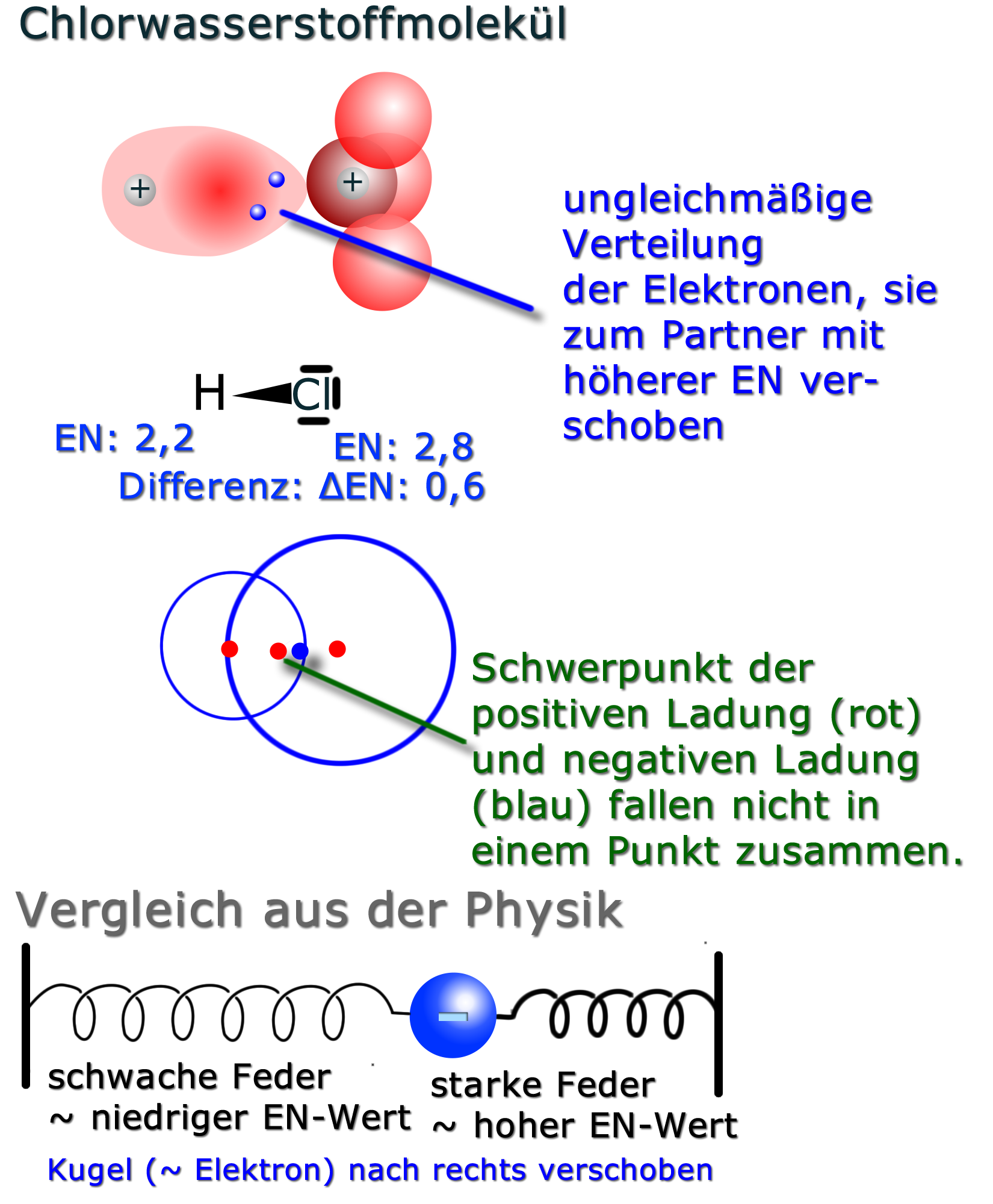
Der entscheidende Faktor, der bestimmt, ob ein Molekül polar ist oder nicht, ist die Elektronegativität der Atome, aus denen es besteht. Elektronegativität ist ein Maß dafür, wie stark ein Atom Elektronen in einer chemischen Bindung anzieht. Je größer der Unterschied in der Elektronegativität zwischen zwei Atomen in einer Bindung ist, desto polarer ist die Bindung. Betrachten wir das Wassermolekül (H₂O) als Beispiel.
Sauerstoff hat eine viel höhere Elektronegativität als Wasserstoff. Das bedeutet, dass der Sauerstoff die Elektronen in den O-H-Bindungen stärker an sich zieht. Dadurch erhält der Sauerstoff im Wassermolekül eine leicht negative Ladung (δ-) und die beiden Wasserstoffatome jeweils eine leicht positive Ladung (δ+). Die asymmetrische Verteilung der Ladung macht das Wassermolekül polar.
Wie man Polarität erkennt: Die Grundlagen
Hier sind einige einfache Richtlinien, um zu erkennen, wann ein Molekül wahrscheinlich polar ist:
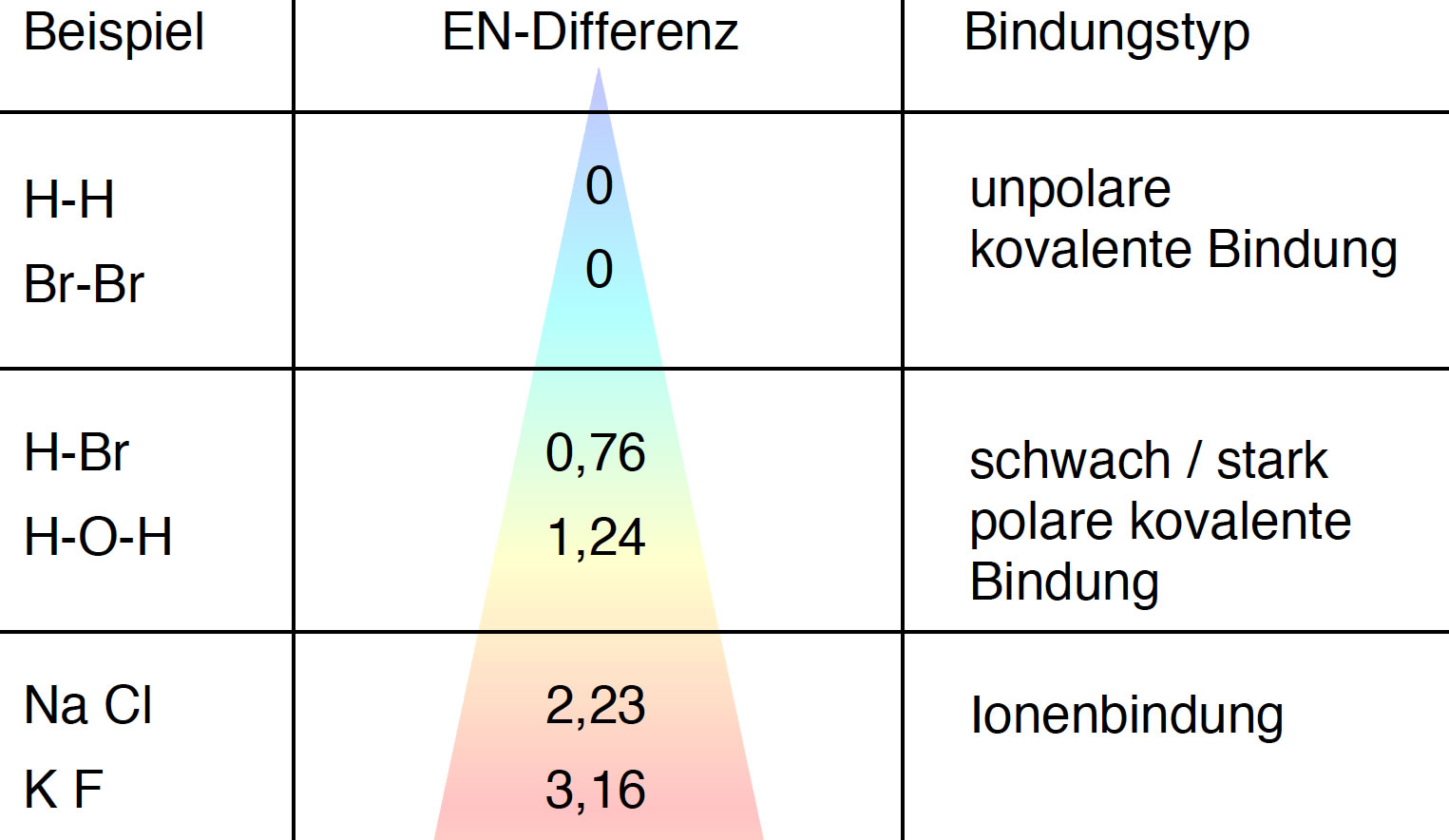
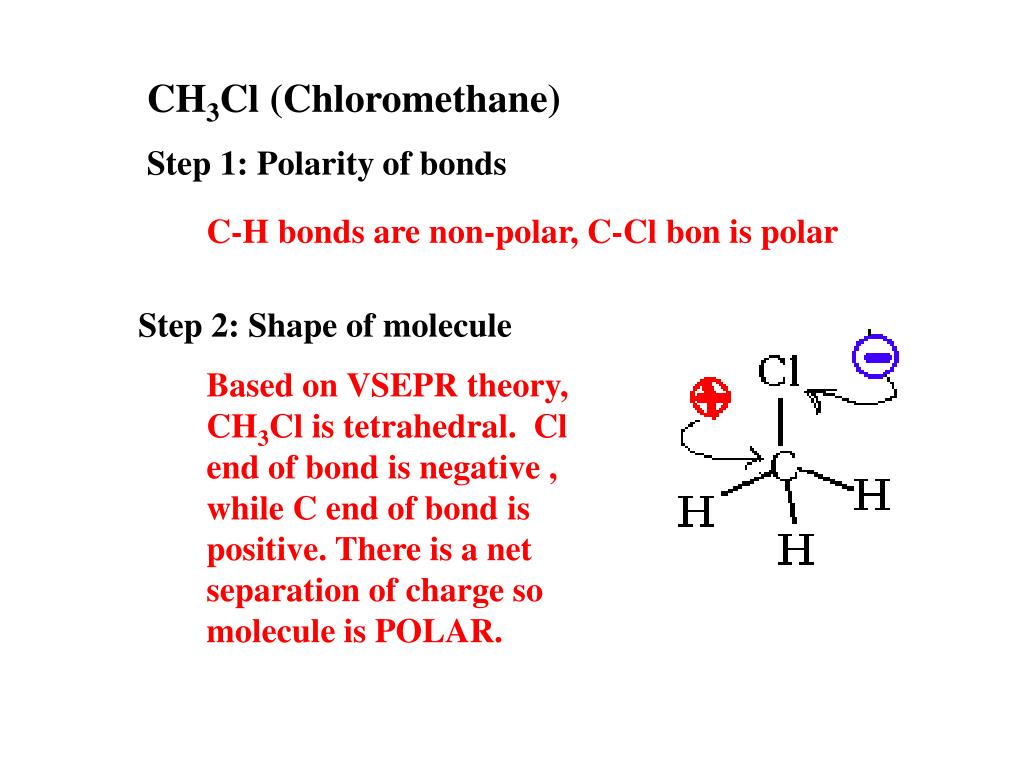
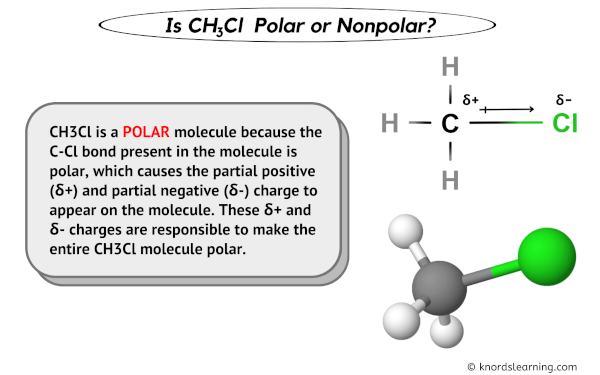
- Unterschiedliche Atome mit unterschiedlicher Elektronegativität: Wenn ein Molekül aus Atomen mit signifikant unterschiedlicher Elektronegativität besteht (z.B. H und O, C und Cl), ist die Wahrscheinlichkeit hoch, dass es polar ist. Eine Elektronegativitätstabelle kann dabei helfen.
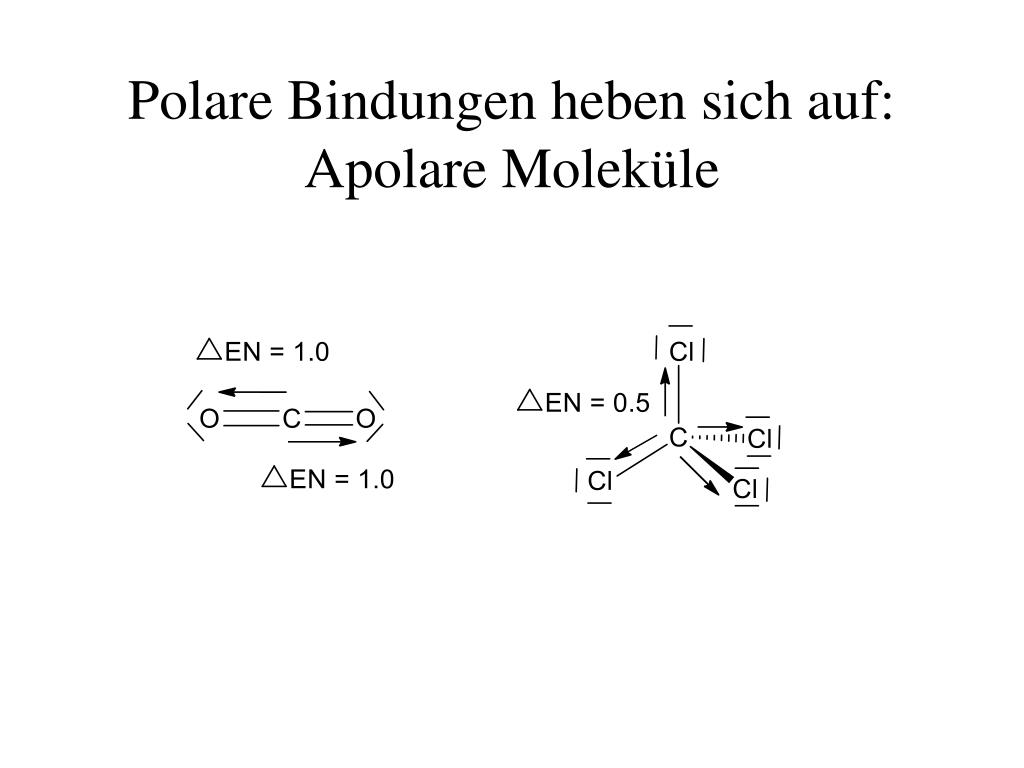
- Asymmetrische Molekülgeometrie: Selbst wenn ein Molekül polare Bindungen enthält, kann es insgesamt unpolar sein, wenn die polaren Bindungen sich gegenseitig aufheben. Dies geschieht oft bei Molekülen mit einer sehr symmetrischen Form, wie z.B. Kohlenstoffdioxid (CO₂). CO₂ hat zwar zwei polare C=O-Bindungen, aber die lineare Form des Moleküls führt dazu, dass sich die Dipolmomente der beiden Bindungen aufheben, wodurch das Molekül insgesamt unpolar wird.
- Vorhandensein von freien Elektronenpaaren: Atome mit freien Elektronenpaaren (Elektronen, die nicht an einer Bindung beteiligt sind) üben zusätzlichen Einfluss auf die Molekülgeometrie aus und tragen oft zur Polarität bei. Das Wassermolekül (H₂O) ist ein gutes Beispiel, da der Sauerstoff zwei freie Elektronenpaare besitzt, die die Molekülgeometrie verbiegen und zur Polarität beitragen.
Beispiele für polare und unpolare Moleküle
Lassen Sie uns einige gängige Beispiele betrachten, um das Konzept zu veranschaulichen:
- Polar:
- Wasser (H₂O): Wie bereits erwähnt, ist Wasser aufgrund der Elektronegativitätsdifferenz zwischen Sauerstoff und Wasserstoff und der gewinkelten Molekülgeometrie polar.
- Ammoniak (NH₃): Der Stickstoff ist elektronegativer als die Wasserstoffatome und besitzt ein freies Elektronenpaar. Dadurch ist Ammoniak polar.
- Ethanol (C₂H₅OH): Die Hydroxylgruppe (-OH) macht Ethanol polar. Der Rest des Moleküls (die Ethylgruppe) ist jedoch unpolar.
- Unpolar:
- Methan (CH₄): Obwohl die C-H-Bindungen leicht polar sind, ist die tetraedrische Molekülgeometrie sehr symmetrisch, wodurch sich die Dipolmomente aufheben.
- Kohlenstoffdioxid (CO₂): Wie bereits erwähnt, ist CO₂ aufgrund seiner linearen Struktur unpolar.
- Öl und Fette: Diese bestehen hauptsächlich aus Kohlenwasserstoffen (Kohlenstoff- und Wasserstoffatome), die sehr ähnliche Elektronegativitäten aufweisen. Daher sind Öl und Fette im Allgemeinen unpolar.
Warum ist die Polarität so wichtig?
Die Polarität von Molekülen hat weitreichende Auswirkungen auf die Eigenschaften von Substanzen. Hier sind einige Beispiele:
- Löslichkeit: "Gleiches löst Gleiches" ist ein bekanntes Prinzip in der Chemie. Polare Substanzen lösen sich gut in polaren Lösungsmitteln (wie Wasser), während unpolare Substanzen sich gut in unpolaren Lösungsmitteln (wie Öl) lösen. Das ist der Grund, warum sich Öl und Wasser nicht mischen – Wasser ist polar und Öl ist unpolar.
- Siedepunkte: Polare Moleküle haben in der Regel höhere Siedepunkte als unpolare Moleküle ähnlicher Größe. Dies liegt daran, dass zwischen polaren Molekülen stärkere intermolekulare Kräfte (Dipol-Dipol-Wechselwirkungen und Wasserstoffbrückenbindungen) wirken, die mehr Energie benötigen, um überwunden zu werden.
- Elektrische Leitfähigkeit: Die Polarität kann beeinflussen, wie gut eine Substanz Elektrizität leitet. Zum Beispiel sind ionische Verbindungen (die aus geladenen Ionen bestehen) oft gute Leiter, wenn sie in Wasser gelöst sind, da die polaren Wassermoleküle die Ionen stabilisieren und ihnen erlauben, sich frei zu bewegen.
- Biologische Systeme: Die Polarität spielt eine entscheidende Rolle in biologischen Systemen. Zum Beispiel ist Wasser das Hauptlösungsmittel in lebenden Organismen, und die Polarität von Wasser ist entscheidend für viele biologische Prozesse, wie z.B. die Faltung von Proteinen und die Bildung von Zellmembranen.
Polarität im Alltag: Beispiele aus Deutschland
Die Auswirkungen der Polarität lassen sich auch im deutschen Alltag beobachten:
- Reinigung: Deutsche sind bekannt für ihre Sauberkeit. Viele Reinigungsmittel nutzen die Polarität aus. Seifen und Waschmittel haben sowohl polare als auch unpolare Bereiche. Der unpolare Bereich löst sich im Fett und Schmutz, während der polare Bereich sich im Wasser löst, wodurch der Schmutz weggewaschen werden kann.
- Kochen: Beim Kochen spielt die Polarität eine Rolle bei der Zubereitung von Saucen und Dressings. Emulgatoren wie Eigelb (in Mayonnaise) oder Senf helfen, Öl und Wasser zu vermischen, da sie sowohl polare als auch unpolare Eigenschaften besitzen.
- Kleidung: Die Auswahl der richtigen Kleidung hängt oft mit der Polarität der Fasern zusammen. Baumwolle ist polar und nimmt Wasser gut auf, was sie ideal für Sommerkleidung macht. Synthetische Fasern wie Polyester sind oft unpolar und wasserabweisend, was sie für Regenkleidung geeignet macht.
- Weinherstellung: Die Polarität spielt eine Rolle bei der Extraktion von Aromastoffen aus den Trauben während der Weinherstellung. Auch die Stabilität und das Mundgefühl des Weines werden durch polare und unpolare Inhaltsstoffe beeinflusst.
Ein kleines Experiment für zu Hause
Um die Polarität von Wasser zu demonstrieren, können Sie ein einfaches Experiment durchführen:
- Reiben Sie einen Plastiklöffel oder einen Luftballon an Ihren Haaren oder einem Wollpullover, um ihn statisch aufzuladen.
- Lassen Sie einen dünnen Wasserstrahl aus einem Wasserhahn laufen.
- Halten Sie den aufgeladenen Löffel oder Ballon in die Nähe des Wasserstrahls.
Sie werden feststellen, dass der Wasserstrahl zum Löffel oder Ballon abgelenkt wird. Das liegt daran, dass die statische Ladung auf dem Löffel oder Ballon die polaren Wassermoleküle anzieht.
Fazit
Die Polarität von Molekülen ist ein fundamentales Konzept, das viele Aspekte unserer Welt erklärt, von der Löslichkeit von Substanzen bis hin zu biologischen Prozessen. Ich hoffe, diese Erklärung hat Ihnen geholfen, dieses Konzept besser zu verstehen und seine Bedeutung im Alltag zu erkennen. Wenn Sie das nächste Mal in Deutschland sind und ein Gericht kochen, Wäsche waschen oder einfach nur ein Glas Wasser trinken, denken Sie an die faszinierende Welt der polaren Moleküle! Viel Spaß beim Entdecken!
"Wissen ist Macht." - Francis Bacon
![Wann Ist Ein Molekül Polar Polarität • polar und unpolar, Polarität Chemie · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/05/Polarität_WP_2_wasser-1-1024x576.jpg)
![Wann Ist Ein Molekül Polar Polarität • polar und unpolar, Polarität Chemie · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/05/Polarität_WP_4_elektrisches-dipolmoment-1-1024x576.jpg)
![Wann Ist Ein Molekül Polar Atombindungen • Erklärung, Eigenschaften · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/11/Folie3-6-1024x576.png)

![Wann Ist Ein Molekül Polar Moleküle • Aufbau, Beispiele, Eigenschaften · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/11/WP_1_polare-Moleküle-1024x576.jpg)
![Wann Ist Ein Molekül Polar Kovalente Bindung • Polare Atombindung, Bindungsarten · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/09/Kovalente_Bindung_WP_3-1024x576.jpg)