Warum Haben Alkohole Eine Höhere Siedetemperatur Als Alkane

Hallo liebe Reisende und Freunde der gepflegten Wissensvermittlung! Vielleicht habt ihr euch schon einmal gefragt, warum der Wein so schön dampft, wenn er erhitzt wird, während das Benzin im Tank eures Mietwagens viel länger flüssig bleibt. Die Antwort liegt in der Chemie, genauer gesagt, in den unterschiedlichen Siedetemperaturen von Alkoholen und Alkanen. Keine Sorge, wir werden das Ganze nicht zu einer trockenen Chemiestunde machen. Stattdessen versuche ich, euch das Phänomen auf eine verständliche und unterhaltsame Weise zu erklären, so dass ihr beim nächsten Glas Wein mit eurem neu erworbenen Wissen glänzen könnt.
Alkohole und Alkane: Was ist der Unterschied?
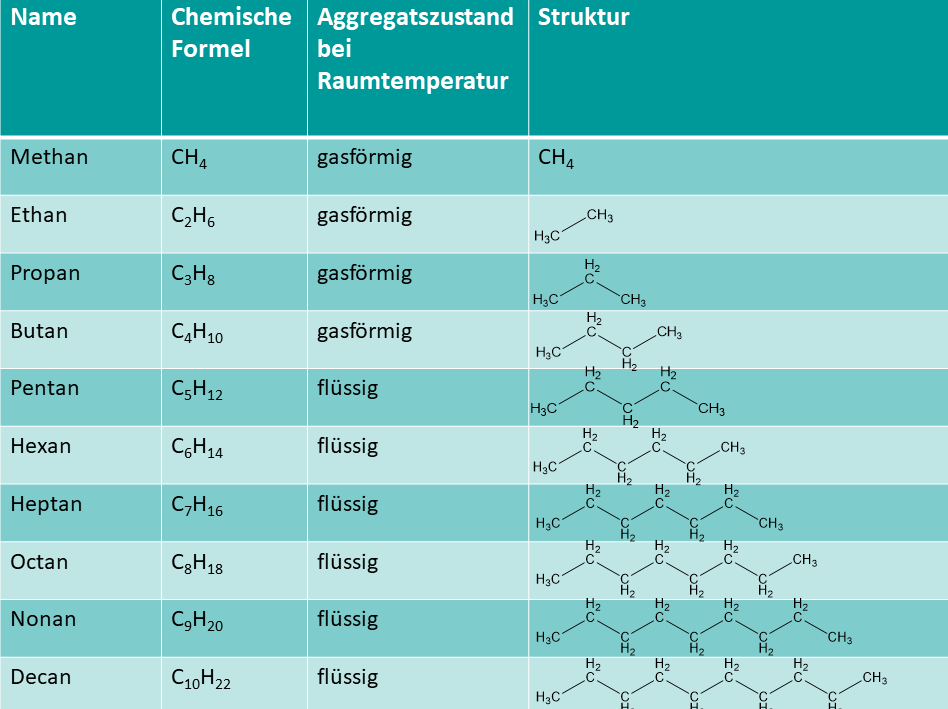
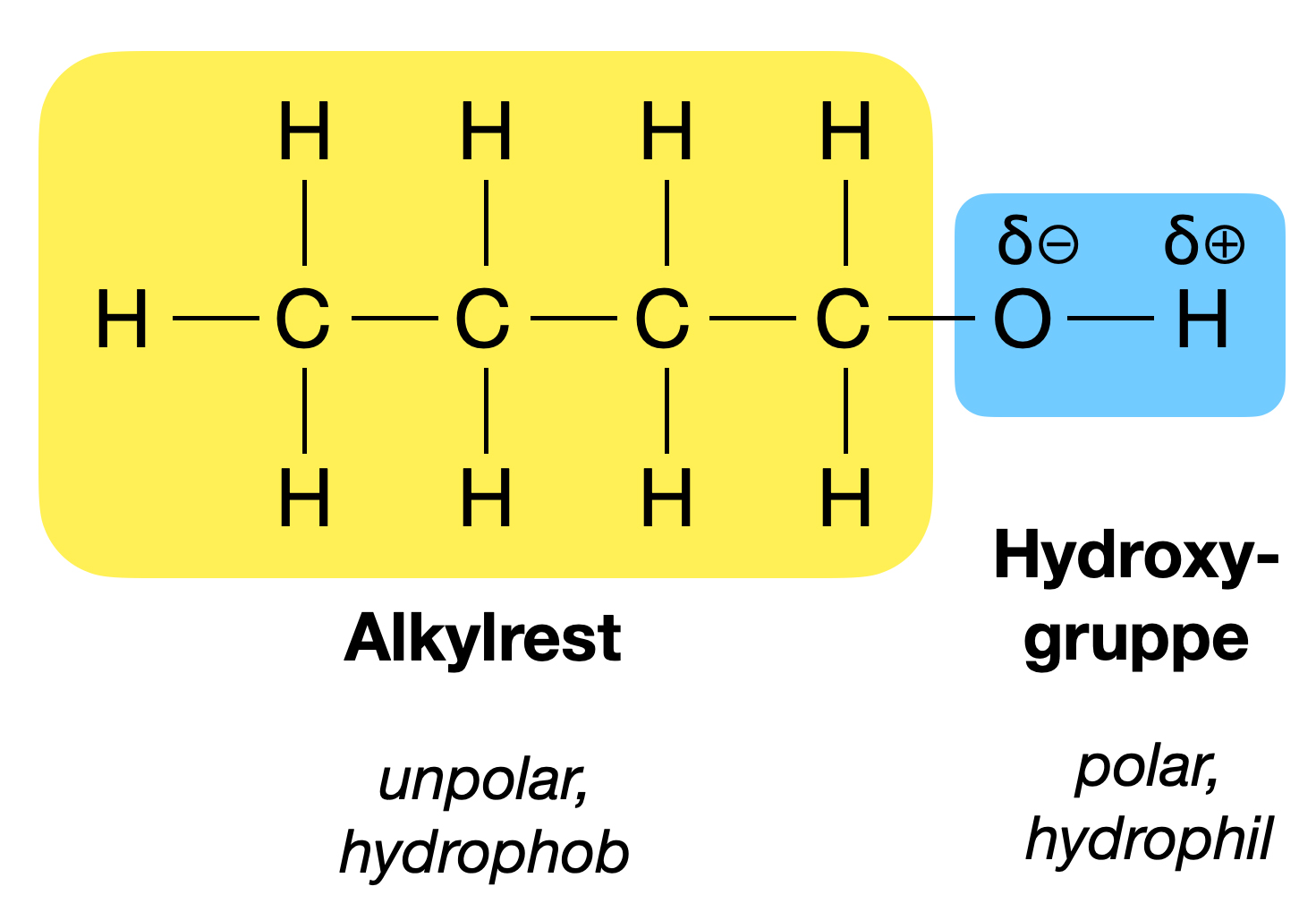
Bevor wir uns den Siedetemperaturen widmen, sollten wir kurz klären, was Alkohole und Alkane überhaupt sind. Stellt euch beide als Familien von Kohlenwasserstoffen vor, also Verbindungen, die hauptsächlich aus Kohlenstoff (C) und Wasserstoff (H) bestehen. Der entscheidende Unterschied liegt in einem kleinen, aber sehr wichtigen Detail: Alkohole haben eine zusätzliche OH-Gruppe (Hydroxylgruppe) an einem ihrer Kohlenstoffatome hängen. Alkane hingegen bestehen nur aus Kohlenstoff- und Wasserstoffatomen, die durch einfache Bindungen miteinander verbunden sind.
Ein kleines Beispiel zur Veranschaulichung: Methan (CH4) ist ein Alkan, während Ethanol (C2H5OH) ein Alkohol ist. Ethanol ist der Trinkalkohol, der in Bier, Wein und Spirituosen vorkommt.
Siedetemperatur: Was bedeutet das eigentlich?
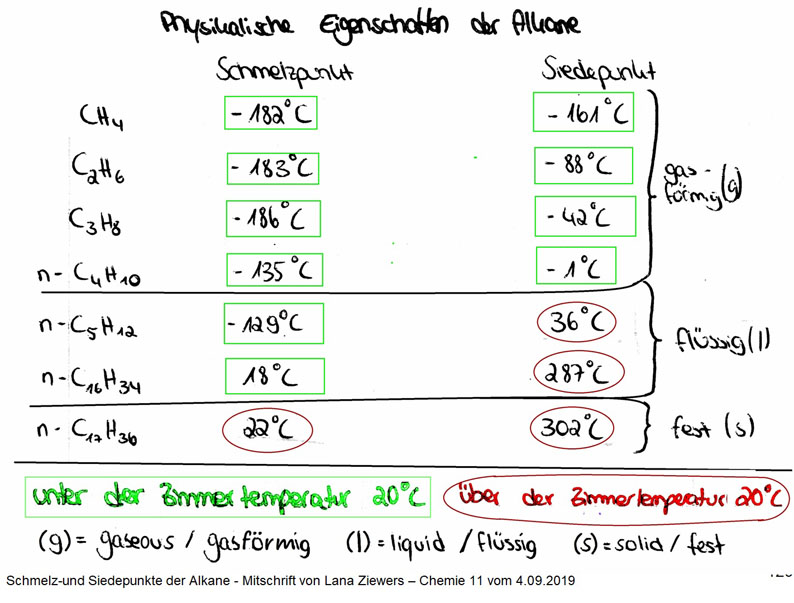
Die Siedetemperatur ist die Temperatur, bei der eine Flüssigkeit in einen gasförmigen Zustand übergeht. Einfacher gesagt: Es ist die Temperatur, bei der eine Flüssigkeit zu kochen beginnt. Je höher die Siedetemperatur einer Substanz, desto mehr Energie (Wärme) benötigt man, um die Anziehungskräfte zwischen den Molekülen zu überwinden und sie in den gasförmigen Zustand zu überführen.
Warum haben Alkohole eine höhere Siedetemperatur als Alkane?
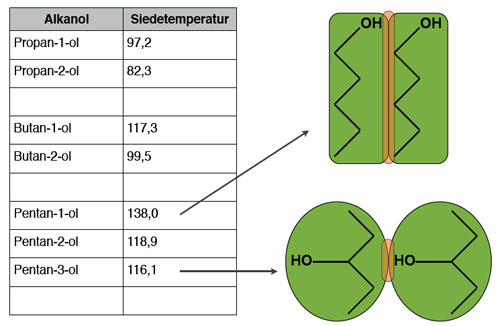
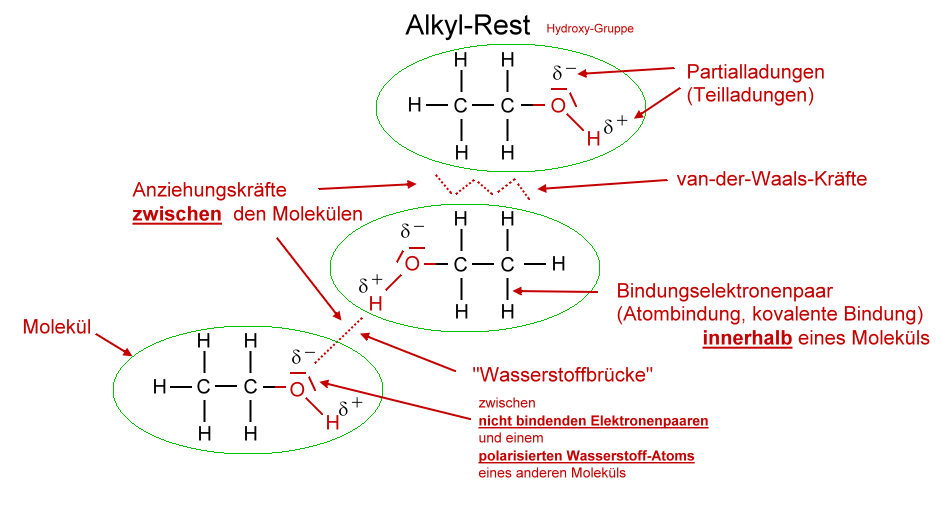
Hier kommt der springende Punkt: Die Hydroxylgruppe (OH-Gruppe) in Alkoholen macht den entscheidenden Unterschied. Diese Gruppe ermöglicht es den Alkoholmolekülen, untereinander Wasserstoffbrückenbindungen zu bilden. Was sind Wasserstoffbrückenbindungen? Stellt sie euch als eine Art "Klettverschluss" zwischen den Molekülen vor.
Wasserstoffbrückenbindungen: Der Schlüssel zum Verständnis
Wasserstoffbrückenbindungen entstehen, wenn ein Wasserstoffatom, das an ein stark elektronegatives Atom wie Sauerstoff (in der OH-Gruppe) gebunden ist, von einem anderen elektronegativen Atom in einem benachbarten Molekül angezogen wird. In Alkoholen ist das Sauerstoffatom in der OH-Gruppe stark elektronegativ, was bedeutet, dass es die Elektronen in der Bindung zu Wasserstoff stärker anzieht. Dadurch bekommt das Wasserstoffatom eine leicht positive Ladung (δ+), während das Sauerstoffatom eine leicht negative Ladung (δ-) erhält. Diese Ladungsunterschiede führen zu einer elektrostatischen Anziehungskraft zwischen dem positiv geladenen Wasserstoffatom eines Alkoholmoleküls und dem negativ geladenen Sauerstoffatom eines anderen Alkoholmoleküls – voilà, die Wasserstoffbrückenbindung ist geboren!
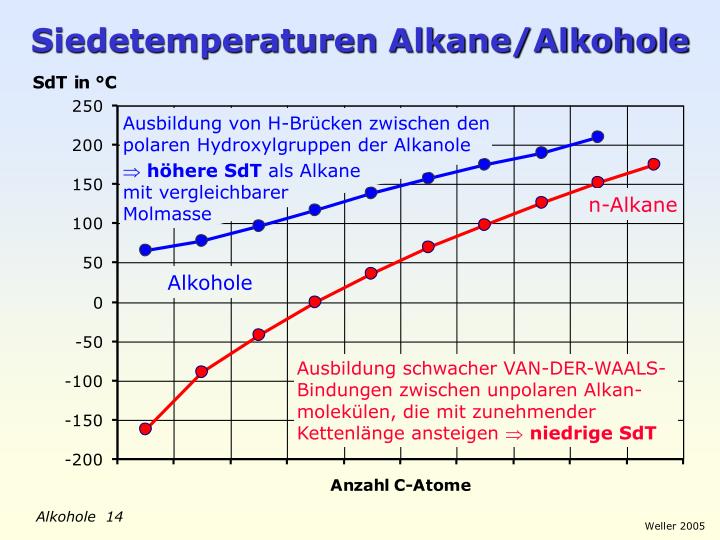
Merkt euch: Wasserstoffbrückenbindungen sind relativ starke intermolekulare Kräfte. Das bedeutet, dass sie mehr Energie benötigen, um gebrochen zu werden. Im Vergleich dazu halten Alkane nur durch schwache Van-der-Waals-Kräfte zusammen.
Van-der-Waals-Kräfte: Die schwächere Verbindung
Alkane, die nur aus Kohlenstoff- und Wasserstoffatomen bestehen, weisen keine so starken intermolekularen Kräfte wie Wasserstoffbrückenbindungen auf. Stattdessen werden sie durch Van-der-Waals-Kräfte zusammengehalten. Diese Kräfte sind schwächer und entstehen durch temporäre, zufällige Ladungsverschiebungen innerhalb der Moleküle. Diese Verschiebungen erzeugen kurzzeitig kleine Dipole (Bereiche mit unterschiedlicher Ladung), die benachbarte Moleküle anziehen. Da diese Dipole jedoch nur kurzlebig sind, sind die resultierenden Anziehungskräfte viel schwächer als Wasserstoffbrückenbindungen.
Die Auswirkung auf die Siedetemperatur
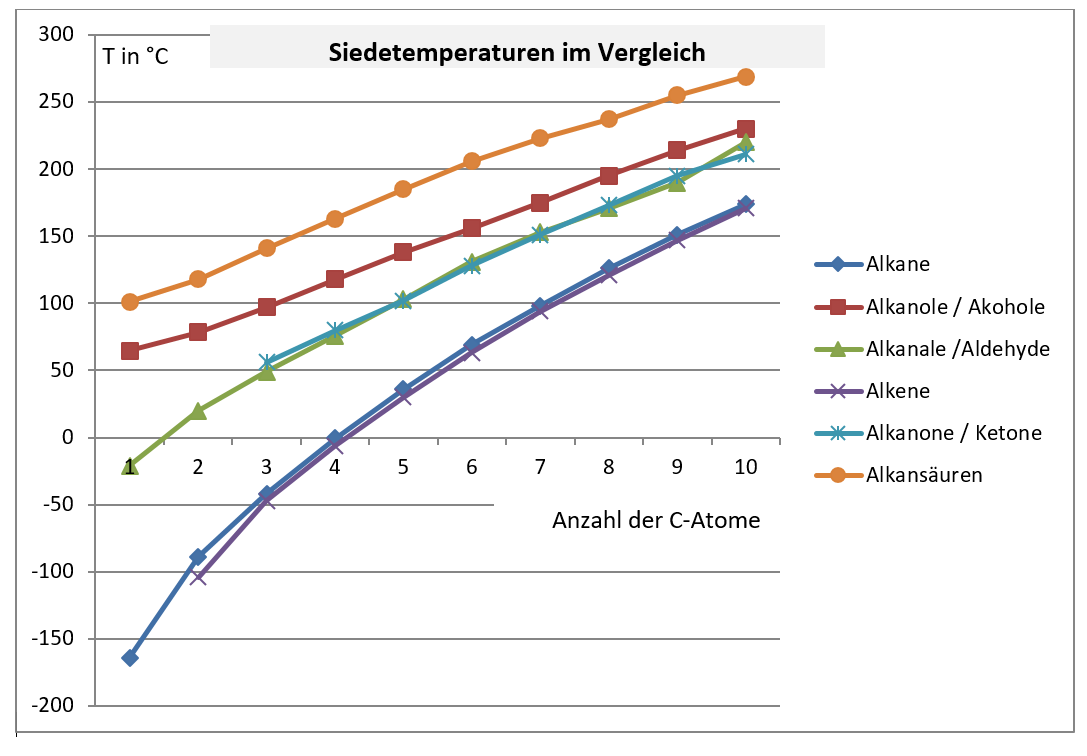
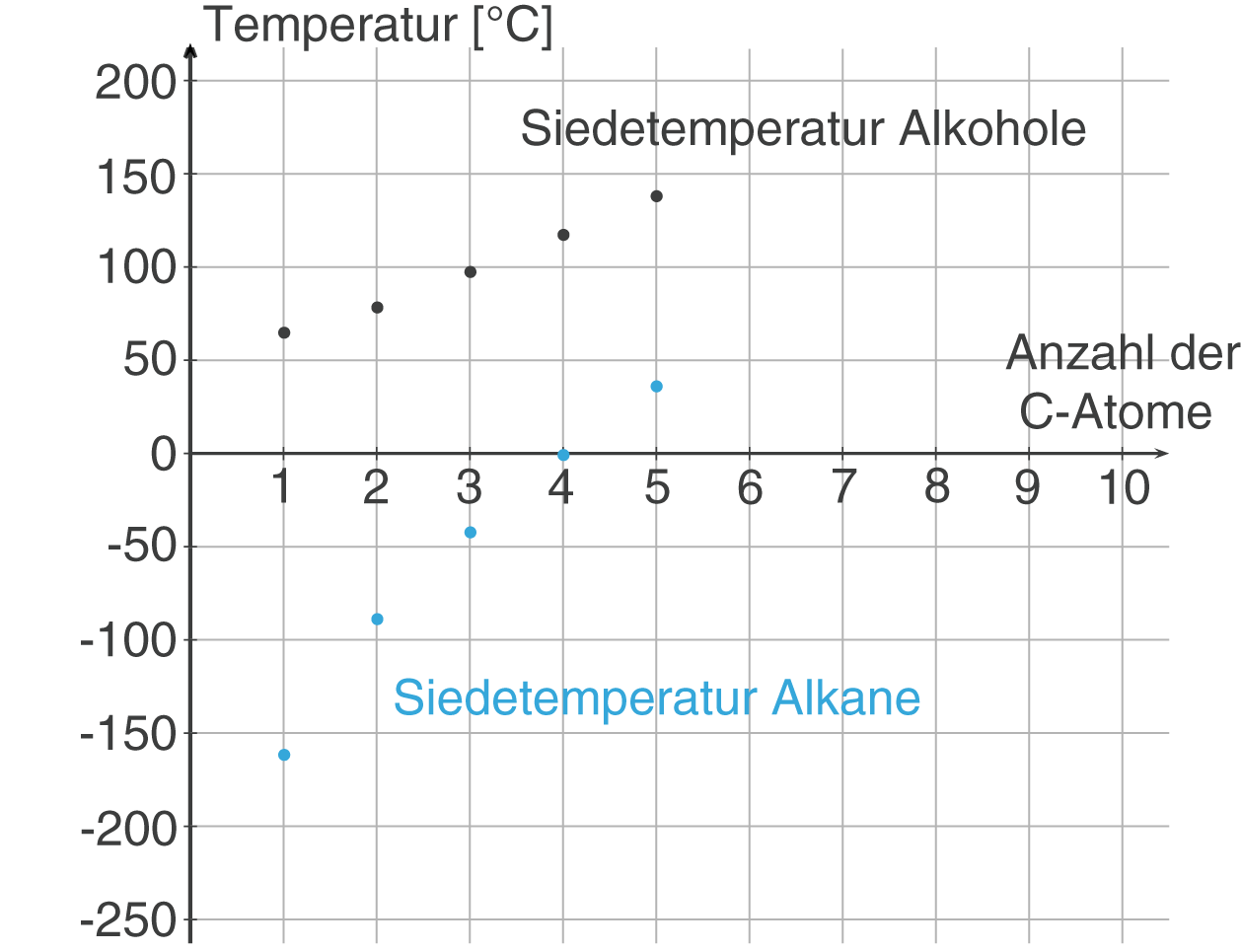
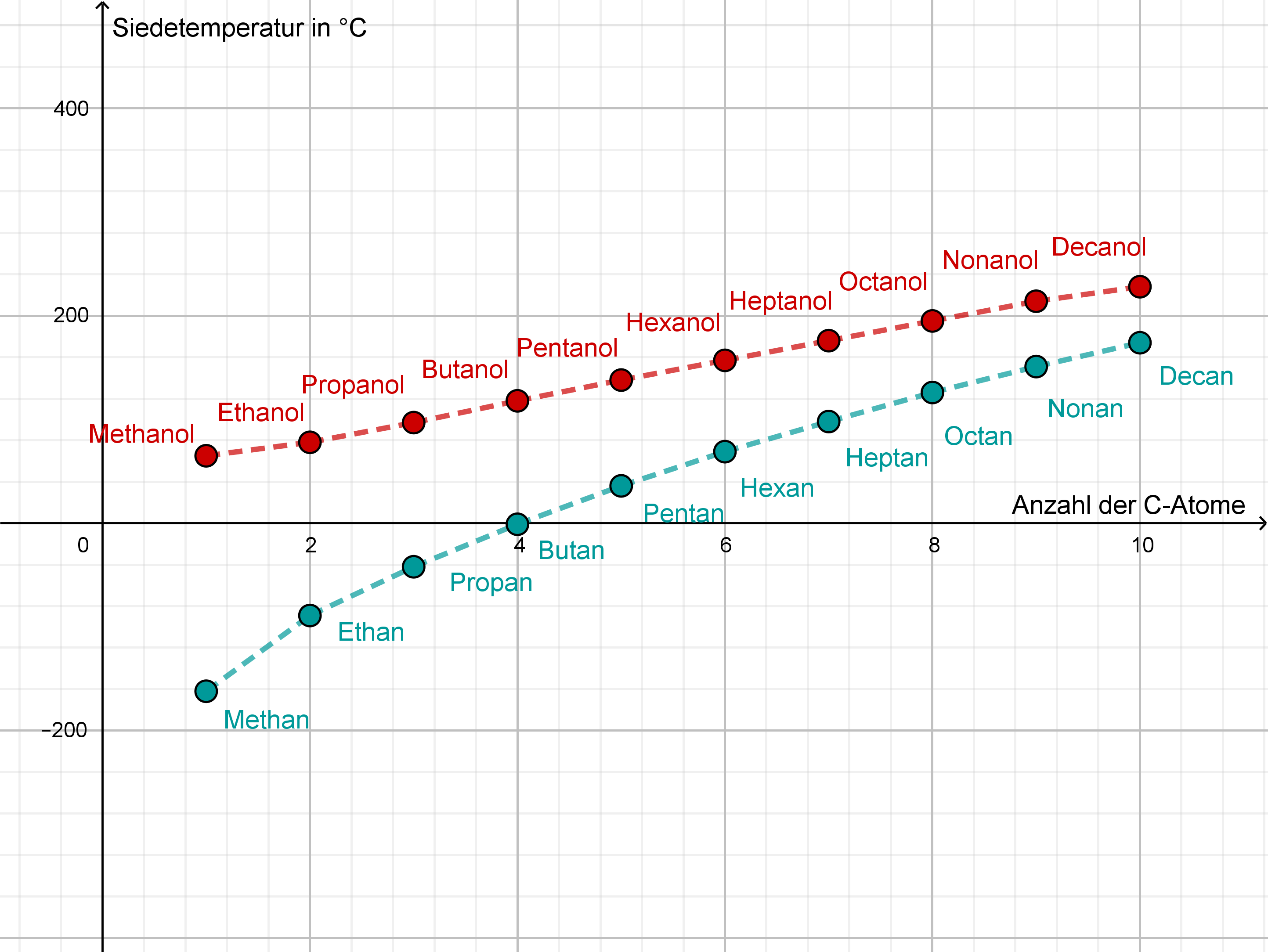
Da Alkohole Wasserstoffbrückenbindungen ausbilden, benötigen sie deutlich mehr Energie, um vom flüssigen in den gasförmigen Zustand überzugehen. Man muss sozusagen die "Klettverschlüsse" zwischen den Molekülen aufbrechen. Alkane hingegen, die nur durch schwache Van-der-Waals-Kräfte zusammengehalten werden, lassen sich leichter in den gasförmigen Zustand überführen. Deshalb haben Alkohole höhere Siedetemperaturen als Alkane mit vergleichbarer Molekülmasse.
Konkretes Beispiel: Ethanol (C2H5OH) hat eine Siedetemperatur von 78,37 °C, während Butan (C4H10), ein Alkan mit einer ähnlichen Molekülmasse, eine Siedetemperatur von -0,5 °C hat. Der Unterschied ist enorm!
Zusammenfassend:
- Alkohole besitzen eine OH-Gruppe, die Wasserstoffbrückenbindungen ermöglicht.
- Alkane besitzen keine OH-Gruppe und werden durch schwache Van-der-Waals-Kräfte zusammengehalten.
- Wasserstoffbrückenbindungen sind stärkere intermolekulare Kräfte als Van-der-Waals-Kräfte.
- Je stärker die intermolekularen Kräfte, desto höher die Siedetemperatur.
Was bedeutet das für euren Aufenthalt?
Auch wenn ihr vielleicht nicht vorhabt, Alkohole und Alkane im Labor zu erhitzen, hat dieses Wissen durchaus praktische Relevanz für euren Aufenthalt. Zum Beispiel erklärt es, warum Desinfektionsmittel, die oft auf Alkoholbasis sind, schnell verdunsten (Alkohol hat eine relativ niedrige Siedetemperatur, obwohl sie höher ist als bei Alkanen). Es erklärt auch, warum bestimmte Lösungsmittel (oft Alkane) leicht entflammbar sind – ihre niedrige Siedetemperatur bedeutet, dass sie leicht verdampfen und mit Luft ein entzündliches Gemisch bilden können.
Und natürlich, wenn ihr euch in einem Weinanbaugebiet befindet, könnt ihr eure neu gewonnenen Kenntnisse über Wasserstoffbrückenbindungen und Siedetemperaturen nutzen, um eurem Sommelier-Gespräch eine wissenschaftliche Note zu verleihen. Prost!
Ich hoffe, diese Erklärung hat euch geholfen, das Phänomen der unterschiedlichen Siedetemperaturen von Alkoholen und Alkanen besser zu verstehen. Genießt eure Reise und entdeckt die Welt mit offenen Augen (und einem kleinen bisschen Chemie-Wissen im Gepäck)!






![Warum Haben Alkohole Eine Höhere Siedetemperatur Als Alkane Homologe Reihe • einfach erklärt, Überblick · [mit Video]](https://blog.assets.studyflix.de/wp-content/uploads/2021/12/02_homologe-Reihe-der-Alkohole-2-1024x576.jpg)