Warum Haben Salze Eine Hohe Schmelztemperatur
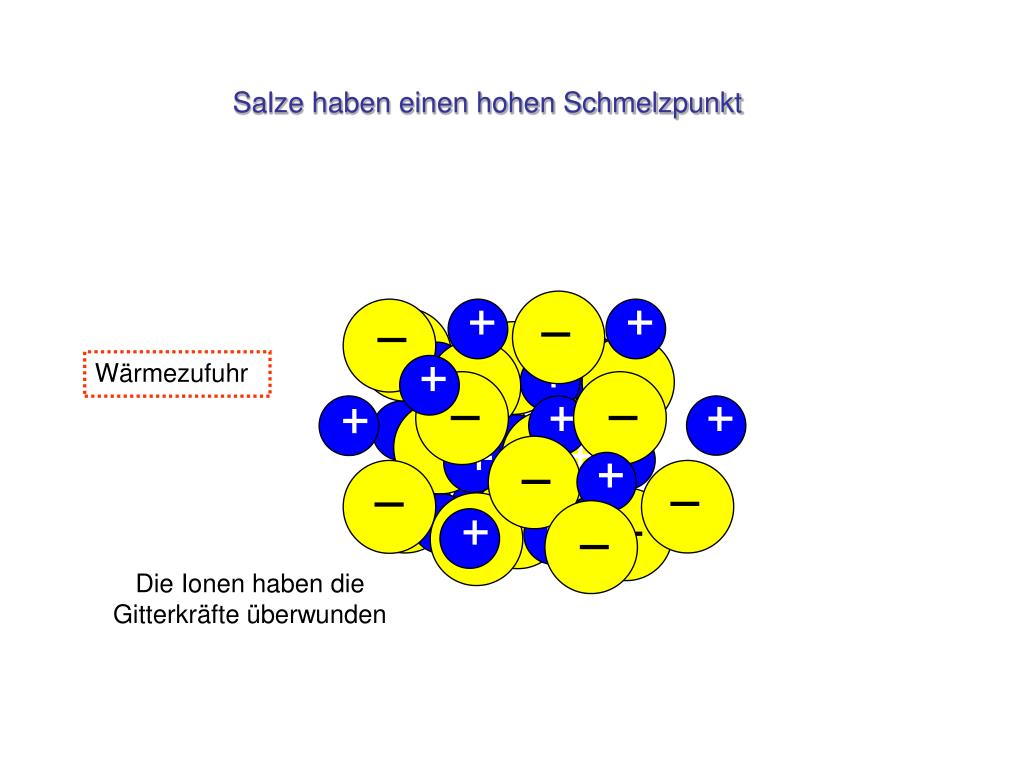
Salze sind allgegenwärtig in unserem Leben, vom Speisesalz, das wir täglich verwenden, bis hin zu den Mineralien, aus denen Gesteine bestehen. Ein charakteristisches Merkmal vieler Salze ist ihre relativ hohe Schmelztemperatur. Das bedeutet, dass eine beträchtliche Menge an Energie benötigt wird, um sie von einem festen Zustand in einen flüssigen Zustand zu überführen. Dieser Artikel erklärt die Gründe für diese hohe Schmelztemperatur auf einfache und verständliche Weise.
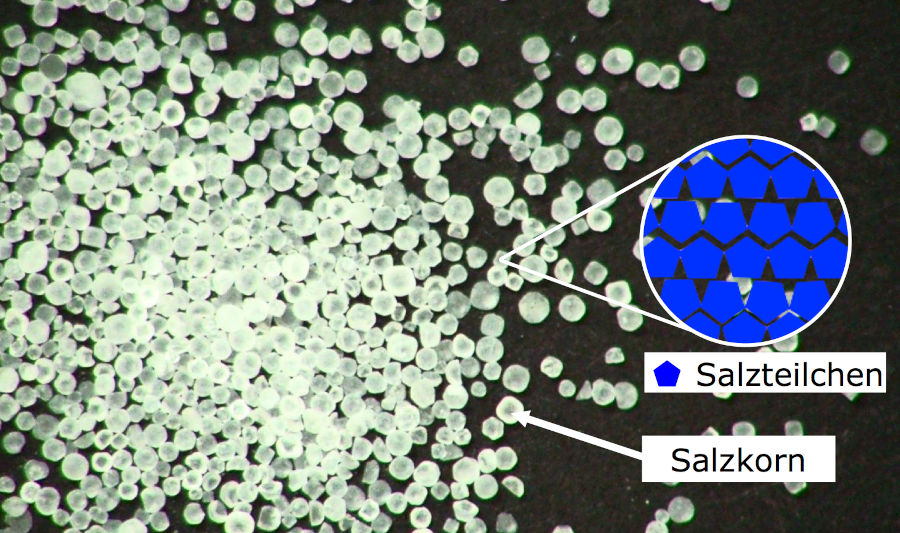
Was sind Salze?
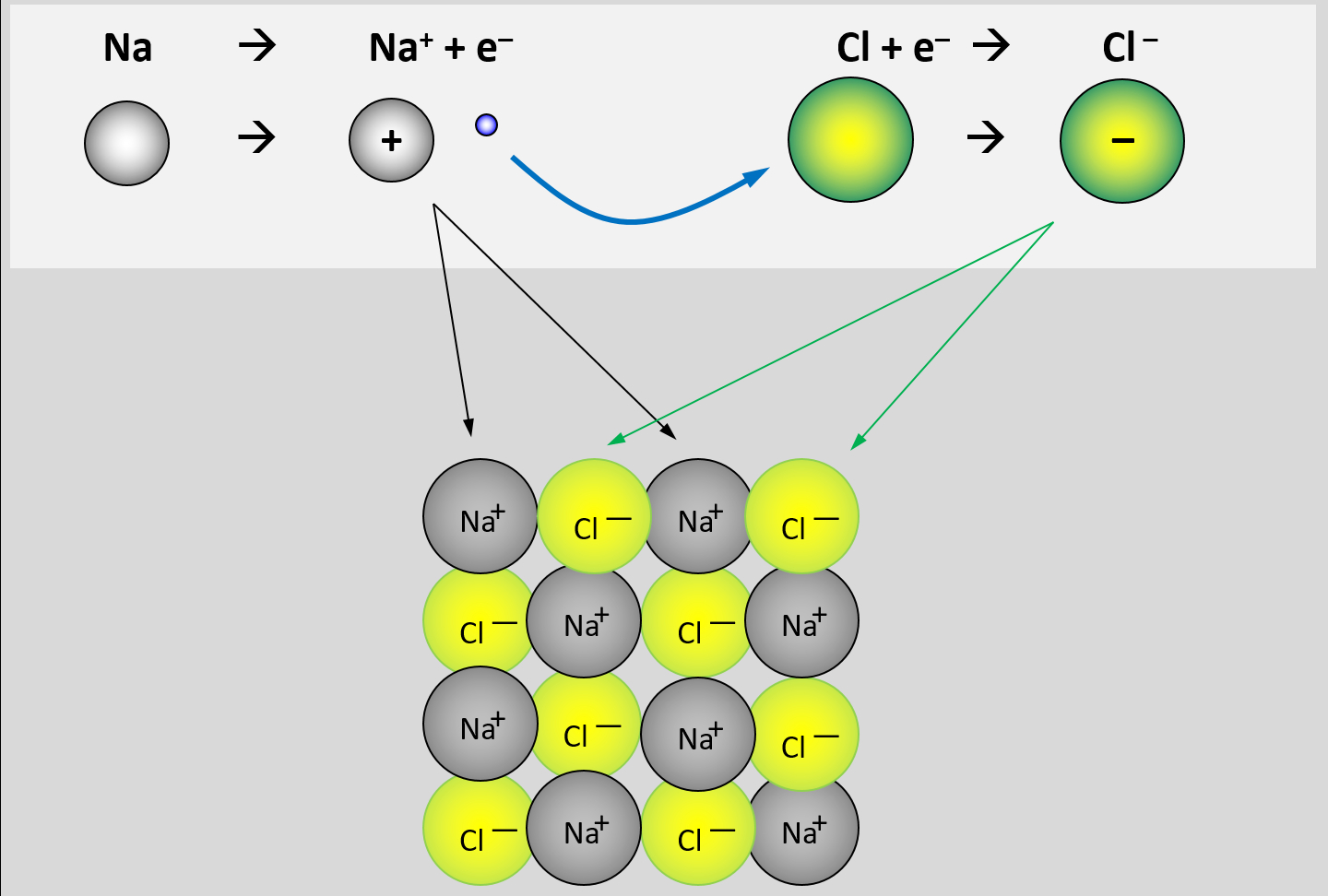
Bevor wir uns den Gründen für die hohen Schmelzpunkte zuwenden, ist es wichtig zu verstehen, was Salze eigentlich sind. Im chemischen Sinne sind Salze ionische Verbindungen, die aus der Reaktion zwischen einer Säure und einer Base entstehen. Dabei tauschen die Säure und die Base Ionen aus, was zur Bildung eines Salzes und Wasser führt. Ein bekanntes Beispiel ist die Reaktion von Salzsäure (HCl) mit Natronlauge (NaOH), die zu Natriumchlorid (NaCl), also Kochsalz, und Wasser (H2O) führt.
Ionen sind Atome oder Moleküle, die eine elektrische Ladung tragen. Es gibt zwei Arten von Ionen:
- Kationen: Positiv geladene Ionen, die entstehen, wenn ein Atom Elektronen abgibt.
- Anionen: Negativ geladene Ionen, die entstehen, wenn ein Atom Elektronen aufnimmt.
Salze bestehen aus einem Gitterwerk von positiv geladenen Kationen und negativ geladenen Anionen, die durch starke elektrostatische Kräfte zusammengehalten werden. Diese Anordnung wird als Ionengitter bezeichnet.
Die Stärke der Ionenbindung
Der Hauptgrund für die hohen Schmelzpunkte von Salzen liegt in der Stärke der Ionenbindung, die die Ionen im Kristallgitter zusammenhält. Diese Bindung ist eine elektrostatische Anziehungskraft zwischen den entgegengesetzt geladenen Ionen. Je stärker diese Anziehungskraft ist, desto mehr Energie ist erforderlich, um die Ionen voneinander zu trennen und das Salz zu schmelzen.
Die Stärke der Ionenbindung hängt von zwei Hauptfaktoren ab:
- Ladung der Ionen: Je höher die Ladung der Ionen, desto stärker ist die elektrostatische Anziehungskraft zwischen ihnen. Zum Beispiel hat Magnesiumoxid (MgO), das aus Mg2+- und O2--Ionen besteht, eine viel höhere Schmelztemperatur als Natriumchlorid (NaCl), das aus Na+- und Cl--Ionen besteht.
- Ionengröße: Je kleiner die Ionen, desto näher können sie sich kommen, und desto stärker ist die elektrostatische Anziehungskraft. Ein kleineres Ion erzeugt ein stärkeres elektrisches Feld um sich herum.
Diese beiden Faktoren werden im Coulomb'schen Gesetz zusammengefasst, welches die elektrostatische Kraft zwischen zwei geladenen Teilchen beschreibt:
F = k * (q1 * q2) / r2
Dabei ist:
- F die elektrostatische Kraft
- k eine Konstante (Coulomb-Konstante)
- q1 und q2 die Ladungen der Ionen
- r der Abstand zwischen den Ionen
Dieses Gesetz zeigt, dass die Kraft (und damit die Stärke der Ionenbindung) direkt proportional zu den Ladungen der Ionen und umgekehrt proportional zum Quadrat des Abstands zwischen ihnen ist.
Die Struktur des Ionengitters
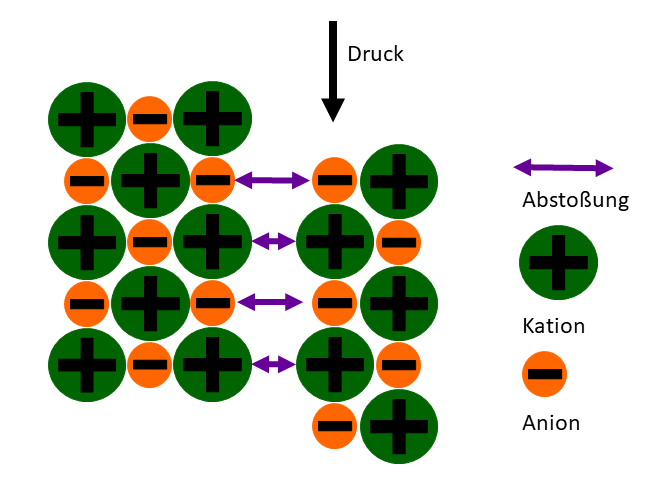
Die räumliche Anordnung der Ionen im Ionengitter spielt ebenfalls eine wichtige Rolle. In einem Kristallgitter sind die Ionen in einer regelmäßigen, sich wiederholenden Struktur angeordnet. Diese Struktur maximiert die Anziehungskräfte zwischen entgegengesetzt geladenen Ionen und minimiert die Abstoßungskräfte zwischen gleich geladenen Ionen.
Um ein Salz zu schmelzen, muss diese geordnete Struktur aufgebrochen werden. Das bedeutet, dass die Ionen genügend Energie erhalten müssen, um sich aus ihren festen Positionen im Gitter zu lösen und sich frei bewegen zu können. Dies erfordert eine erhebliche Menge an Energie, da die elektrostatischen Kräfte, die die Ionen zusammenhalten, sehr stark sind. Die Gitterenergie ist ein Maß für die Stärke der elektrostatischen Anziehungskräfte im Ionengitter. Je höher die Gitterenergie, desto höher ist die Schmelztemperatur.
Vergleich mit anderen Bindungsarten
Um die Bedeutung der Ionenbindung für die hohen Schmelztemperaturen von Salzen besser zu verstehen, ist es hilfreich, sie mit anderen Arten von chemischen Bindungen zu vergleichen:
- Kovalente Bindungen: Diese Bindungen entstehen durch das Teilen von Elektronen zwischen Atomen. Stoffe mit kovalenten Bindungen haben im Allgemeinen niedrigere Schmelz- und Siedepunkte als Salze, da die intermolekularen Kräfte (z. B. Van-der-Waals-Kräfte) zwischen den Molekülen schwächer sind als die elektrostatischen Kräfte zwischen Ionen. Beispiele hierfür sind Wasser (H2O) und Methan (CH4).
- Metallische Bindungen: Diese Bindungen entstehen durch die Anziehung zwischen positiv geladenen Metallionen und einem "Elektronengas" von delokalisierten Elektronen. Metalle haben in der Regel hohe Schmelzpunkte, aber nicht so hoch wie viele Salze mit hochgeladenen Ionen. Die Schmelzpunkte von Metallen sind stark vom jeweiligen Metall und seiner elektronischen Struktur abhängig.
Die Polarität der Bindungen spielt ebenfalls eine Rolle. Während kovalente Bindungen Elektronen teilen, können sie dies ungleichmäßig tun, was zu polaren kovalenten Bindungen führt. Stoffe mit polaren kovalenten Bindungen haben oft höhere Schmelz- und Siedepunkte als Stoffe mit unpolaren kovalenten Bindungen, aber immer noch niedriger als Salze.
Beispiele und Anwendungen
Einige Beispiele veranschaulichen den Einfluss der Ionenladung und -größe auf die Schmelztemperatur:
- Natriumchlorid (NaCl): Schmelzpunkt 801 °C. Besteht aus einfach geladenen Na+- und Cl--Ionen.
- Magnesiumoxid (MgO): Schmelzpunkt 2852 °C. Besteht aus zweifach geladenen Mg2+- und O2--Ionen. Die höheren Ladungen führen zu einer deutlich höheren Schmelztemperatur.
- Lithiumfluorid (LiF): Schmelzpunkt 845 °C. Sowohl Lithium als auch Fluor sind relativ kleine Ionen, was zu einer stärkeren elektrostatischen Anziehungskraft führt.
- Caesiumiodid (CsI): Schmelzpunkt 621 °C. Caesium und Iod sind relativ große Ionen, was die elektrostatische Anziehungskraft verringert und zu einer niedrigeren Schmelztemperatur führt.
Die hohen Schmelztemperaturen von Salzen haben wichtige praktische Anwendungen. Beispielsweise werden einige Salze als Hochtemperatur-Wärmeträger in Solarkraftwerken eingesetzt. Sie können Wärmeenergie speichern und bei hohen Temperaturen freisetzen, was die Effizienz der Energieerzeugung erhöht.
Darüber hinaus werden Salze in der Keramikherstellung verwendet. Durch das Erhitzen von Keramikrohstoffen mit Salzen können bestimmte Eigenschaften der Keramik verändert werden, wie z. B. die Härte oder die elektrische Leitfähigkeit. Die hohen Temperaturen, die erforderlich sind, um die Salze zu schmelzen und mit den Keramikrohstoffen zu vermischen, sind ein wichtiger Bestandteil dieses Prozesses.
Zusammenfassung
Zusammenfassend lässt sich sagen, dass die hohen Schmelztemperaturen von Salzen auf die starken elektrostatischen Anziehungskräfte zwischen den entgegengesetzt geladenen Ionen im Ionengitter zurückzuführen sind. Die Stärke dieser Anziehungskräfte hängt von der Ladung und der Größe der Ionen ab. Je höher die Ladung und je kleiner die Ionen, desto stärker ist die Ionenbindung und desto höher ist die Schmelztemperatur. Die räumliche Anordnung der Ionen im Kristallgitter trägt ebenfalls zur Stabilität des Salzes bei. Diese Eigenschaften machen Salze zu wichtigen Materialien mit vielfältigen Anwendungen, die von der Lebensmittelindustrie bis zur Energietechnik reichen.
Das Verständnis der Gründe für die hohen Schmelztemperaturen von Salzen ermöglicht es uns, ihre Eigenschaften besser zu nutzen und neue Anwendungen für diese vielseitigen Verbindungen zu entwickeln.











![Warum Haben Salze Eine Hohe Schmelztemperatur Salze • einfach erklärt: Eigenschaften, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/09/WP_Natriumchlorid-Gitter-1-1024x576.jpg)

![Warum Haben Salze Eine Hohe Schmelztemperatur Salze Eigenschaften│Chemie Lernvideo [Learning Level Up] - YouTube](https://i.ytimg.com/vi/VCHgiT5bQkw/maxresdefault.jpg)
