Warum Leitet Salzsäure Den Elektrischen Strom
Viele Neuankömmlinge in Deutschland, insbesondere solche mit naturwissenschaftlichem oder technischem Hintergrund, fragen sich vielleicht, warum Salzsäure (HCl) elektrischen Strom leitet. Dieser Artikel erklärt das Phänomen auf einfache und verständliche Weise, ohne Fachjargon zu verwenden, und soll ein klares Verständnis für die zugrundeliegenden Prinzipien vermitteln.
Was ist Salzsäure?
Salzsäure ist eine wässrige Lösung von Chlorwasserstoff (HCl). Chlorwasserstoff ist ein farbloses, stechend riechendes Gas. Wenn dieses Gas in Wasser gelöst wird, entsteht Salzsäure. Die Konzentration von Salzsäure wird üblicherweise in Prozent oder Molarität (mol/L) angegeben. Konzentrierte Salzsäure kann sehr ätzend sein und muss mit Vorsicht behandelt werden.
Elektrische Leitfähigkeit: Grundlagen
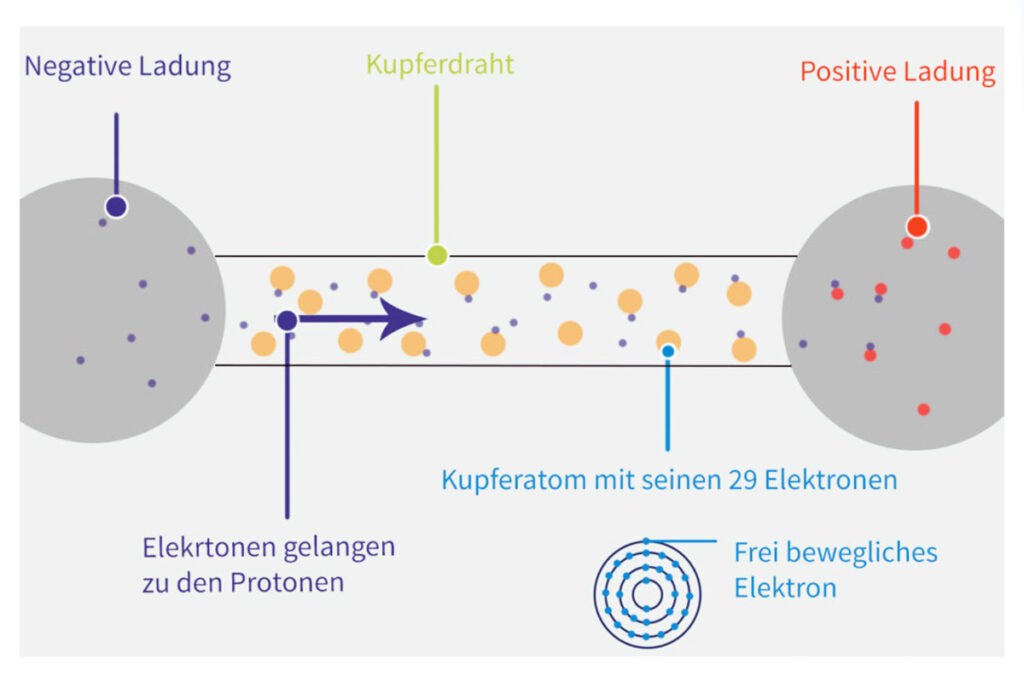
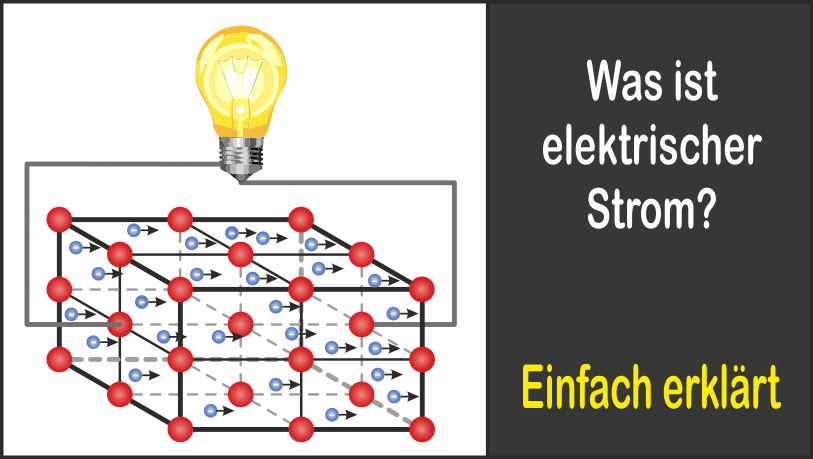
Um zu verstehen, warum Salzsäure Strom leitet, müssen wir zunächst die Grundlagen der elektrischen Leitfähigkeit verstehen. Elektrischer Strom ist der Fluss von elektrisch geladenen Teilchen. In Metallen sind diese Teilchen Elektronen, die sich frei durch das Metallgitter bewegen können. Damit eine Substanz elektrischen Strom leiten kann, benötigt sie also frei bewegliche, geladene Teilchen.
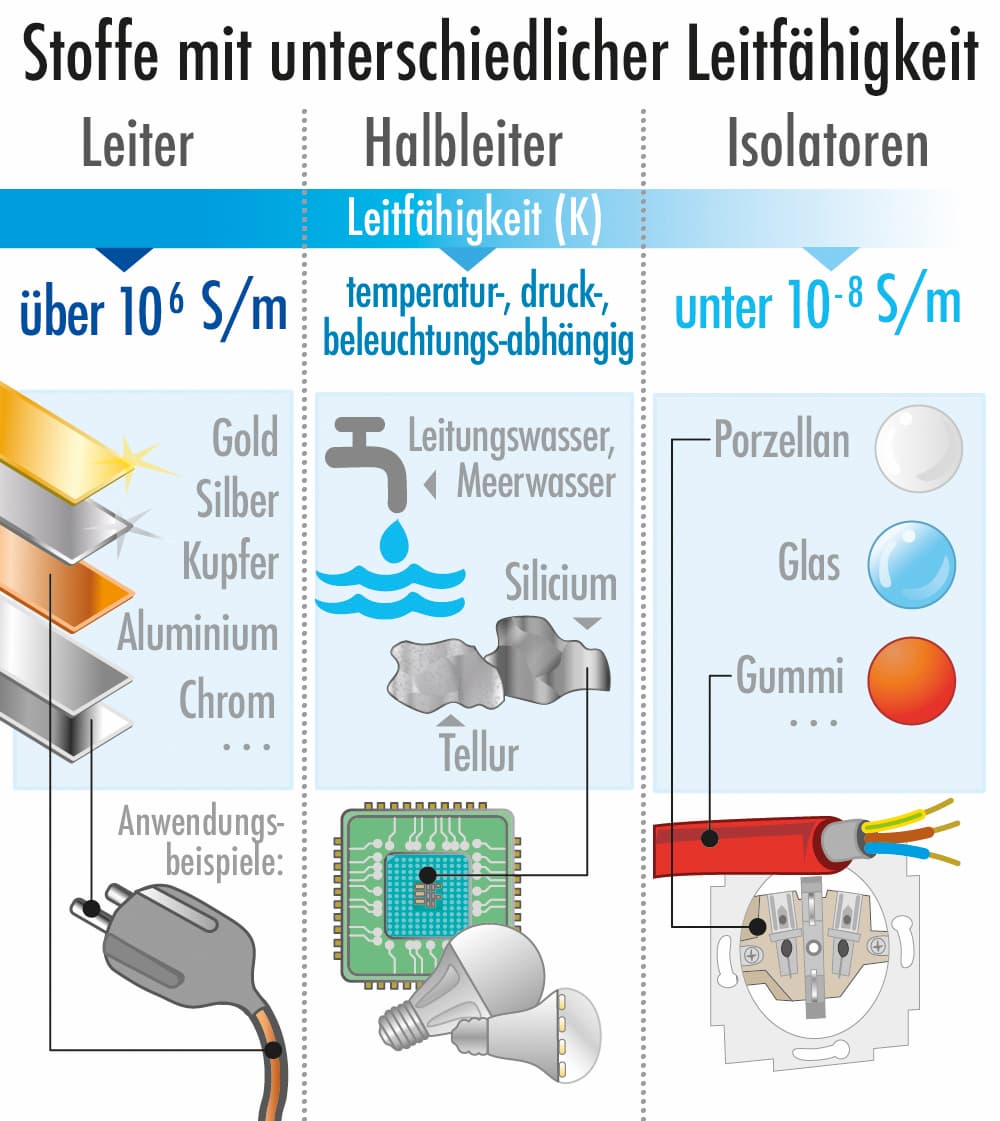
Isolatoren, Halbleiter und Leiter
Stoffe lassen sich anhand ihrer elektrischen Leitfähigkeit in drei Kategorien einteilen:
- Isolatoren: Diese Stoffe leiten keinen oder kaum elektrischen Strom. Beispiele sind Glas, Gummi und Kunststoffe. Sie haben keine frei beweglichen Ladungsträger.
- Halbleiter: Diese Stoffe leiten elektrischen Strom unter bestimmten Bedingungen. Ihre Leitfähigkeit kann durch äußere Einflüsse wie Temperatur oder Lichteinfall beeinflusst werden. Beispiele sind Silizium und Germanium.
- Leiter: Diese Stoffe leiten elektrischen Strom sehr gut. Beispiele sind Metalle wie Kupfer, Silber und Gold. Sie haben viele frei bewegliche Ladungsträger.
Warum reines Wasser keinen Strom leitet
Reines Wasser (H2O) ist ein sehr schlechter elektrischer Leiter. Obwohl Wasser aus Wasserstoff- und Sauerstoffatomen besteht, die Elektronen besitzen, sind diese Elektronen fest an die Atome gebunden und können sich nicht frei bewegen. Reines Wasser dissoziiert (zerfällt) nur in sehr geringem Umfang in Ionen (H+ und OH-), was bedeutet, dass es kaum frei bewegliche Ladungsträger gibt.
Die Rolle von Ionen bei der elektrischen Leitfähigkeit
Die elektrische Leitfähigkeit von Lösungen hängt von der Anwesenheit von Ionen ab. Ionen sind Atome oder Moleküle, die eine elektrische Ladung tragen. Es gibt zwei Arten von Ionen:
- Kationen: Positiv geladene Ionen (z.B. H+, Na+).
- Anionen: Negativ geladene Ionen (z.B. Cl-, OH-).
Wenn eine Substanz in Wasser gelöst wird und Ionen freisetzt, wird die Lösung elektrisch leitfähig. Diese Leitfähigkeit wird als ionische Leitfähigkeit bezeichnet.
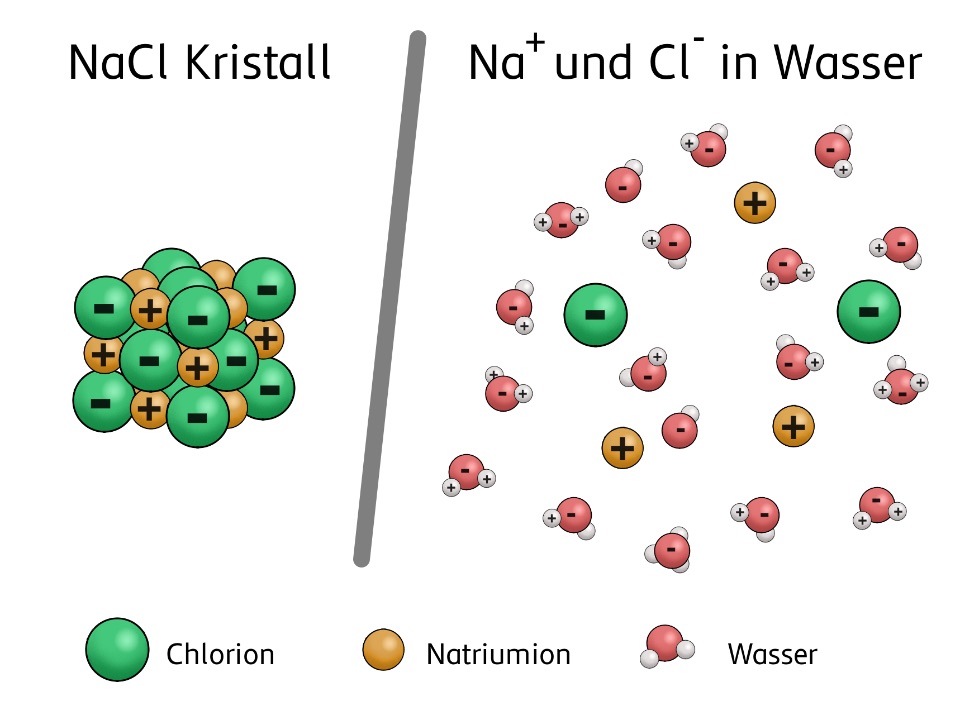
Salzsäure und Ionisierung
Wenn Chlorwasserstoff (HCl) in Wasser gelöst wird, ionisert er. Das bedeutet, dass sich die HCl-Moleküle in Wasser in Ionen aufspalten:
HCl (g) + H2O (l) → H3O+ (aq) + Cl- (aq)
Dabei entsteht:
- Hydronium-Ionen (H3O+): Ein Proton (H+) bindet sich an ein Wassermolekül (H2O) und bildet ein Hydronium-Ion.
- Chlorid-Ionen (Cl-): Das Chloratom nimmt ein Elektron auf und wird zu einem negativ geladenen Chlorid-Ion.
Diese Hydronium- und Chlorid-Ionen sind frei beweglich in der Lösung. Sie sind die Ladungsträger, die den elektrischen Strom in der Salzsäure leiten. Je höher die Konzentration der Salzsäure, desto mehr Ionen sind in der Lösung vorhanden, und desto besser leitet sie den elektrischen Strom.
Der Mechanismus der Stromleitung in Salzsäure
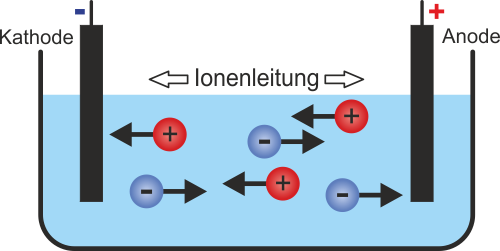
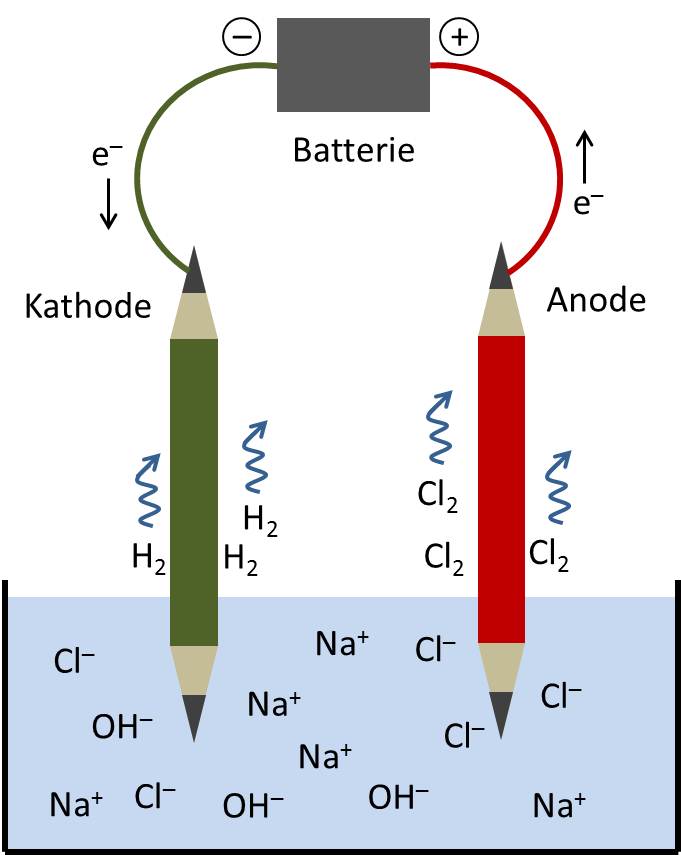
Wenn eine Spannung an eine Salzsäurelösung angelegt wird, bewegen sich die Ionen in Richtung der Elektroden mit entgegengesetzter Ladung:
- Die Hydronium-Ionen (H3O+) bewegen sich zur negativen Elektrode (Kathode). Dort nehmen sie Elektronen auf und werden zu Wasserstoffgas und Wasser:
2H3O+ + 2e- → H2 (g) + 2H2O (l)
- Die Chlorid-Ionen (Cl-) bewegen sich zur positiven Elektrode (Anode). Dort geben sie Elektronen ab und werden zu Chlorgas:
2Cl- → Cl2 (g) + 2e-
Dieser Fluss von Ionen von einer Elektrode zur anderen erzeugt einen elektrischen Strom. Die Gesamtreaktion ist die Elektrolyse von Salzsäure, bei der Wasserstoff- und Chlorgas entstehen.
Faktoren, die die Leitfähigkeit von Salzsäure beeinflussen
Die elektrische Leitfähigkeit von Salzsäure hängt von verschiedenen Faktoren ab:
- Konzentration: Je höher die Konzentration der Salzsäure, desto mehr Ionen sind vorhanden und desto besser ist die Leitfähigkeit.
- Temperatur: Die Leitfähigkeit nimmt mit steigender Temperatur zu, da die Ionen sich schneller bewegen können.
- Art der Säure: Starke Säuren wie Salzsäure dissoziieren vollständig in Wasser und erzeugen mehr Ionen als schwache Säuren. Daher leiten starke Säuren den Strom besser.
Sicherheitshinweise
Salzsäure ist eine ätzende Substanz und sollte mit Vorsicht behandelt werden. Beim Umgang mit Salzsäure sollten immer Schutzhandschuhe, Schutzbrille und Schutzkleidung getragen werden. Die Dämpfe von Salzsäure sind reizend für die Atemwege. Bei Kontakt mit der Haut oder den Augen sofort mit viel Wasser spülen und einen Arzt aufsuchen.
Zusammenfassung
Salzsäure leitet elektrischen Strom, weil sie in Wasser in Hydronium-Ionen (H3O+) und Chlorid-Ionen (Cl-) dissoziiert. Diese Ionen sind frei bewegliche Ladungsträger, die den elektrischen Strom zwischen den Elektroden transportieren. Die Leitfähigkeit der Salzsäure hängt von der Konzentration, der Temperatur und der Art der Säure ab. Aufgrund ihrer ätzenden Eigenschaften ist beim Umgang mit Salzsäure Vorsicht geboten und entsprechende Schutzkleidung ist zu tragen.



![Warum Leitet Salzsäure Den Elektrischen Strom Elektrische Leitfähigkeit · Formel, Einheit, Tabelle · [mit Video]](https://assets.studyflix.de/storage/blobs/proxy/eyJfcmFpbHMiOnsiZGF0YSI6NzU4MzMsInB1ciI6ImJsb2JfaWQifX0=--b8386dd9665b67e8daf2da4c2b99e9c22444ea16/Elektrische_Leitfähigkeit_Thumbnail.png)