Was Bedeutet Polar Und Unpolar

Viele Prozesse in Chemie und Biologie hängen davon ab, wie gut sich verschiedene Stoffe miteinander mischen. Ob sich zwei Stoffe mischen lassen oder nicht, wird oft durch ihre Polarität bestimmt. Die Begriffe polar und unpolar beschreiben die Verteilung der elektrischen Ladung innerhalb eines Moleküls. Dieses Konzept ist essentiell, um zu verstehen, wie Substanzen miteinander interagieren und warum bestimmte Stoffe sich in anderen lösen, während andere dies nicht tun.
Grundlagen der Polarität
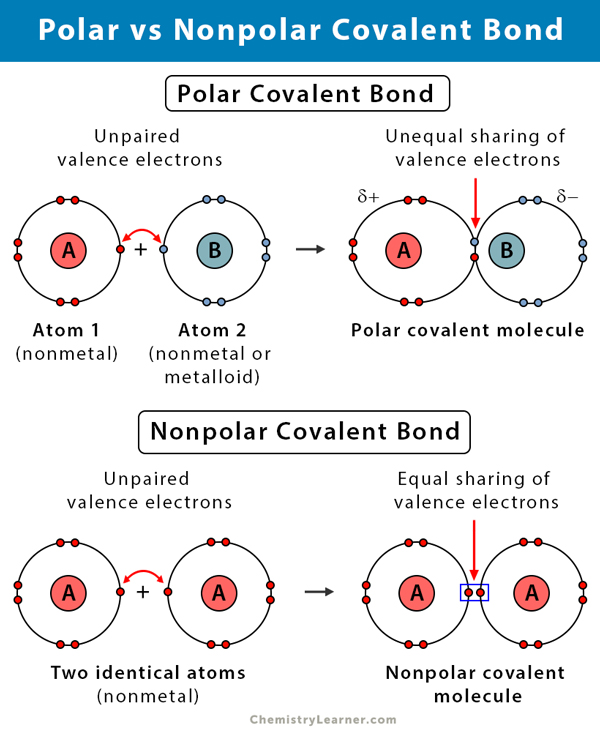
Um Polarität zu verstehen, muss man sich die Struktur von Molekülen ansehen. Moleküle bestehen aus Atomen, die durch chemische Bindungen miteinander verbunden sind. Diese Bindungen entstehen durch die gemeinsame Nutzung von Elektronen. Allerdings teilen sich nicht alle Atome Elektronen gleichmäßig. Die Fähigkeit eines Atoms, Elektronen in einer chemischen Bindung stärker an sich zu ziehen, wird als Elektronegativität bezeichnet.
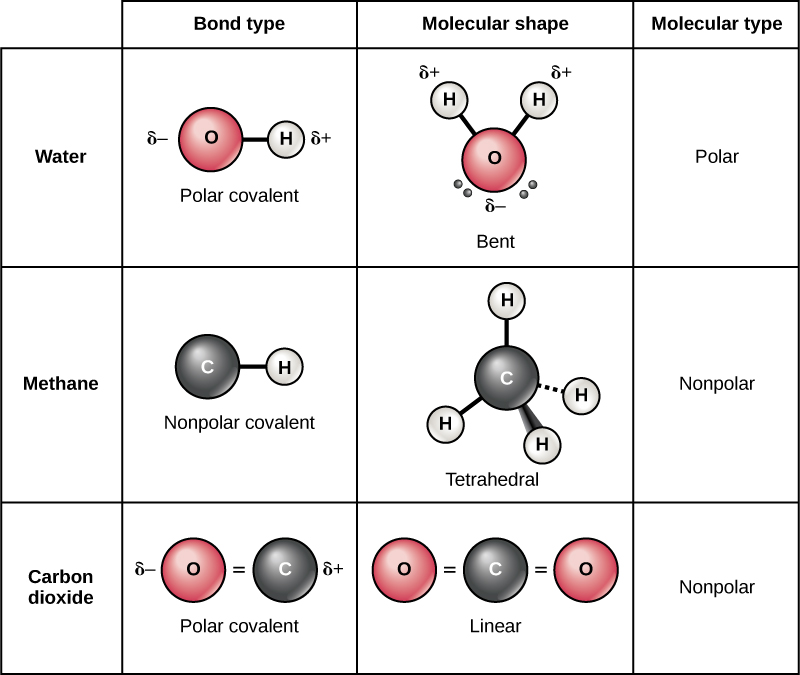
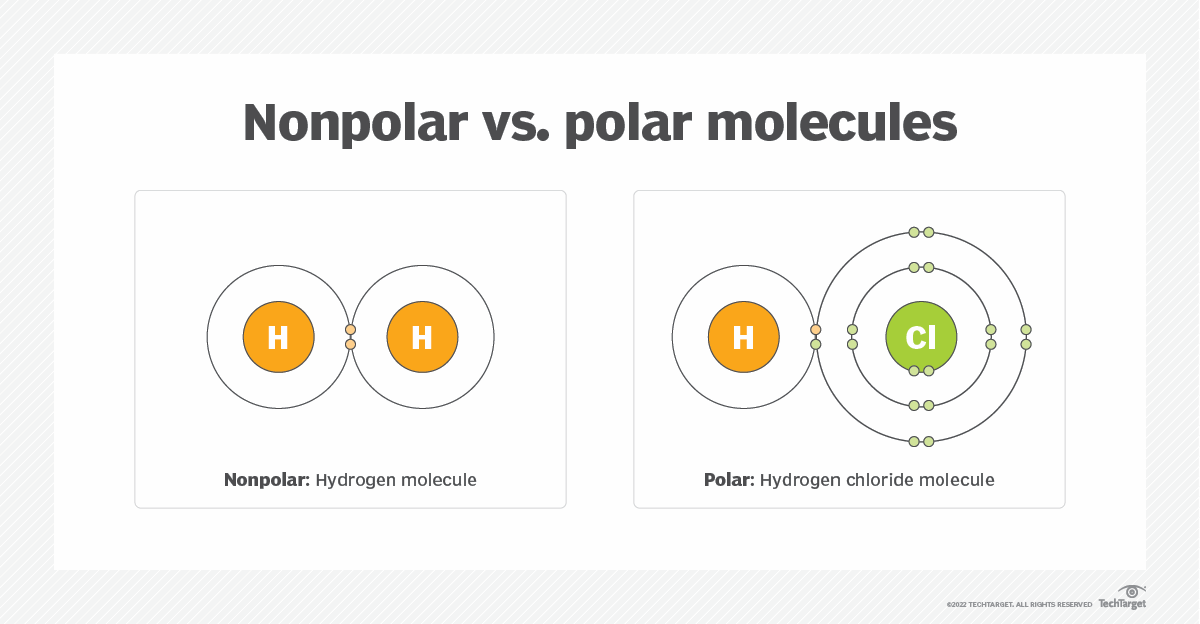
Atome wie Sauerstoff (O), Stickstoff (N) und Fluor (F) sind beispielsweise sehr elektronegativ, während Atome wie Kohlenstoff (C) und Wasserstoff (H) eine geringere Elektronegativität haben. Wenn zwei Atome mit unterschiedlicher Elektronegativität eine Bindung eingehen, werden die Elektronen ungleichmäßig verteilt. Das elektronegativere Atom zieht die Elektronen stärker an, wodurch es eine leicht negative Teilladung (δ-) erhält. Das weniger elektronegative Atom erhält eine leicht positive Teilladung (δ+). Diese ungleiche Ladungsverteilung führt zu einer polaren Bindung.
Im Gegensatz dazu spricht man von einer unpolaren Bindung, wenn zwei Atome mit ähnlicher oder gleicher Elektronegativität miteinander verbunden sind. In diesem Fall werden die Elektronen gleichmäßig geteilt, und es entstehen keine Teilladungen. Ein typisches Beispiel ist die Bindung zwischen zwei Kohlenstoffatomen (C-C) oder zwischen Kohlenstoff und Wasserstoff (C-H), da die Elektronegativitätsunterschiede gering sind.
Polarität von Molekülen
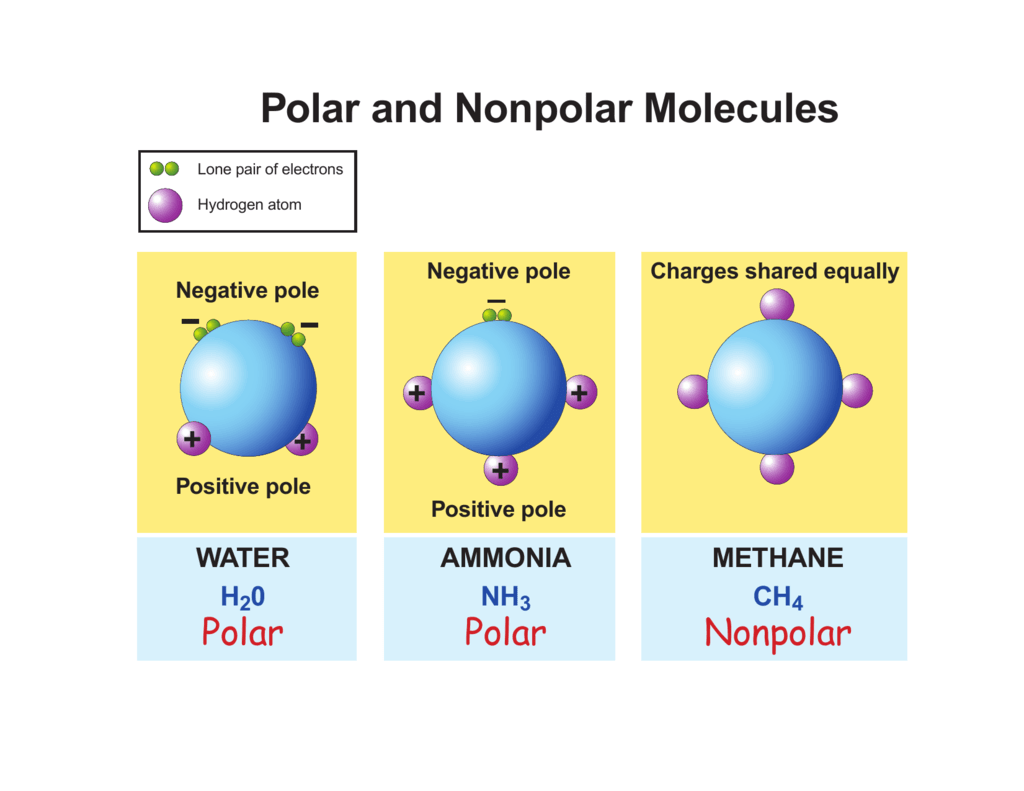
Die Polarität eines gesamten Moleküls hängt nicht nur von der Polarität der einzelnen Bindungen ab, sondern auch von der Geometrie des Moleküls. Ein Molekül kann polare Bindungen enthalten, aber dennoch unpolar sein, wenn die Dipolmomente (die Vektoren, die die Richtung und Stärke der Polarität darstellen) sich gegenseitig aufheben.
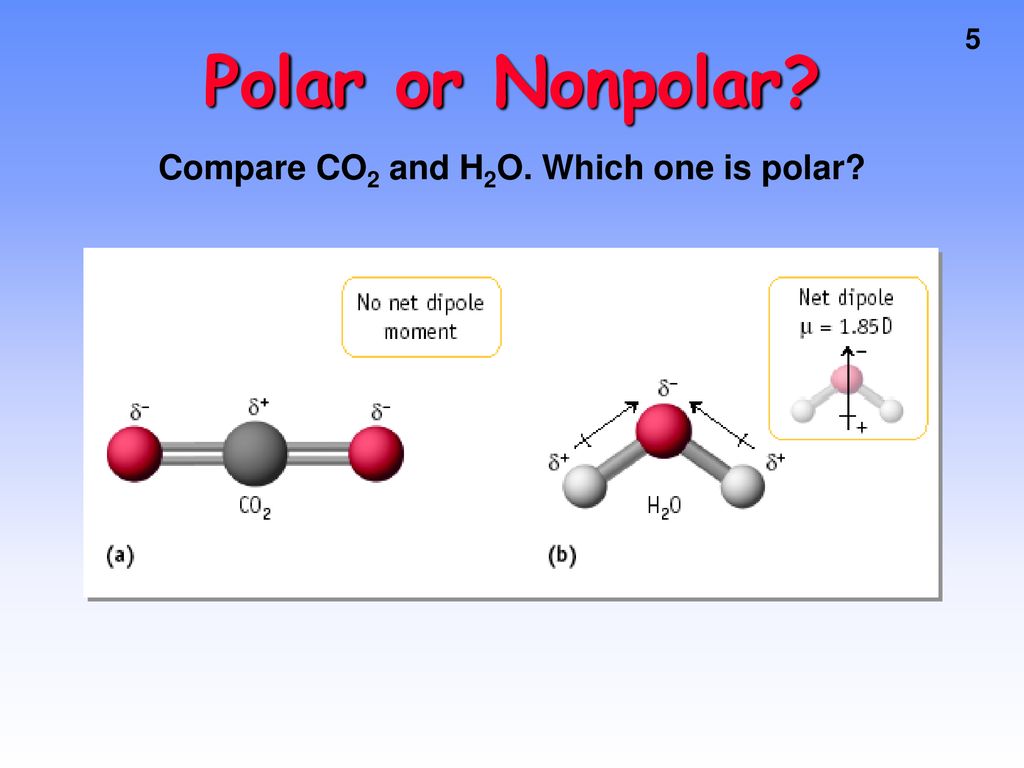
Beispiel: Kohlenstoffdioxid (CO2)
CO2 hat zwei polarte C=O-Bindungen. Sauerstoff ist elektronegativer als Kohlenstoff, zieht also die Elektronen an sich. Das Molekül ist aber linear aufgebaut. Dadurch wirken die Dipolmomente der beiden C=O-Bindungen in entgegengesetzte Richtungen und heben sich gegenseitig auf. Das Ergebnis ist ein unpolares Molekül.
Beispiel: Wasser (H2O)
Wasser hat zwei polare O-H-Bindungen. Sauerstoff ist elektronegativer als Wasserstoff. Im Gegensatz zu CO2 ist das Wassermolekül gewinkelt und nicht linear. Dadurch heben sich die Dipolmomente der O-H-Bindungen nicht vollständig auf, sondern verstärken sich teilweise. Das Ergebnis ist ein polares Molekül mit einem deutlichen Dipolmoment.
"Gleiches löst Gleiches" – Die Löslichkeit
Die Polarität spielt eine entscheidende Rolle bei der Löslichkeit von Stoffen. Ein grundlegendes Prinzip lautet: "Gleiches löst Gleiches" ("Similia similibus solvuntur" auf Lateinisch). Das bedeutet, dass polare Stoffe sich gut in polaren Lösungsmitteln lösen, während unpolare Stoffe sich gut in unpolaren Lösungsmitteln lösen.
Warum ist das so?
Die intermolekularen Kräfte spielen hierbei eine wichtige Rolle. Polare Moleküle ziehen sich durch Dipol-Dipol-Kräfte oder Wasserstoffbrückenbindungen gegenseitig an. Wenn ein polarer Stoff in einem polaren Lösungsmittel gelöst wird, können die Lösungsmittelmoleküle diese intermolekularen Kräfte überwinden und stattdessen mit den Molekülen des gelösten Stoffes interagieren. Die resultierenden Wechselwirkungen zwischen Lösungsmittel und gelöstem Stoff sind energetisch günstig, was zur Lösung führt.
Unpolare Moleküle interagieren hauptsächlich durch Van-der-Waals-Kräfte, schwache, kurzreichweitige Anziehungskräfte. Wenn ein unpolarer Stoff in einem unpolaren Lösungsmittel gelöst wird, sind die Van-der-Waals-Kräfte zwischen den Molekülen des gelösten Stoffes und den Molekülen des Lösungsmittels ähnlich stark wie die ursprünglichen Wechselwirkungen. Dadurch wird die Lösung des Stoffes begünstigt.
Beispiele:
- Wasser (polar) und Salz (polar): Salz (Natriumchlorid, NaCl) ist eine ionische Verbindung und somit sehr polar. Es löst sich gut in Wasser, weil die Wassermoleküle die Ionen (Na+ und Cl-) umhüllen und stabilisieren.
- Wasser (polar) und Öl (unpolar): Öl besteht hauptsächlich aus unpolaren Kohlenwasserstoffen. Es löst sich nicht in Wasser, da die Wassermoleküle stärkere Anziehungskräfte zueinander haben als zu den Ölmolekülen.
- Benzin (unpolar) und Fett (unpolar): Benzin ist ein unpolares Lösungsmittel und löst Fette (die ebenfalls unpolar sind) gut auf.
Bedeutung der Polarität in verschiedenen Bereichen
Die Polarität ist ein grundlegendes Konzept mit weitreichenden Auswirkungen in verschiedenen Bereichen:
- Chemie: Die Polarität beeinflusst die Reaktionsfähigkeit von Molekülen, die Art der chemischen Reaktionen und die Selektivität von Katalysatoren.
- Biologie: Die Polarität ist entscheidend für die Struktur und Funktion von Biomolekülen wie Proteinen, DNA und Lipiden. Die Wechselwirkungen zwischen polaren und unpolaren Regionen dieser Moleküle bestimmen ihre Faltung, Stabilität und Interaktion mit anderen Molekülen. Zum Beispiel ist die Lipiddoppelschicht einer Zellmembran aufgrund der polaren Köpfe und unpolaren Schwänze der Phospholipide so angeordnet, dass sie eine Barriere für polare Substanzen bildet.
- Pharmazie: Die Polarität eines Medikaments beeinflusst, wie gut es vom Körper aufgenommen, verteilt, metabolisiert und ausgeschieden wird. Medikamente müssen oft sowohl polare als auch unpolare Eigenschaften aufweisen, um durch Zellmembranen zu gelangen und an Zielmoleküle zu binden.
- Umweltwissenschaften: Die Polarität beeinflusst das Verhalten von Schadstoffen in der Umwelt. Beispielsweise können unpolare Schadstoffe wie DDT sich in fettreichem Gewebe von Tieren anreichern (Bioakkumulation).
- Materialwissenschaften: Die Polarität beeinflusst die Oberflächeneigenschaften von Materialien, die Adhäsion von Beschichtungen und die Benetzbarkeit von Oberflächen.
Wie man Polarität bestimmt
Es gibt verschiedene Methoden, um die Polarität einer Substanz zu bestimmen:
- Betrachtung der Molekülstruktur: Analysieren Sie die Bindungen und die Molekülgeometrie. Sind polare Bindungen vorhanden? Heben sich die Dipolmomente auf oder verstärken sie sich?
- Löslichkeitstests: Testen Sie die Löslichkeit in polaren (z.B. Wasser) und unpolaren (z.B. Hexan) Lösungsmitteln.
- Messung des Dipolmoments: Experimentelle Bestimmung des Dipolmoments eines Moleküls. Ein Dipolmoment ungleich Null deutet auf ein polares Molekül hin.
Zusammenfassung
Die Polarität ist ein fundamentales Konzept, das die Wechselwirkungen zwischen Molekülen und die Löslichkeit von Stoffen bestimmt. Das Verständnis von Polarität ist essenziell für viele Bereiche der Naturwissenschaften und Technik. Merken Sie sich:"Gleiches löst Gleiches." Polare Stoffe lösen sich gut in polaren Lösungsmitteln, unpolare Stoffe in unpolaren Lösungsmitteln. Die Molekülstruktur und Elektronegativitätsdifferenzen bestimmen die Polarität eines Moleküls und beeinflussen seine Eigenschaften und sein Verhalten.



![Was Bedeutet Polar Und Unpolar Polarität • polar und unpolar, Polarität Chemie · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/05/Polarität_WP_2_wasser-1-1024x576.jpg)




![Was Bedeutet Polar Und Unpolar Polarität • polar und unpolar, Polarität Chemie · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/05/Polarität_WP_1-2-1024x576.jpg)

![Was Bedeutet Polar Und Unpolar Polar vs Nonpolar molecules: How to tell? [GCE A Level Chemistry] - YouTube](https://i.ytimg.com/vi/WkiA4Du-5oE/maxresdefault.jpg)