Was Gibt Die Hauptgruppe Im Periodensystem An
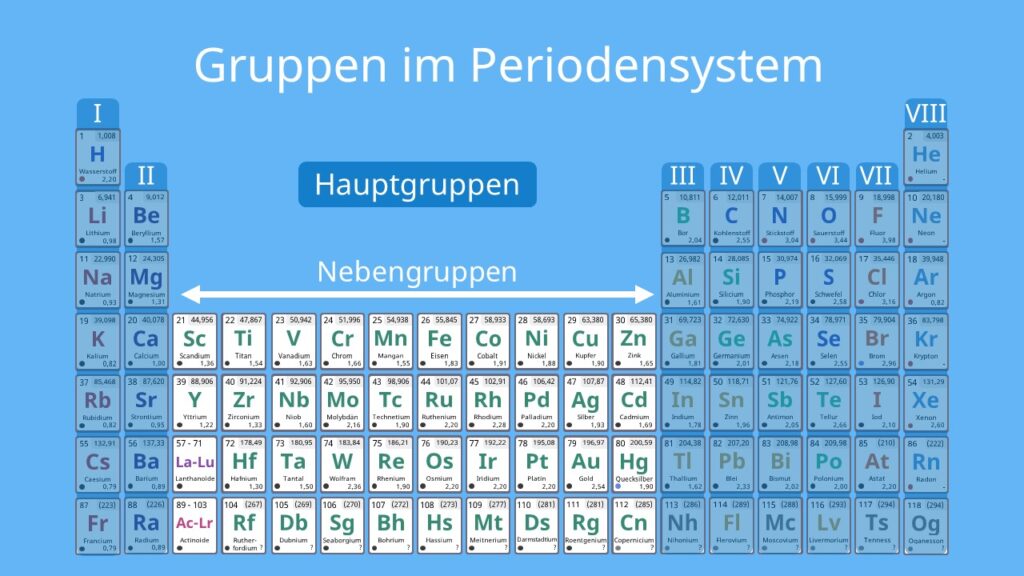
Das Periodensystem der Elemente (PSE) ist eine tabellarische Anordnung aller bekannten chemischen Elemente. Es ordnet die Elemente nach steigender Atomzahl und gruppiert sie nach ähnlichen chemischen Eigenschaften. Eine der wichtigsten Strukturierungselemente des PSE sind die Hauptgruppen. Dieses Dokument erklärt, was die Hauptgruppen im Periodensystem angeben und welche Bedeutung sie für das Verständnis der chemischen Eigenschaften der Elemente haben.
Was sind die Hauptgruppen?
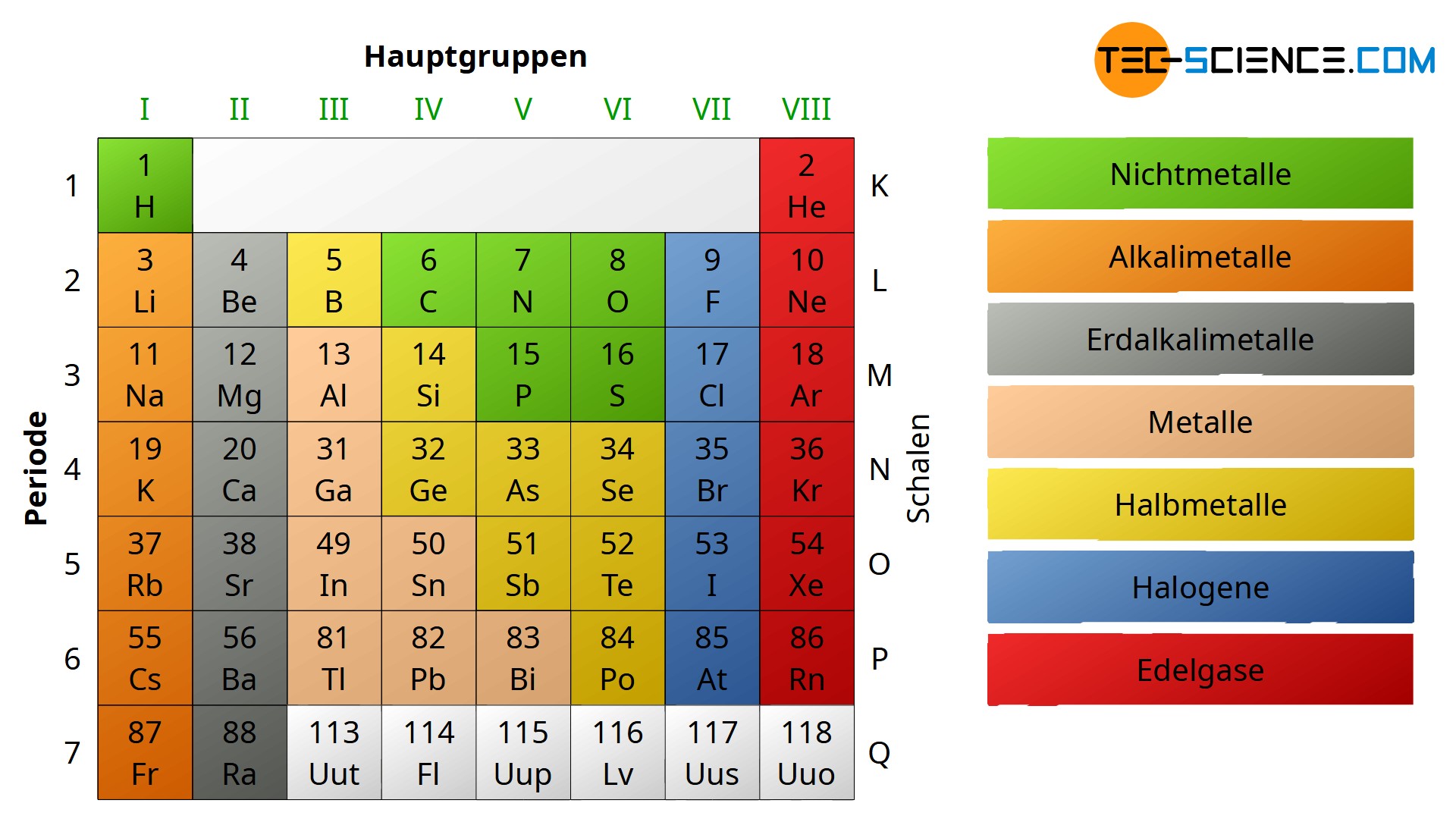
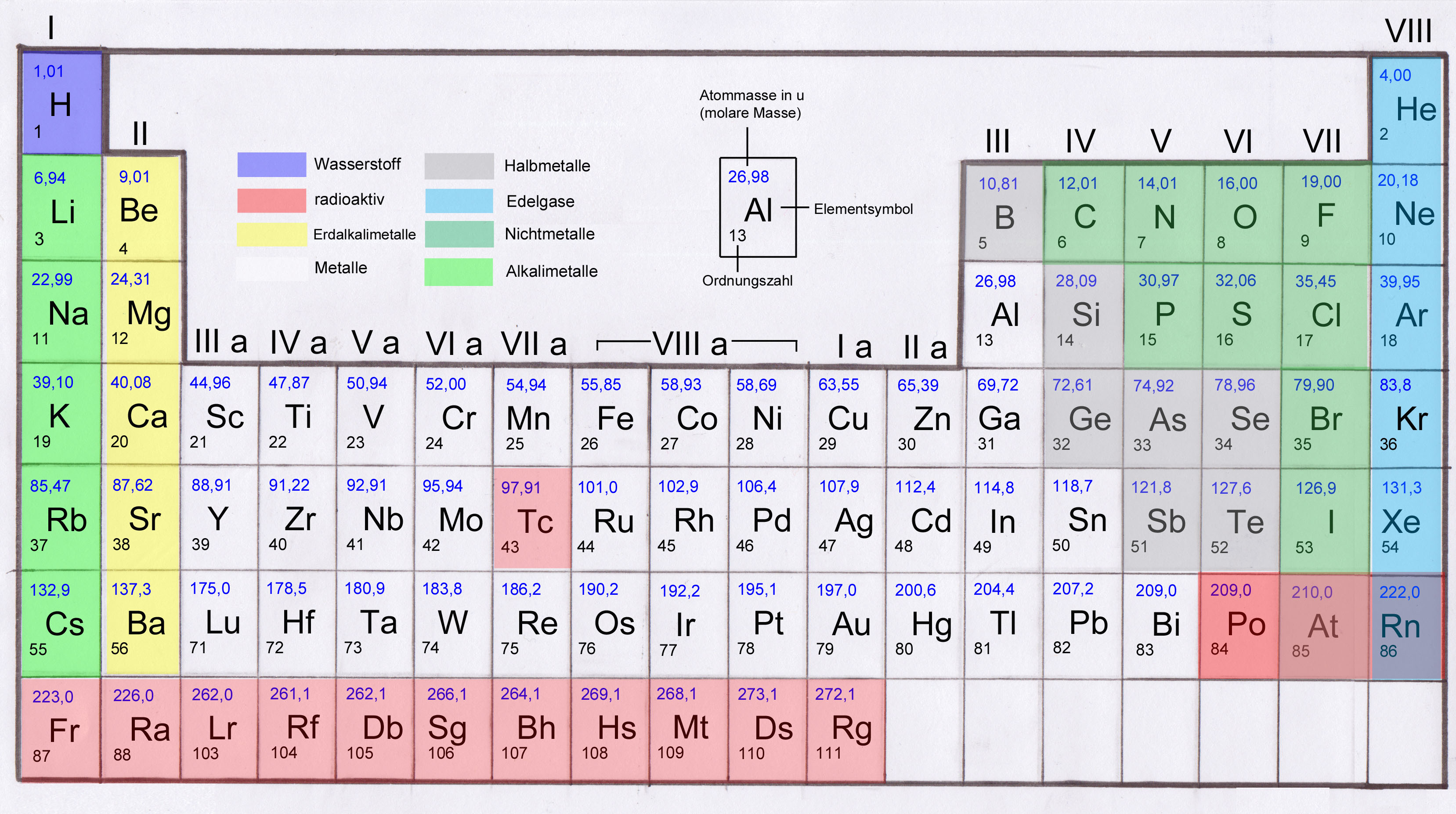
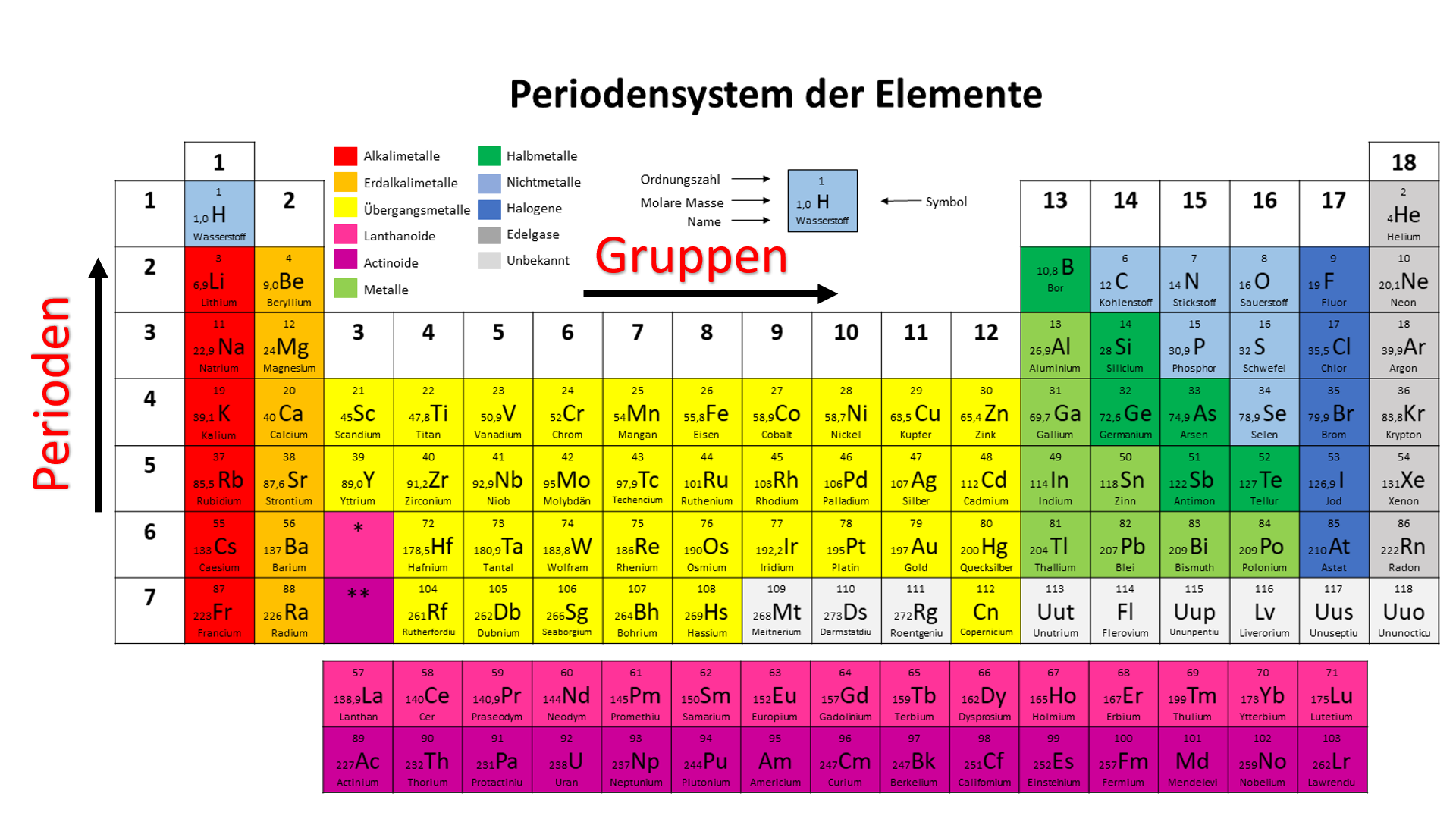
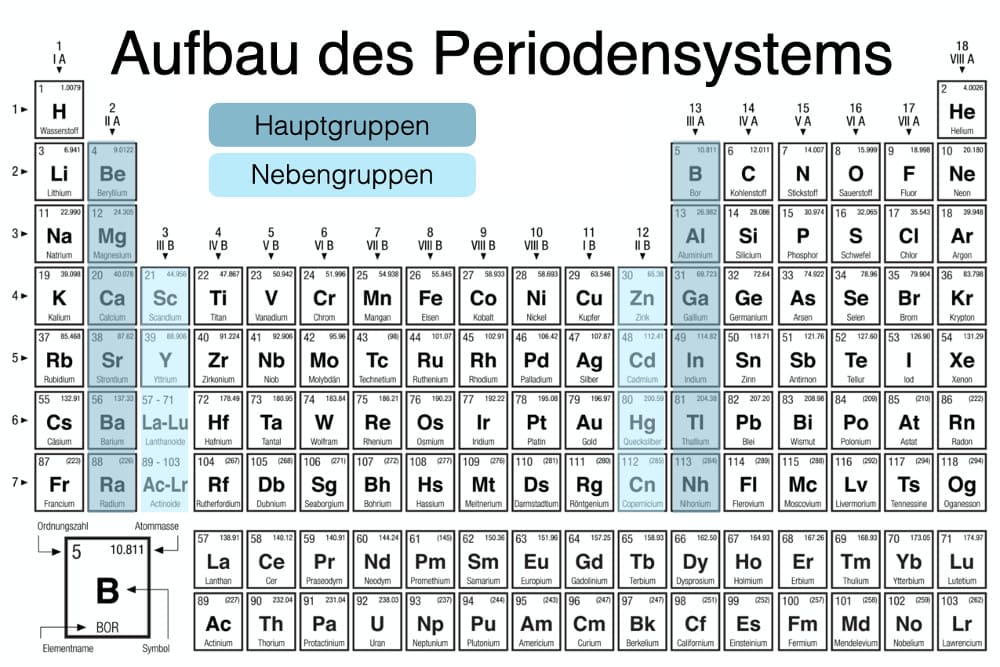
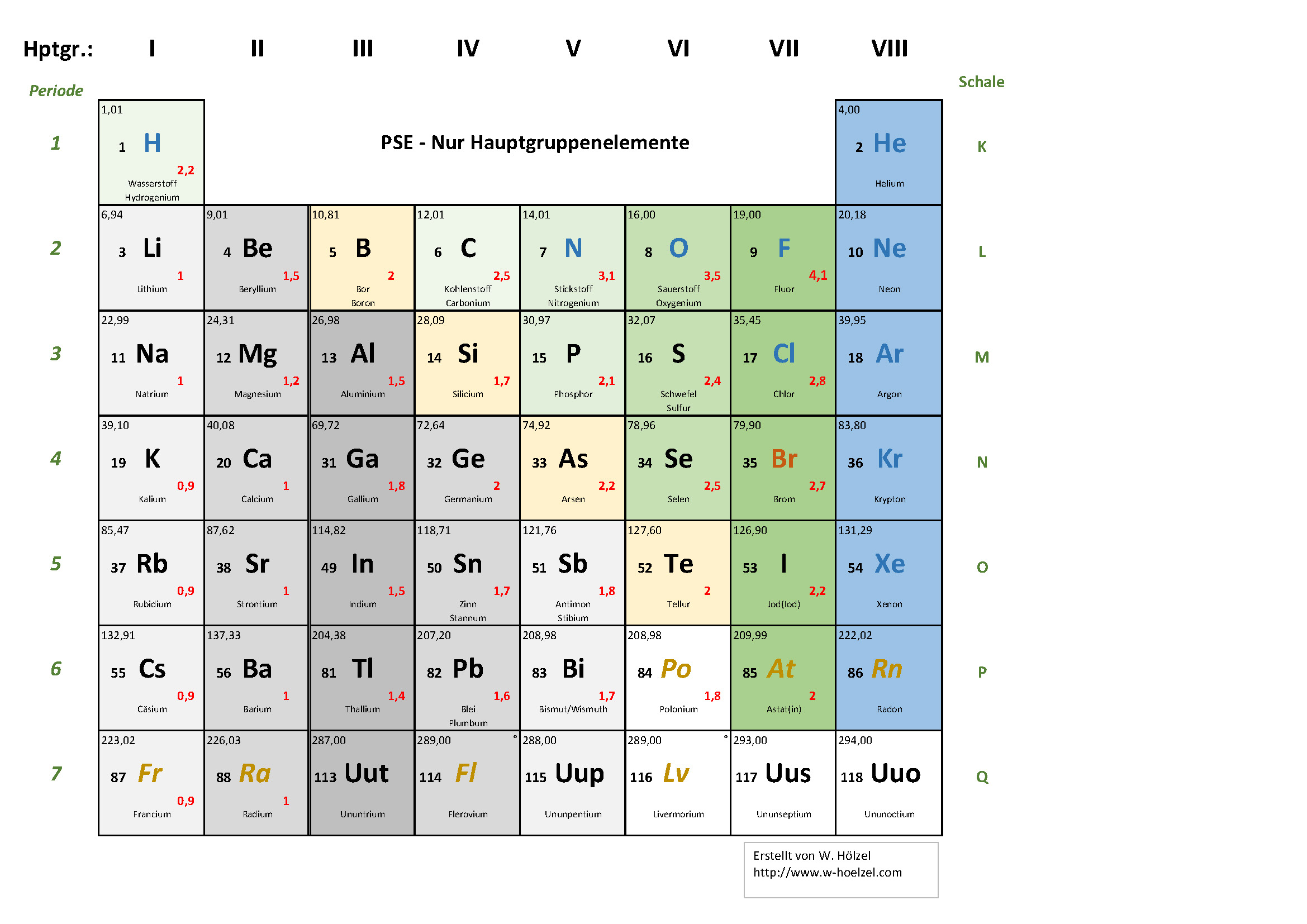
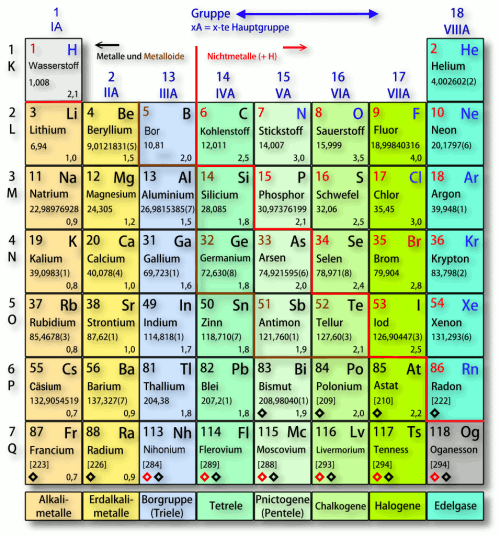
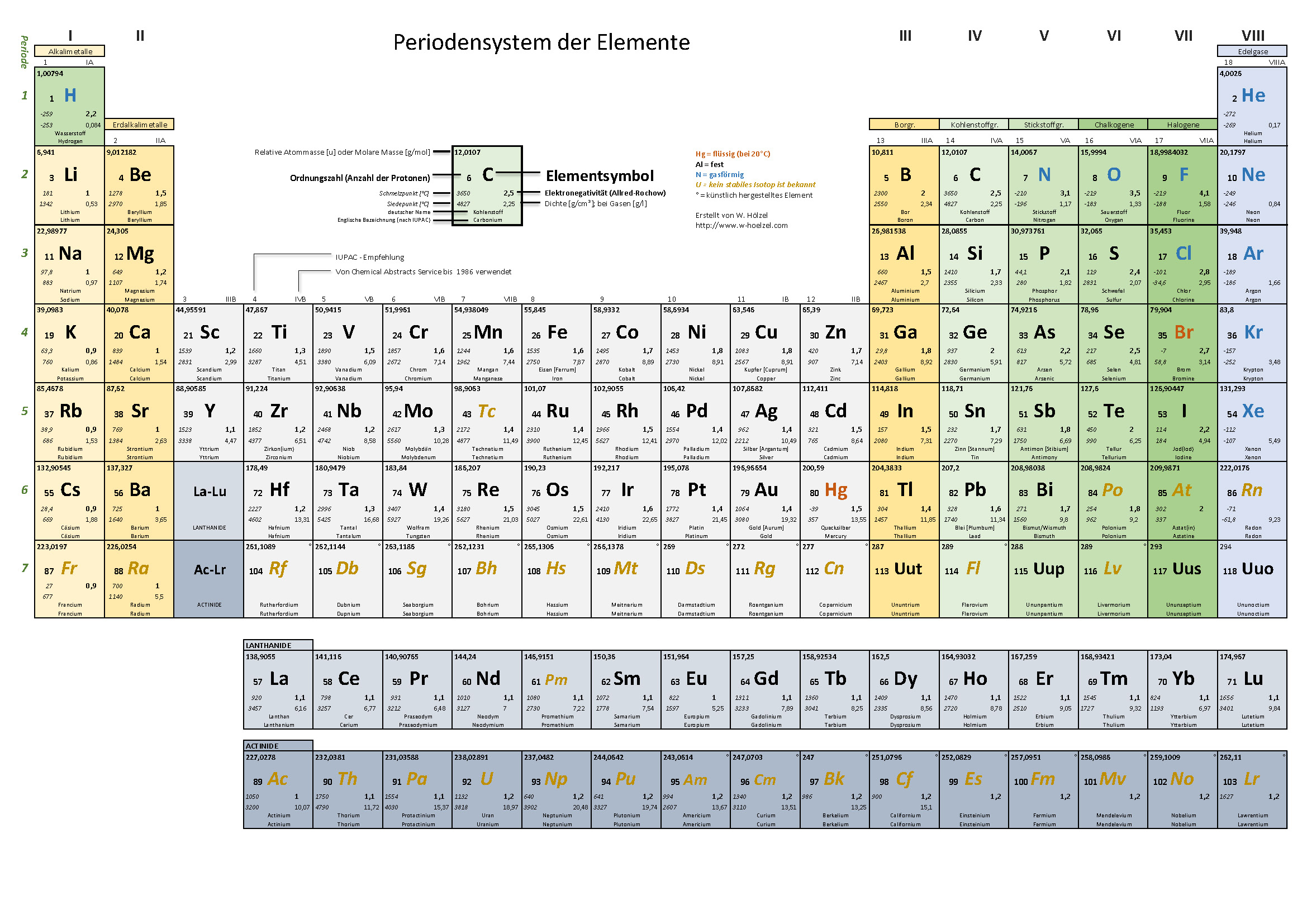
Die Hauptgruppen, auch als A-Gruppen bezeichnet, sind die Gruppen 1, 2 und 13 bis 18 im Periodensystem. Im Gegensatz zu den Nebengruppenelementen (Übergangsmetallen) zeigen die Hauptgruppenelemente in ihren chemischen Eigenschaften einen sehr regelmäßigen und vorhersagbaren Trend. Die Elemente innerhalb einer Hauptgruppe haben ähnliche Valenzelektronenkonfigurationen, was zu ähnlichen chemischen Reaktionen und Bindungsverhalten führt.
Manchmal werden die Hauptgruppen auch als Repräsentative Elemente bezeichnet, da ihre Eigenschaften besonders gut die periodischen Trends im System widerspiegeln.
Die Hauptgruppen im Detail:
Hier ist eine detailliertere Betrachtung der einzelnen Hauptgruppen:
- Gruppe 1: Alkalimetalle Diese Gruppe umfasst Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr). Sie sind alle sehr reaktiv, weiche Metalle, die leicht ein Elektron abgeben, um eine positive Ladung (+1) zu bilden. Sie reagieren heftig mit Wasser unter Freisetzung von Wasserstoffgas und bilden basische Hydroxide (daher der Name Alkalimetalle).
- Gruppe 2: Erdalkalimetalle Diese Gruppe umfasst Beryllium (Be), Magnesium (Mg), Kalzium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra). Sie sind ebenfalls reaktiv, aber weniger reaktiv als die Alkalimetalle. Sie geben leicht zwei Elektronen ab, um eine positive Ladung (+2) zu bilden.
- Gruppe 13: Borgruppe Diese Gruppe umfasst Bor (B), Aluminium (Al), Gallium (Ga), Indium (In) und Thallium (Tl). Bor ist ein Halbmetall, während die anderen Elemente Metalle sind. Ihre Valenzelektronenkonfiguration ermöglicht die Bildung von drei kovalenten Bindungen oder die Abgabe von drei Elektronen zur Bildung einer +3 Ladung (obwohl dies bei schwereren Elementen weniger wahrscheinlich ist).
- Gruppe 14: Kohlenstoffgruppe Diese Gruppe umfasst Kohlenstoff (C), Silizium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb). Kohlenstoff ist ein Nichtmetall, Silizium und Germanium sind Halbmetalle, und Zinn und Blei sind Metalle. Die Elemente dieser Gruppe können vier kovalente Bindungen bilden.
- Gruppe 15: Stickstoffgruppe Diese Gruppe umfasst Stickstoff (N), Phosphor (P), Arsen (As), Antimon (Sb) und Bismut (Bi). Stickstoff und Phosphor sind Nichtmetalle, Arsen und Antimon sind Halbmetalle, und Bismut ist ein Metall. Die Elemente dieser Gruppe können drei kovalente Bindungen bilden oder fünf Elektronen aufnehmen, um eine -3 Ladung zu bilden.
- Gruppe 16: Chalkogene Diese Gruppe umfasst Sauerstoff (O), Schwefel (S), Selen (Se), Tellur (Te) und Polonium (Po). Sauerstoff, Schwefel und Selen sind Nichtmetalle, Tellur ist ein Halbmetall, und Polonium ist ein Metall. Sauerstoff ist das zweitreaktivste Element (nach Fluor). Diese Elemente bilden häufig zwei kovalente Bindungen oder nehmen zwei Elektronen auf, um eine -2 Ladung zu bilden.
- Gruppe 17: Halogene Diese Gruppe umfasst Fluor (F), Chlor (Cl), Brom (Br), Iod (I) und Astat (At). Sie sind alle sehr reaktive Nichtmetalle. Sie nehmen leicht ein Elektron auf, um eine negative Ladung (-1) zu bilden. Sie kommen in der Natur typischerweise als zweiatomige Moleküle (F2, Cl2, Br2, I2) vor.
- Gruppe 18: Edelgase Diese Gruppe umfasst Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und Radon (Rn). Sie sind alle Gase und sehr reaktionsträge (inert), da sie eine voll besetzte äußere Elektronenschale haben. Früher nannte man sie inerte Gase, aber einige schwerere Edelgase (Xe, Kr) können unter bestimmten Bedingungen Verbindungen bilden.
Was geben die Hauptgruppen an?
Die Hauptgruppen im Periodensystem geben im Wesentlichen die Anzahl der Valenzelektronen eines Elements an. Valenzelektronen sind die Elektronen in der äußersten Elektronenschale eines Atoms, die für die chemische Bindung verantwortlich sind. Die Gruppennummer (mit einigen Ausnahmen, die später erläutert werden) entspricht der Anzahl der Valenzelektronen.
Beispiele:
- Elemente der Gruppe 1 (Alkalimetalle) haben 1 Valenzelektron.
- Elemente der Gruppe 2 (Erdalkalimetalle) haben 2 Valenzelektronen.
- Elemente der Gruppe 13 (Borgruppe) haben 3 Valenzelektronen.
- Elemente der Gruppe 14 (Kohlenstoffgruppe) haben 4 Valenzelektronen.
- Elemente der Gruppe 15 (Stickstoffgruppe) haben 5 Valenzelektronen.
- Elemente der Gruppe 16 (Chalkogene) haben 6 Valenzelektronen.
- Elemente der Gruppe 17 (Halogene) haben 7 Valenzelektronen.
- Elemente der Gruppe 18 (Edelgase) haben 8 Valenzelektronen (außer Helium, das nur 2 hat).
Die Anzahl der Valenzelektronen bestimmt maßgeblich das chemische Verhalten eines Elements. Sie bestimmt, wie das Element mit anderen Elementen reagiert, welche Arten von Bindungen es eingehen kann und welche Ladung es als Ion bildet.
Die Kenntnis der Anzahl der Valenzelektronen ermöglicht es, die chemische Formel von Verbindungen vorherzusagen. Zum Beispiel wissen wir, dass Natrium (Gruppe 1, 1 Valenzelektron) und Chlor (Gruppe 17, 7 Valenzelektronen) dazu neigen, Natriumchlorid (NaCl) zu bilden, da Natrium ein Elektron abgibt und Chlor es aufnimmt, wodurch beide Atome eine stabile äußere Elektronenschale erreichen.
Ausnahmen und wichtige Hinweise
Es gibt ein paar Ausnahmen und wichtige Hinweise, die man im Zusammenhang mit Hauptgruppen und Valenzelektronen beachten sollte:
- Helium: Helium (He) gehört zur Gruppe 18 (Edelgase), hat aber nur 2 Valenzelektronen. Obwohl es nur zwei Elektronen hat, ist seine Elektronenschale voll, was es sehr stabil und reaktionsträge macht.
- Wasserstoff: Wasserstoff (H) steht in der Gruppe 1, hat aber einzigartige Eigenschaften und gehört weder wirklich zu den Alkalimetallen noch zu den Halogenen. Es kann entweder ein Elektron abgeben, um ein H+-Ion zu bilden, oder ein Elektron aufnehmen, um ein H--Ion zu bilden.
- Nebengruppenelemente: Die hier beschriebenen Regeln gelten *nicht* für die Nebengruppenelemente (Übergangsmetalle). Diese Elemente haben kompliziertere Valenzelektronenkonfigurationen und bilden oft Ionen mit unterschiedlichen Ladungen.
- Schwere Elemente: Bei den schwereren Elementen (ab Periode 4) spielen die inneren Elektronen (d- und f-Orbitale) eine größere Rolle, und die Vorhersage der Eigenschaften wird komplizierter. Der inerte Paareffekt ist ein Beispiel dafür, wo die s-Elektronen im äußersten Orbital schwerer Elemente (wie Thallium, Blei und Bismut) weniger wahrscheinlich an der Bindung teilnehmen, was zu niedrigeren Oxidationsstufen führt.
Zusammenfassend
Die Hauptgruppen im Periodensystem geben Auskunft über die Anzahl der Valenzelektronen eines Elements. Diese Information ist entscheidend, um die chemischen Eigenschaften des Elements, seine Reaktivität und seine Fähigkeit zur Bildung chemischer Bindungen zu verstehen. Durch das Verständnis der Hauptgruppen und ihrer Eigenschaften kann man das Verhalten von Elementen und die Zusammensetzung chemischer Verbindungen vorhersagen.
Obwohl es einige Ausnahmen gibt, bieten die Hauptgruppen eine wertvolle Grundlage für das Verständnis der Chemie der Elemente und ihrer Wechselwirkungen.