Was Ist Der Osmotische Druck
Viele, die nach Deutschland ziehen oder sich für Naturwissenschaften interessieren, stoßen auf den Begriff "Osmotischer Druck". Er spielt eine wichtige Rolle in zahlreichen biologischen und chemischen Prozessen. Dieser Artikel erklärt auf einfache und verständliche Weise, was der osmotische Druck ist und warum er so bedeutend ist.
Was ist Osmose?
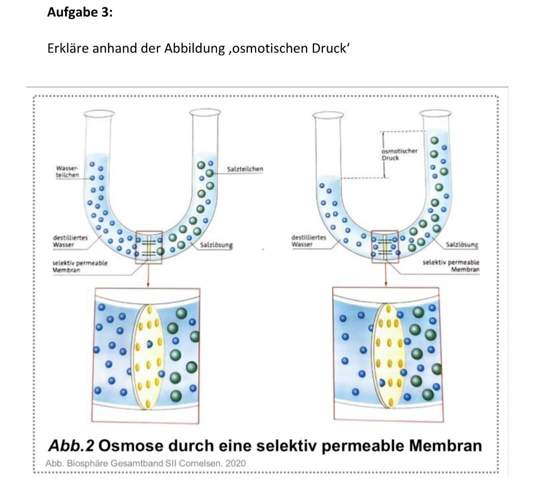
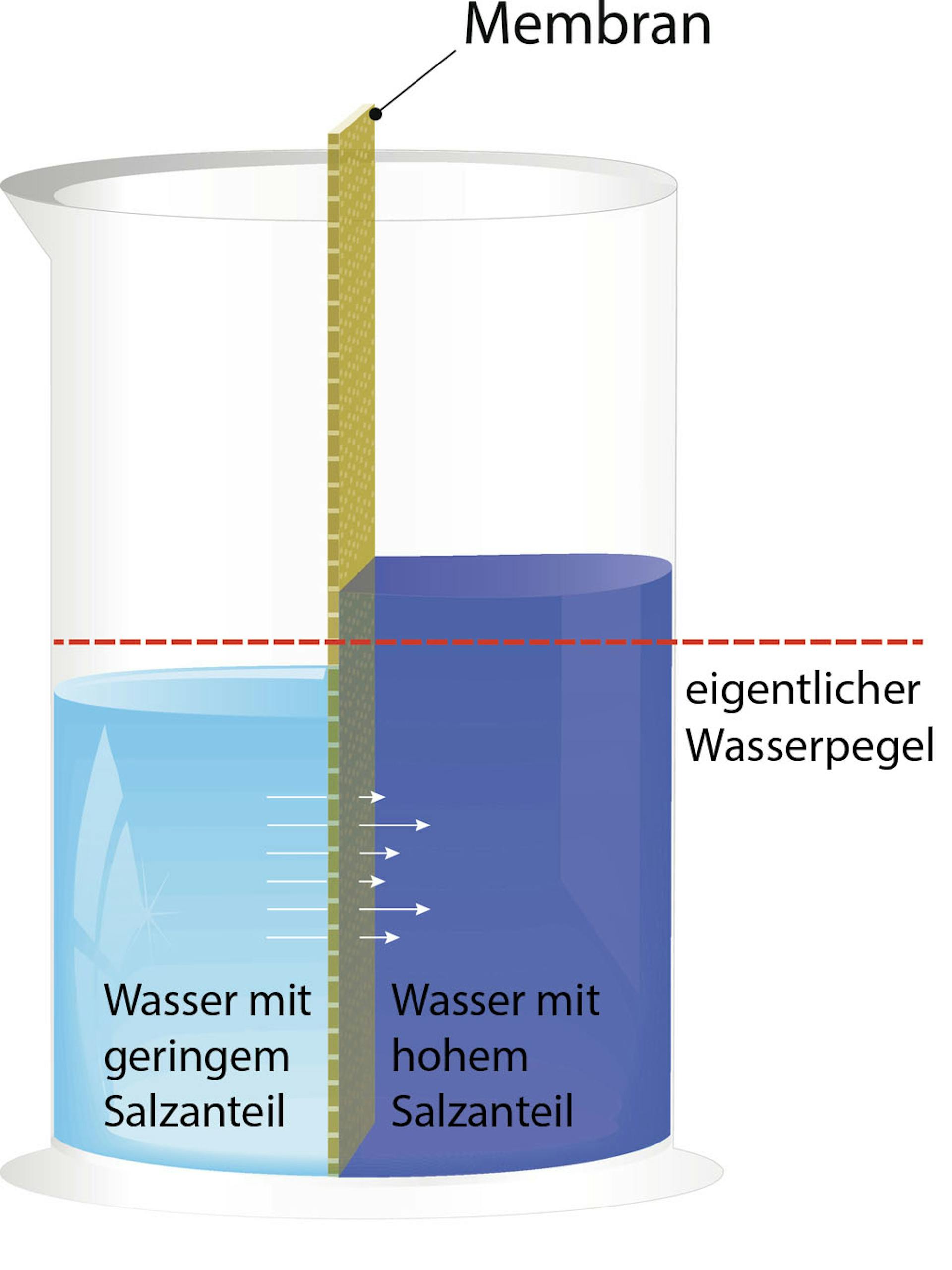
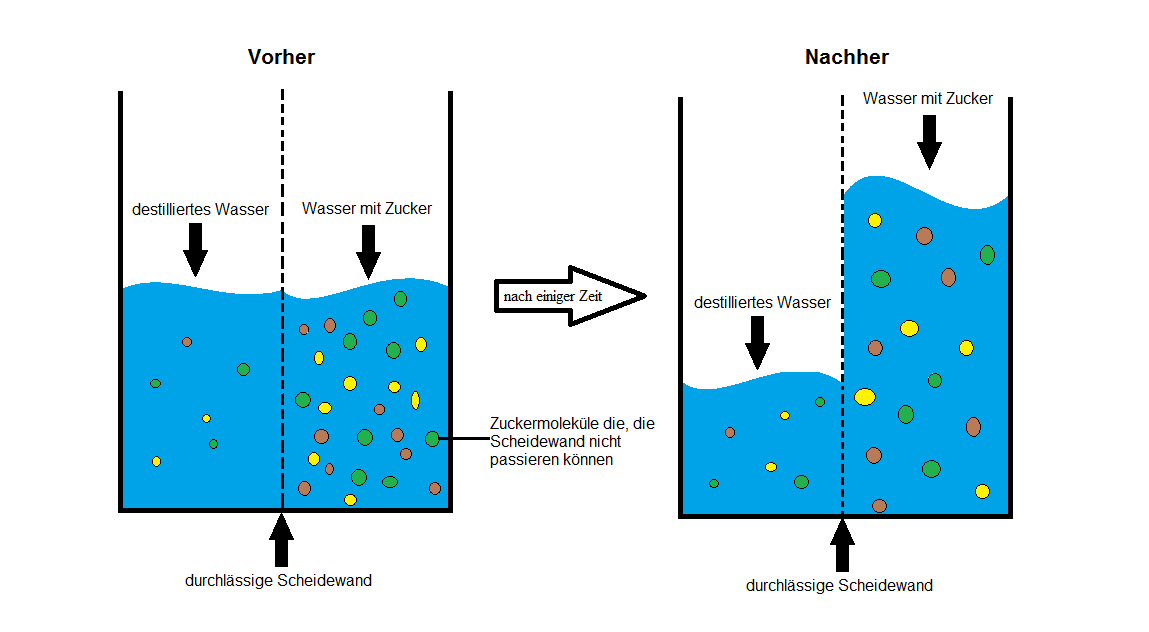
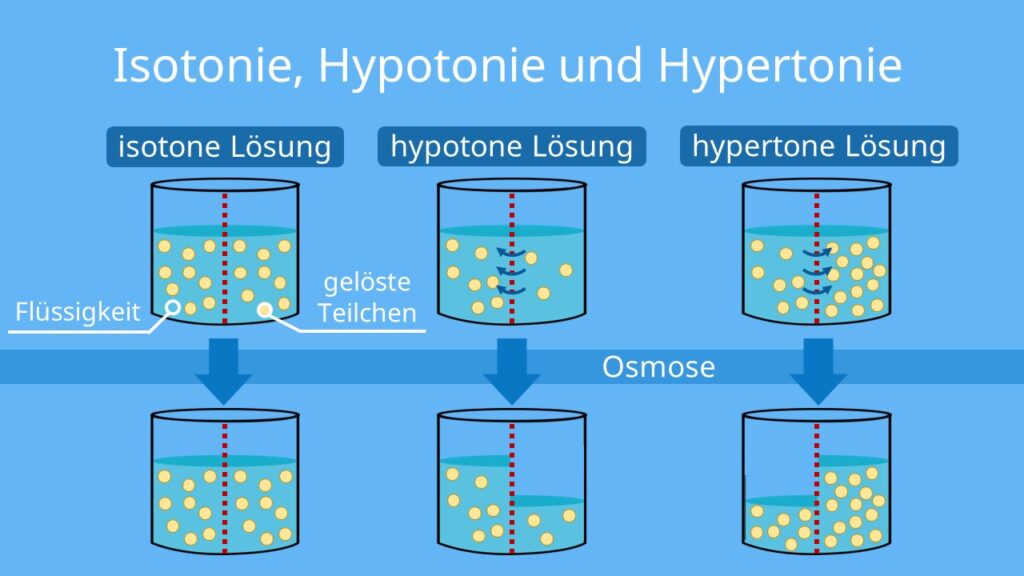
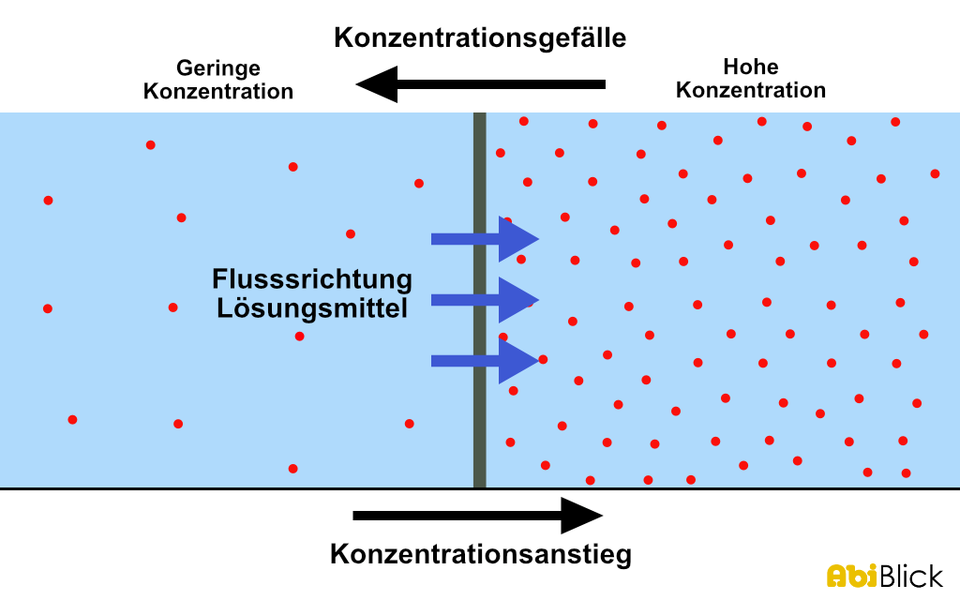
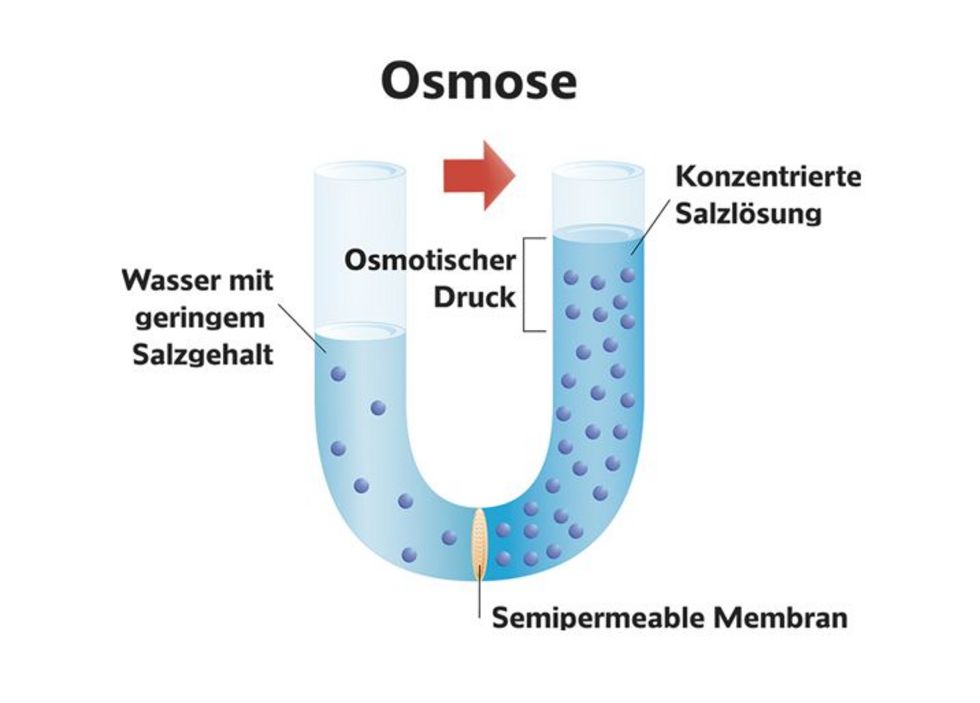
Bevor wir uns dem osmotischen Druck widmen, müssen wir zunächst verstehen, was Osmose ist. Osmose ist die spontane Netto-Bewegung von Lösungsmittelmolekülen durch eine semipermeable Membran in einen Bereich höherer gelöster Stoffkonzentration, mit dem Ziel, die Konzentration auszugleichen. Eine semipermeable Membran ist eine Membran, die bestimmte Moleküle oder Ionen passieren lässt, andere jedoch nicht. Stellen Sie sich eine Membran mit winzigen Poren vor. Kleine Wassermoleküle können hindurchpassen, während größere Zuckermoleküle blockiert werden.
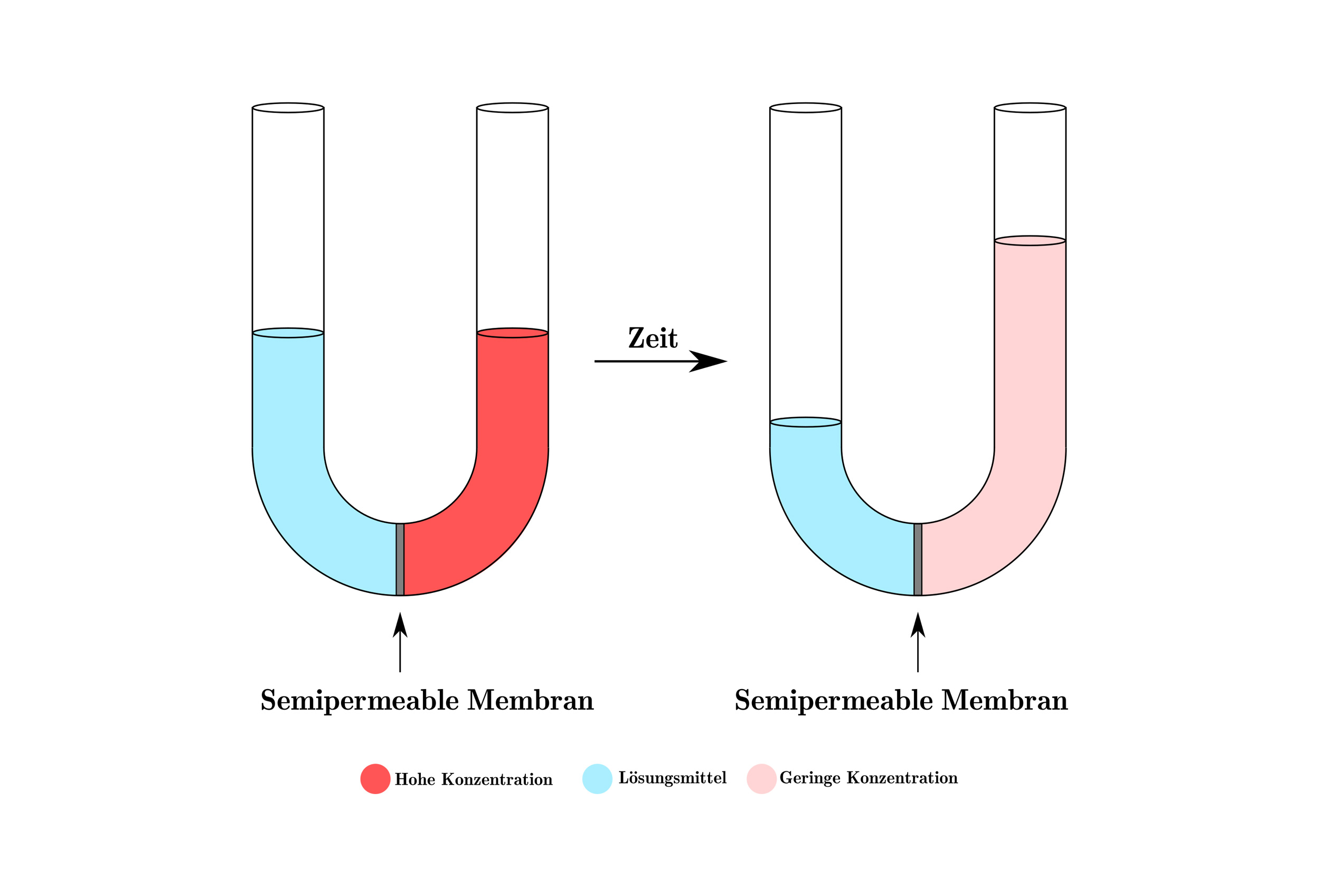
Betrachten wir ein einfaches Beispiel: Sie haben ein U-förmiges Rohr, das durch eine semipermeable Membran geteilt ist. Auf der einen Seite befindet sich reines Wasser, auf der anderen Seite eine Zuckerlösung (also Wasser mit gelöstem Zucker). Aufgrund der Osmose wandert Wasser aus der Seite mit dem reinen Wasser (hohe Wasserkonzentration) auf die Seite mit der Zuckerlösung (niedrige Wasserkonzentration). Dies geschieht so lange, bis ein Gleichgewicht erreicht ist oder ein anderer Faktor die Bewegung stoppt. Die Wassermenge auf der Seite mit der Zuckerlösung nimmt also zu.
Der Osmotische Druck – Definition und Bedeutung
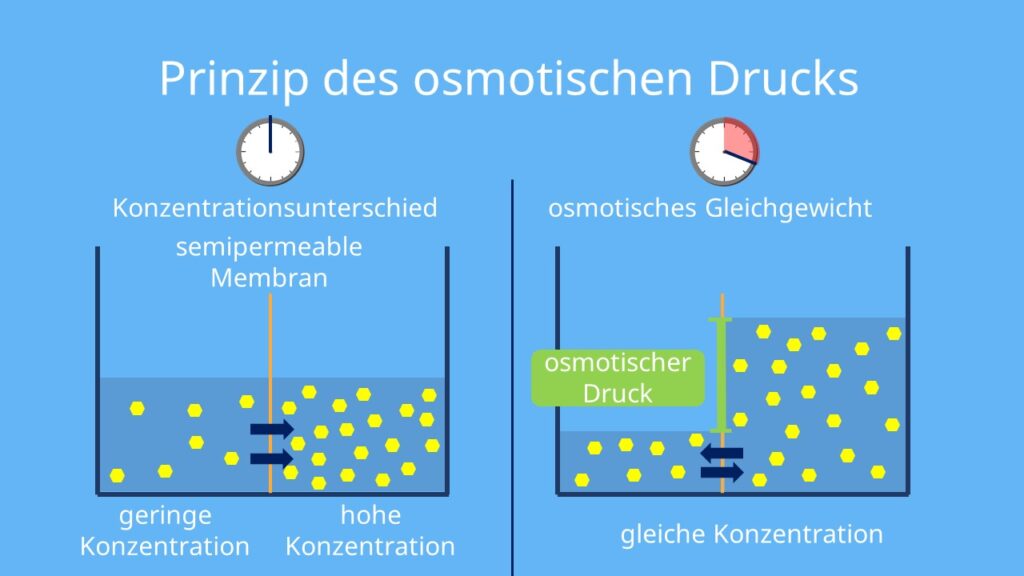
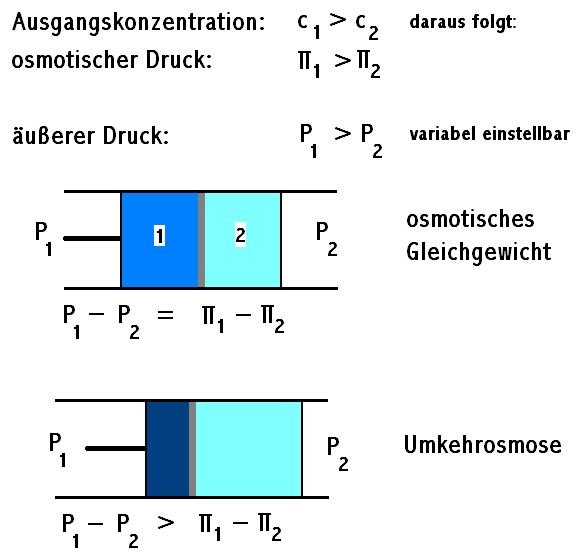
Der osmotische Druck ist der Druck, der aufgewendet werden muss, um die Osmose zu stoppen. Mit anderen Worten, es ist der Druck, der erforderlich ist, um zu verhindern, dass Lösungsmittel (z. B. Wasser) durch eine semipermeable Membran in eine Lösung mit höherer Konzentration gelöster Stoffe wandert. Er ist ein Maß für die Tendenz einer Lösung, Wasser durch Osmose anzuziehen.
Stellen Sie sich das U-förmige Rohr von vorhin vor. Nachdem Wasser durch die Membran gewandert ist und der Flüssigkeitsspiegel auf der Seite der Zuckerlösung gestiegen ist, übt diese Flüssigkeitssäule einen hydrostatischen Druck aus. Der osmotische Druck ist genau dieser Druck, der notwendig wäre, um zu verhindern, dass noch mehr Wasser auf die Seite der Zuckerlösung gelangt. Wenn Sie also auf die Seite der Zuckerlösung einen Druck ausüben, der dem osmotischen Druck entspricht, würde die Osmose aufhören.
Warum ist der osmotische Druck wichtig?
Der osmotische Druck ist in vielen Bereichen von großer Bedeutung:
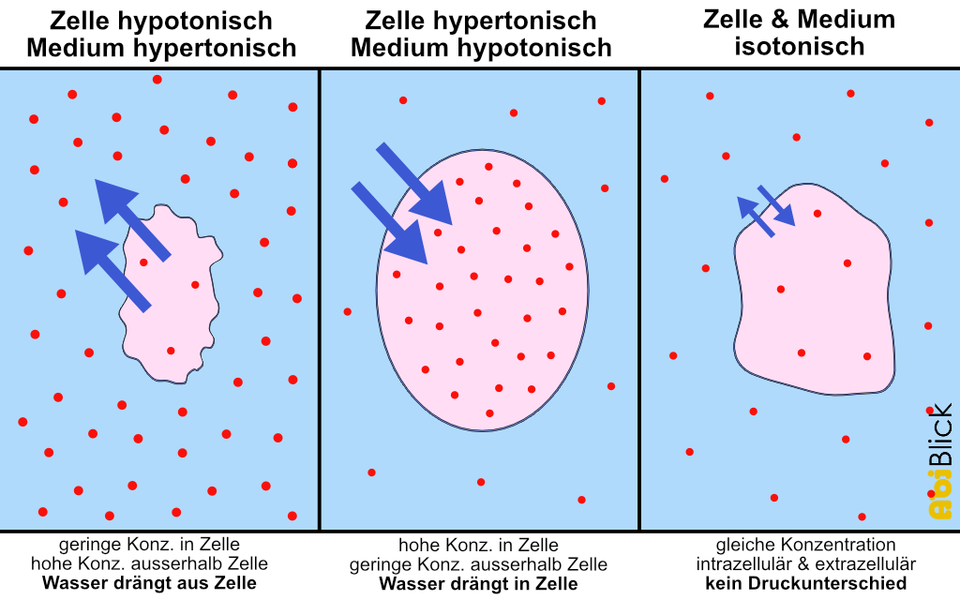
- Biologie: Er spielt eine entscheidende Rolle im Leben von Zellen. Die Zellen sind von Zellmembranen umgeben, die semipermeabel sind. Der osmotische Druck beeinflusst, wie Wasser in die Zellen ein- und austritt. Wenn die Konzentration der gelösten Stoffe außerhalb der Zelle höher ist als innerhalb, verliert die Zelle Wasser (schrumpft). Ist die Konzentration niedriger, nimmt die Zelle Wasser auf (schwillt an). Ein extremes Beispiel ist das Platzen einer roten Blutzelle in reinem Wasser. Pflanzen nutzen den osmotischen Druck, um Wasser aus dem Boden aufzunehmen und ihre Zellen prall zu halten (Turgordruck).
- Medizin: Er ist wichtig für die Aufrechterhaltung des Flüssigkeitshaushaltes im Körper. Intravenöse Flüssigkeiten (Infusionen) müssen einen bestimmten osmotischen Druck haben, um sicherzustellen, dass sie weder Wasser aus den Zellen ziehen noch in die Zellen abgeben. Bei Nierenfunktionstörungen kann der osmotische Druck des Blutes beeinträchtigt sein.
- Lebensmittelindustrie: Er wird bei der Konservierung von Lebensmitteln eingesetzt. Durch das Hinzufügen von Salz oder Zucker wird der osmotische Druck erhöht, was das Wachstum von Mikroorganismen hemmt. Beispiele sind die Konservierung von Gurken durch Einlegen in Salzlake oder die Herstellung von Marmelade mit hohem Zuckergehalt.
- Landwirtschaft: Er beeinflusst die Wasseraufnahme durch Pflanzenwurzeln. Der Salzgehalt des Bodens kann den osmotischen Druck verändern und die Fähigkeit der Pflanzen, Wasser aufzunehmen, beeinträchtigen.
- Wasseraufbereitung: Die Umkehrosmose, ein Verfahren zur Wasserreinigung, nutzt Druck, um Wasser entgegen seinem osmotischen Gradienten durch eine semipermeable Membran zu pressen.
Faktoren, die den osmotischen Druck beeinflussen
Der osmotische Druck hängt von verschiedenen Faktoren ab:
- Konzentration der gelösten Stoffe: Je höher die Konzentration der gelösten Stoffe in einer Lösung, desto höher ist der osmotische Druck. Es besteht ein direkter Zusammenhang.
- Temperatur: Der osmotische Druck steigt mit steigender Temperatur.
- Art der gelösten Stoffe: Die Art der gelösten Stoffe spielt eine Rolle, insbesondere ihre Fähigkeit, sich in Ionen aufzuteilen (Dissoziation). Elektrolyte (z.B. Salze) dissoziieren in Ionen und erzeugen dadurch einen höheren osmotischen Druck als Nicht-Elektrolyte (z.B. Zucker) bei gleicher molarer Konzentration.
Die Van't Hoff'sche Gleichung
Der osmotische Druck kann mit der Van't Hoff'schen Gleichung berechnet werden:
π = i * c * R * T
Wo:
- π = osmotischer Druck
- i = Van't Hoff-Faktor (Anzahl der Teilchen, in die sich ein Stoff in Lösung aufspaltet; z.B. NaCl -> i=2, Zucker -> i=1)
- c = molare Konzentration der Lösung (mol/L)
- R = ideale Gaskonstante (0,0821 L atm / (mol K) oder 8,314 J / (mol K))
- T = absolute Temperatur in Kelvin (K)
Diese Gleichung zeigt, dass der osmotische Druck direkt proportional zur Konzentration der gelösten Stoffe und zur Temperatur ist.
Ein einfaches Beispiel zur Berechnung
Nehmen wir an, wir haben eine Lösung von 0,1 mol/L Glukose (Zucker) bei einer Temperatur von 25°C (298 K). Glukose dissoziiert nicht, also ist i = 1. Die ideale Gaskonstante R ist 0,0821 L atm / (mol K).
π = 1 * 0,1 mol/L * 0,0821 L atm / (mol K) * 298 K
π ≈ 2,45 atm
Der osmotische Druck dieser Glukoselösung beträgt also ungefähr 2,45 Atmosphären.
Osmotischer Druck im Alltag
Auch im Alltag begegnet man dem osmotischen Druck, oft unbewusst:
- Salatdressing: Wenn man einen Salat mit einem stark salzhaltigen oder zuckerhaltigen Dressing übergießt, kann das Wasser aus den Salatblättern austreten, wodurch diese welk werden.
- Eingemachtes: Durch das Einlegen von Obst oder Gemüse in Zucker- oder Salzlösungen wird der osmotische Druck erhöht, was das Wachstum von Bakterien und Pilzen hemmt und die Haltbarkeit verlängert.
- Bewässerung von Pflanzen: Ein zu hoher Salzgehalt im Boden kann den osmotischen Druck erhöhen und es den Pflanzen erschweren, Wasser aufzunehmen. Daher ist es wichtig, auf eine ausgewogene Bewässerung zu achten und gegebenenfalls den Boden zu entsalzen.
Zusammenfassung
Der osmotische Druck ist ein grundlegendes Konzept in den Naturwissenschaften, insbesondere in der Biologie, Chemie und Medizin. Er ist der Druck, der erforderlich ist, um die Osmose zu stoppen und hängt von der Konzentration der gelösten Stoffe, der Temperatur und der Art der gelösten Stoffe ab. Er spielt eine entscheidende Rolle bei vielen biologischen Prozessen, der Konservierung von Lebensmitteln und der Wasseraufbereitung. Das Verständnis des osmotischen Drucks hilft uns, viele Phänomene in unserer Umwelt besser zu verstehen.
![Was Ist Der Osmotische Druck Osmose • Anwendungen und Osmoregulation · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/04/WP-Bilder_Osmose_Osmotischer-Druck-1024x576.jpg)
![Was Ist Der Osmotische Druck Osmose einfach erkärt • Ablauf und Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/WP-Bild_Osmose-einfach-erklärt-1024x576.jpg)

![Was Ist Der Osmotische Druck Osmotischer Druck • einfach erklärt: Definition, Berechnung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/02/WP_Osmotischer-Druck_3-2-1024x576.jpg)
![Was Ist Der Osmotische Druck Osmotischer Druck • einfach erklärt: Definition, Berechnung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/02/WP_Osmotischer-Druck_2-5-1024x576.jpg)



![Was Ist Der Osmotische Druck Osmose einfach erkärt • Ablauf und Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/WP-Bild_Osmose-Beispiel_Aufplatzen-von-Kirschen-2-1024x576.jpg)