Was Ist Die Lewis Formel
Die Lewis-Formel, auch bekannt als Lewis-Struktur oder Elektronenpunktformel, ist ein grundlegendes Werkzeug in der Chemie, um die Bindungsverhältnisse und die Verteilung der Valenzelektronen in Molekülen und Ionen darzustellen. Sie hilft, die Struktur und Reaktivität chemischer Verbindungen zu verstehen. Für Expats und Neuankömmlinge in deutschsprachigen Ländern, die sich mit Chemie beschäftigen oder diese erlernen möchten, ist es wichtig, die Lewis-Formel und ihre Anwendung zu verstehen.
Grundlagen der Lewis-Formel
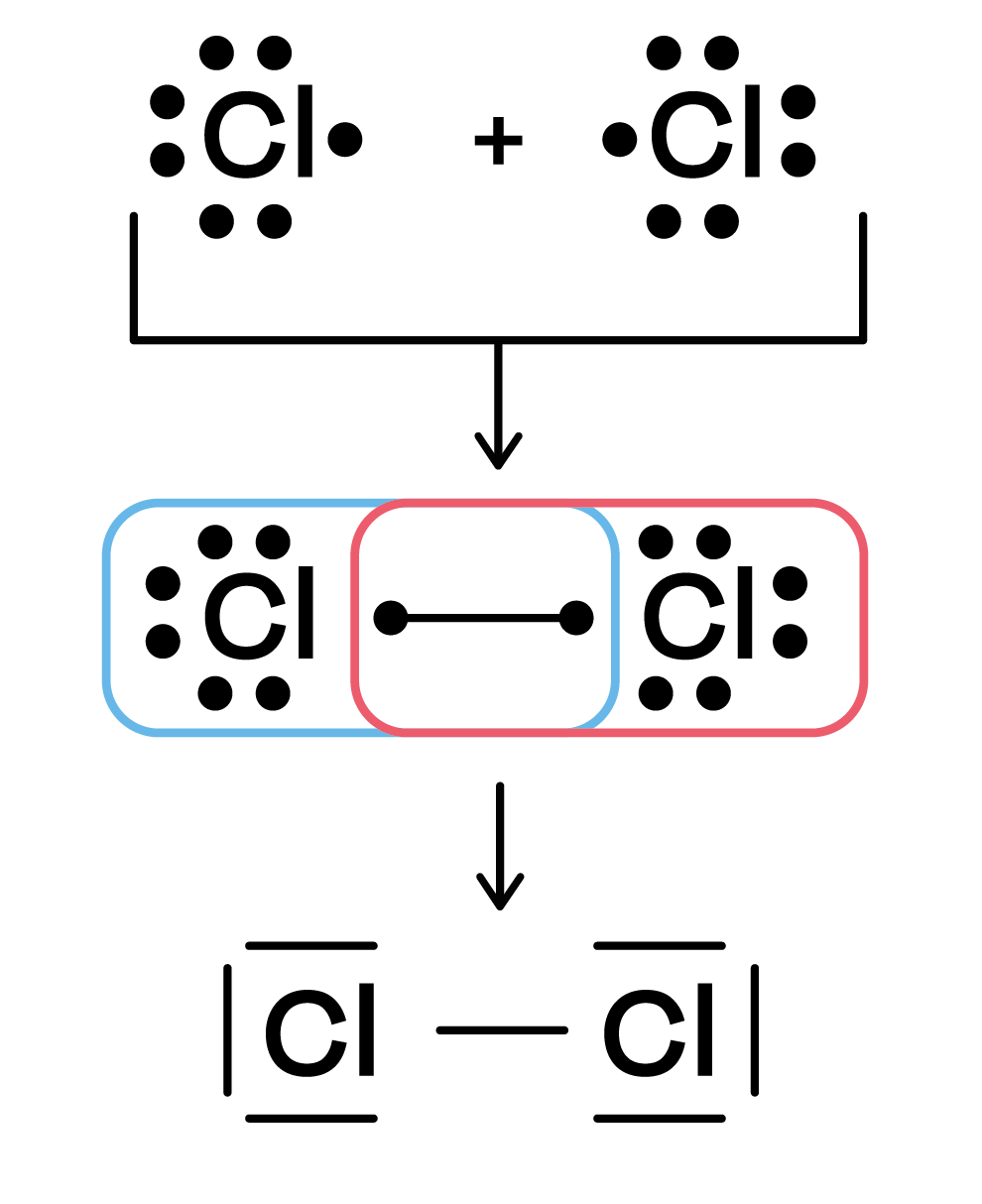
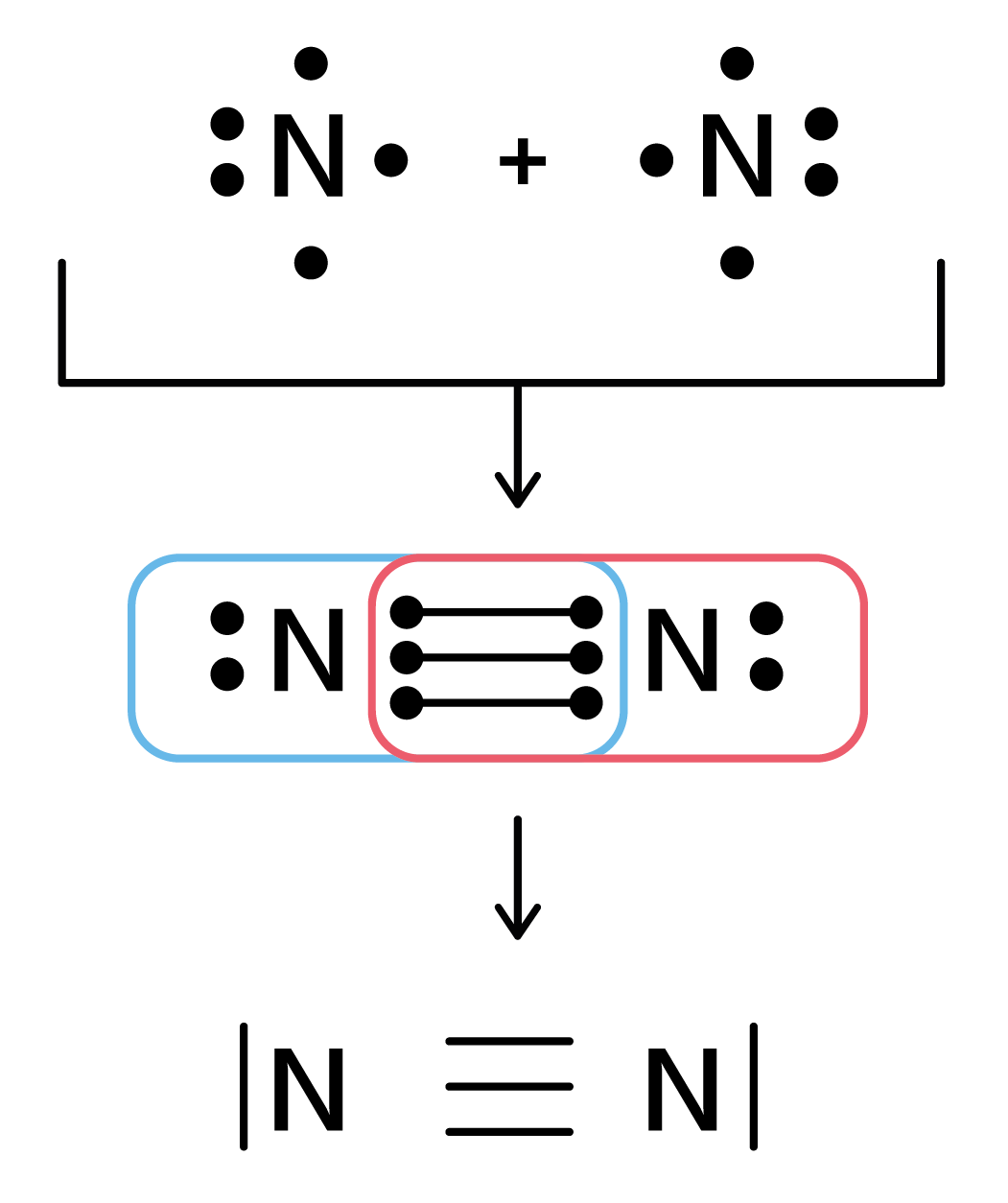
Die Lewis-Formel basiert auf der Oktettregel (oder Duettregel für Wasserstoff und Lithium). Die Oktettregel besagt, dass Atome dazu neigen, Bindungen einzugehen, um acht Valenzelektronen in ihrer äußersten Elektronenschale zu erreichen (die Edelgaskonfiguration). Wasserstoff und Lithium streben eine Konfiguration mit zwei Elektronen an (Duettregel), da ihre Valenzschale nur zwei Elektronen aufnehmen kann.
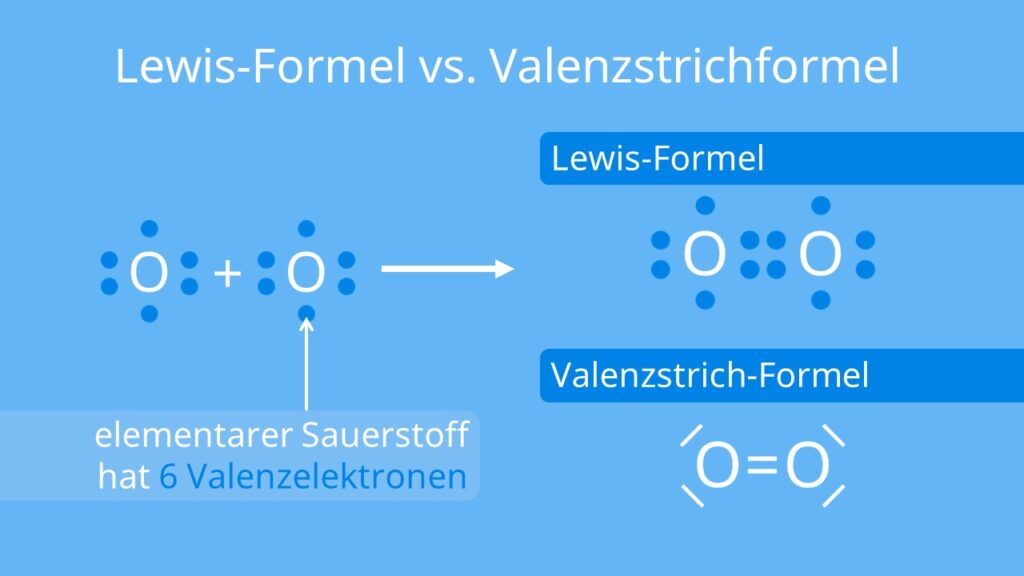
Valenzelektronen sind die Elektronen in der äußersten Schale eines Atoms, die an chemischen Bindungen beteiligt sind. Die Anzahl der Valenzelektronen eines Atoms entspricht in der Regel seiner Gruppennummer im Periodensystem (z.B. hat Sauerstoff in der 6. Gruppe 6 Valenzelektronen).
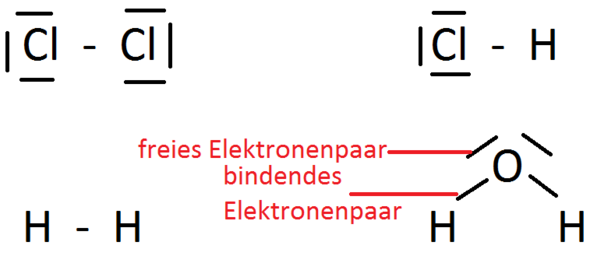
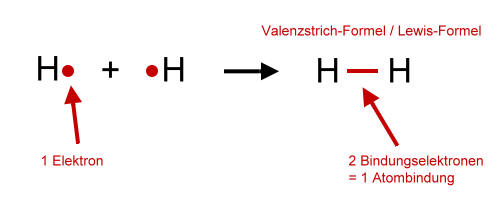
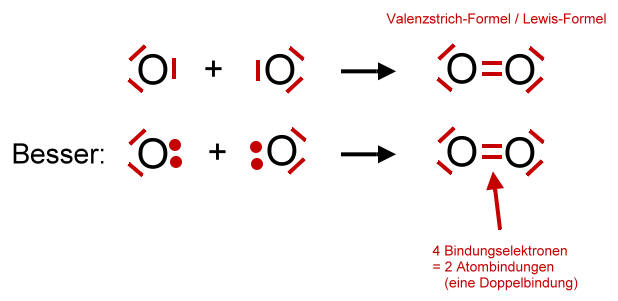
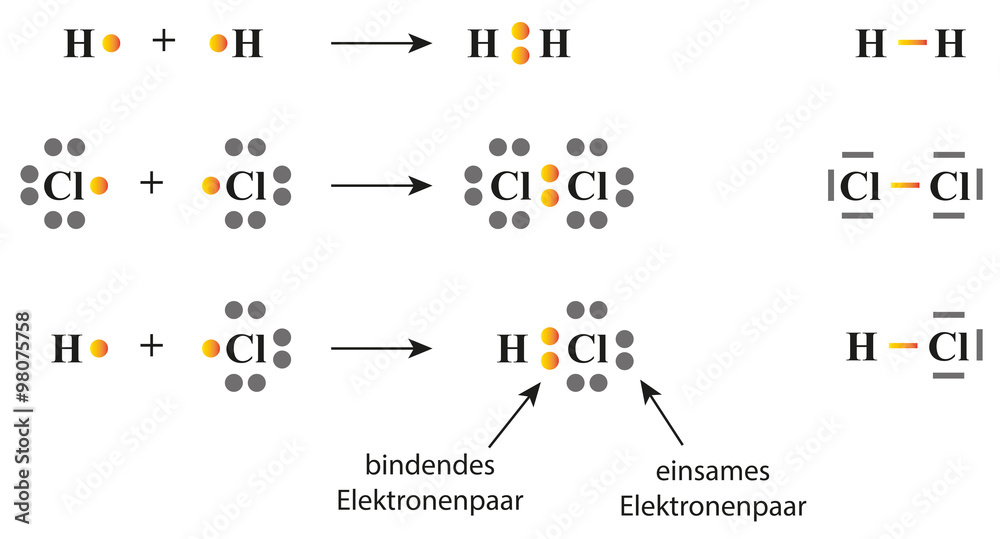
Die Lewis-Formel verwendet Punkte, um Valenzelektronen darzustellen, und Linien, um kovalente Bindungen zwischen Atomen darzustellen. Eine einzelne Linie steht für ein Elektronenpaar (eine Einfachbindung), zwei Linien stehen für zwei Elektronenpaare (eine Doppelbindung), und drei Linien stehen für drei Elektronenpaare (eine Dreifachbindung).
Schritte zur Erstellung einer Lewis-Formel
- Bestimmung der Gesamtanzahl an Valenzelektronen: Addiere die Anzahl der Valenzelektronen aller Atome im Molekül oder Ion. Beachte dabei die Ladung des Ions. Bei einem Anion (negativ geladen) addiere die Anzahl der negativen Ladungen zur Gesamtanzahl der Valenzelektronen. Bei einem Kation (positiv geladen) subtrahiere die Anzahl der positiven Ladungen.
- Bestimmung des Zentralatoms: Das Zentralatom ist in der Regel das am wenigsten elektronegative Atom (außer Wasserstoff). Wasserstoff ist niemals das Zentralatom. Wenn Kohlenstoff vorhanden ist, ist er fast immer das Zentralatom.
- Zeichnen des Skeletts: Verbinde das Zentralatom mit den anderen Atomen durch Einfachbindungen (ein Elektronenpaar).
- Verteilung der restlichen Valenzelektronen: Verteile die restlichen Valenzelektronen als freie Elektronenpaare (nicht-bindende Elektronenpaare) um die Atome, beginnend mit den elektronegativeren Atomen, bis jedes Atom (außer Wasserstoff) ein Oktett (oder Duett für Wasserstoff) erreicht hat.
- Bildung von Mehrfachbindungen: Wenn das Zentralatom weniger als ein Oktett hat, verschiebe freie Elektronenpaare von den umliegenden Atomen zu Bindungen zwischen dem Zentralatom und diesen Atomen, um Doppel- oder Dreifachbindungen zu bilden, bis das Zentralatom ein Oktett erreicht hat.
- Überprüfung der formalen Ladungen: Berechne die formale Ladung jedes Atoms in der Lewis-Formel. Die formale Ladung wird berechnet als:
Formale Ladung = (Anzahl der Valenzelektronen des freien Atoms) - (Anzahl der nicht-bindenden Elektronen) - (1/2 * Anzahl der bindenden Elektronen)
Ziel ist es, eine Lewis-Formel mit minimalen formalen Ladungen zu erhalten.
Beispiele für die Erstellung von Lewis-Formeln
Beispiel 1: Wasser (H2O)
- Gesamtanzahl Valenzelektronen: 2 * (1 Valenzelektron für H) + 6 Valenzelektronen für O = 8 Valenzelektronen
- Zentralatom: Sauerstoff (O)
- Skelett: H-O-H
- Verteilung der restlichen Valenzelektronen: Verteile die restlichen 4 Elektronenpaare (8 Elektronen) um den Sauerstoff. Sauerstoff erhält zwei freie Elektronenpaare.
- Finale Lewis-Formel: H-O-H (mit zwei freien Elektronenpaaren am Sauerstoff)
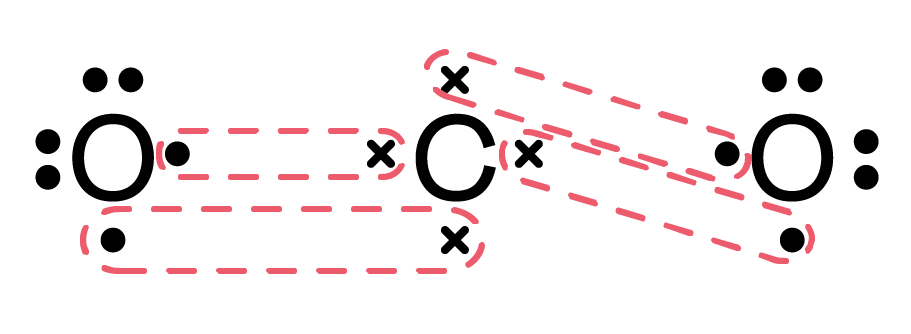
Beispiel 2: Kohlendioxid (CO2)
- Gesamtanzahl Valenzelektronen: 4 Valenzelektronen für C + 2 * (6 Valenzelektronen für O) = 16 Valenzelektronen
- Zentralatom: Kohlenstoff (C)
- Skelett: O-C-O
- Verteilung der restlichen Valenzelektronen: Verteile die restlichen Elektronenpaare um die Sauerstoffatome. Jedes Sauerstoffatom erhält drei freie Elektronenpaare. Nun hat Kohlenstoff nur 4 Elektronen um sich herum.
- Bildung von Mehrfachbindungen: Verschiebe je ein freies Elektronenpaar von jedem Sauerstoffatom zu einer Doppelbindung mit dem Kohlenstoffatom.
- Finale Lewis-Formel: O=C=O (jedes Sauerstoffatom hat zwei freie Elektronenpaare)
Beispiel 3: Ammonium-Ion (NH4+)
- Gesamtanzahl Valenzelektronen: 5 Valenzelektronen für N + 4 * (1 Valenzelektron für H) - 1 (wegen der positiven Ladung) = 8 Valenzelektronen
- Zentralatom: Stickstoff (N)
- Skelett: Verbinde das Stickstoffatom mit den vier Wasserstoffatomen.
- Verteilung der restlichen Valenzelektronen: Alle Valenzelektronen werden für die N-H-Bindungen verwendet. Es gibt keine freien Elektronenpaare.
- Finale Lewis-Formel: [H-N-H]+ (mit vier N-H-Bindungen und der gesamten Struktur in Klammern mit einem '+' als Ladung). Es gibt keine freien Elektronenpaare am Stickstoff. Jedes H ist einfach an N gebunden.
Bedeutung und Anwendung der Lewis-Formel
Die Lewis-Formel ist ein wichtiges Werkzeug für Chemiker und Studierende der Chemie, da sie:
- Vorhersage der Molekülgeometrie: Die Lewis-Formel hilft, die räumliche Anordnung von Atomen in einem Molekül vorherzusagen (Molekülgeometrie). Dies ist wichtig, um die physikalischen und chemischen Eigenschaften der Substanz zu verstehen.
- Vorhersage der Polarität von Molekülen: Die Verteilung der Elektronen in der Lewis-Formel gibt Aufschluss über die Polarität der Bindungen und des gesamten Moleküls. Polare Moleküle haben ein Dipolmoment und können stärkere intermolekulare Kräfte aufweisen.
- Verständnis der Reaktivität: Die Lewis-Formel zeigt, welche Atome oder Atomgruppen in einem Molekül besonders reaktiv sind, z.B. aufgrund von freien Elektronenpaaren oder positiven/negativen Ladungen.
- Bestimmung von Resonanzstrukturen: Manchmal kann ein Molekül nicht durch eine einzige Lewis-Formel adäquat beschrieben werden. In solchen Fällen existieren mehrere Resonanzstrukturen, die die tatsächliche Elektronenverteilung besser darstellen. Die tatsächliche Struktur ist dann ein Hybrid der verschiedenen Resonanzstrukturen.
Ausnahmen von der Oktettregel
Obwohl die Oktettregel ein nützliches Werkzeug ist, gibt es auch Ausnahmen:
- Moleküle mit ungerader Anzahl von Elektronen: Einige Moleküle, wie Stickstoffmonoxid (NO), haben eine ungerade Anzahl von Valenzelektronen und können daher die Oktettregel nicht erfüllen.
- Moleküle mit weniger als einem Oktett: Einige Atome, wie Bor (B) und Beryllium (Be), können stabile Moleküle bilden, in denen sie weniger als acht Elektronen um sich herum haben (z.B. Bortrifluorid, BF3).
- Erweiterte Oktetts: Atome der dritten Periode und darunter (z.B. Schwefel, Phosphor) können mehr als acht Elektronen in ihrer Valenzschale aufnehmen, da sie zusätzliche d-Orbitale zur Verfügung haben (z.B. Schwefelhexafluorid, SF6).
Tipps und Tricks für die Erstellung von Lewis-Formeln
- Üben Sie regelmäßig, um ein Gefühl für die Verteilung der Valenzelektronen zu entwickeln.
- Verwenden Sie ein Periodensystem, um die Anzahl der Valenzelektronen jedes Atoms zu bestimmen.
- Achten Sie auf die Ladung von Ionen und berücksichtigen Sie diese bei der Berechnung der Gesamtanzahl der Valenzelektronen.
- Überprüfen Sie immer die formalen Ladungen, um die wahrscheinlichste Lewis-Formel zu ermitteln.
- Seien Sie sich der Ausnahmen von der Oktettregel bewusst.
Die Lewis-Formel ist ein grundlegendes Konzept in der Chemie, das Ihnen helfen wird, die Struktur, Reaktivität und Eigenschaften chemischer Verbindungen besser zu verstehen. Durch das Verständnis der Regeln und Prinzipien der Lewis-Formel können Sie komplexe chemische Probleme lösen und Ihr Wissen in der Chemie vertiefen. Insbesondere für Neuankömmlinge in deutschsprachigen Ländern, die sich mit der Chemie beschäftigen, ist es wichtig, die Terminologie und die Konzepte in deutscher Sprache zu beherrschen. Nutzen Sie Übungsaufgaben und Beispiele, um Ihre Fähigkeiten zu verbessern und die Lewis-Formel sicher anzuwenden.
Wichtiger Hinweis: Die Lewis-Formel ist eine vereinfachte Darstellung der Elektronenverteilung und berücksichtigt nicht alle Aspekte der chemischen Bindung. Für ein tieferes Verständnis sind fortgeschrittene Konzepte wie die Molekülorbitaltheorie erforderlich.
Für weitere Informationen und Übungsaufgaben empfehlen sich Lehrbücher der Allgemeinen Chemie, Online-Tutorials und Übungsplattformen. Viele Universitäten und Hochschulen bieten auch Kurse in Chemie an, die speziell auf die Bedürfnisse von internationalen Studierenden zugeschnitten sind.
Viel Erfolg beim Lernen und Anwenden der Lewis-Formel!
![Was Ist Die Lewis Formel Lewis Formel • Beispiele, Elektronenschreibweise · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/07/WP-Bilder_Lewis_Formel_Stickstoffdioxid-1-1024x576.jpg)


![Was Ist Die Lewis Formel Lewis Formel • Beispiele, Elektronenschreibweise · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/07/WP-Bilder_Lewis_Formel_Wasser-1024x576.jpg)
![Was Ist Die Lewis Formel Lewis Formel • Beispiele, Elektronenschreibweise · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/Lewis_Formel-Stickstoffdioxid-1024x576.png)
![Was Ist Die Lewis Formel Lewis Formel • Beispiele, Elektronenschreibweise · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/07/WP-Bilder_Lewis_Formel_O2-1024x576.jpg)