Was Ist Ein Dipol Chemie
In der Chemie begegnet man oft dem Begriff "Dipol". Aber was genau verbirgt sich dahinter? Dieser Artikel erklärt das Konzept eines Dipols einfach und verständlich, ideal für Neuankömmlinge in Deutschland oder alle, die ihr chemisches Grundwissen auffrischen möchten.
Was ist ein Dipol? Eine einfache Definition
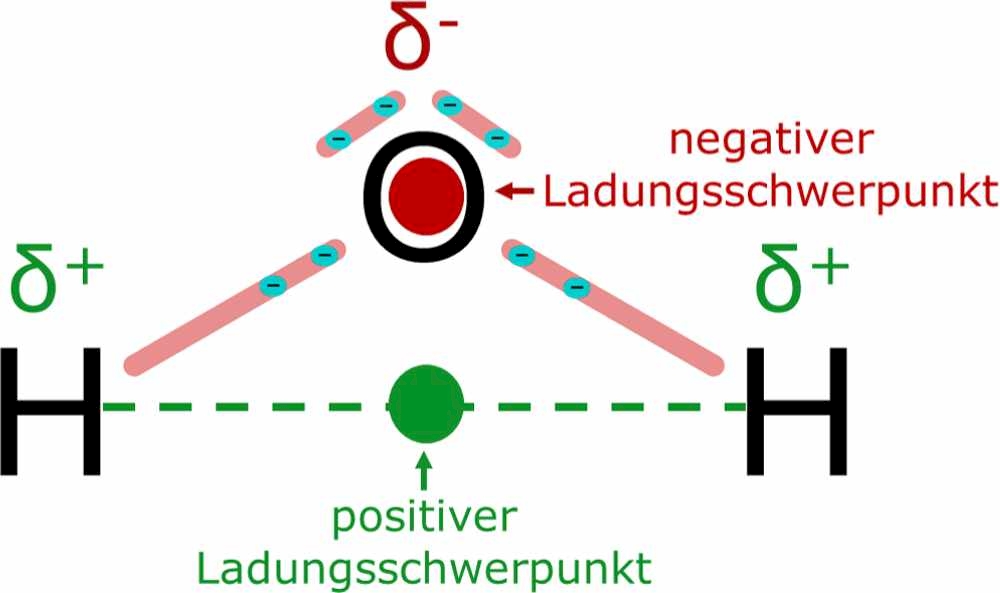
Ein Dipol, abgeleitet vom griechischen "di" (zwei) und "polos" (Pol), beschreibt eine Ladungstrennung innerhalb eines Systems, typischerweise eines Moleküls. Stellen Sie sich vor, es gibt zwei "Pole" – einen positiven und einen negativen – die sich in einem bestimmten Abstand voneinander befinden. Diese Ungleichverteilung der elektrischen Ladung führt zu einem Dipolmoment, einer vektoriellen Größe, die Richtung und Stärke des Dipols angibt.
Der Unterschied zwischen polaren und unpolaren Bindungen
Um das Konzept des Dipols besser zu verstehen, ist es wichtig, den Unterschied zwischen polaren und unpolaren Bindungen zu kennen. Eine chemische Bindung entsteht, wenn sich Atome Elektronen teilen, um eine stabilere elektronische Konfiguration zu erreichen.
- Unpolare Bindung: Wenn zwei Atome mit gleicher oder sehr ähnlicher Elektronegativität eine Bindung eingehen, teilen sie sich die Elektronen gleichmäßig. Es entsteht keine Ladungstrennung, und die Bindung ist unpolar. Ein typisches Beispiel ist die Bindung zwischen zwei Kohlenstoffatomen (C-C) oder zwischen zwei Wasserstoffatomen (H-H).
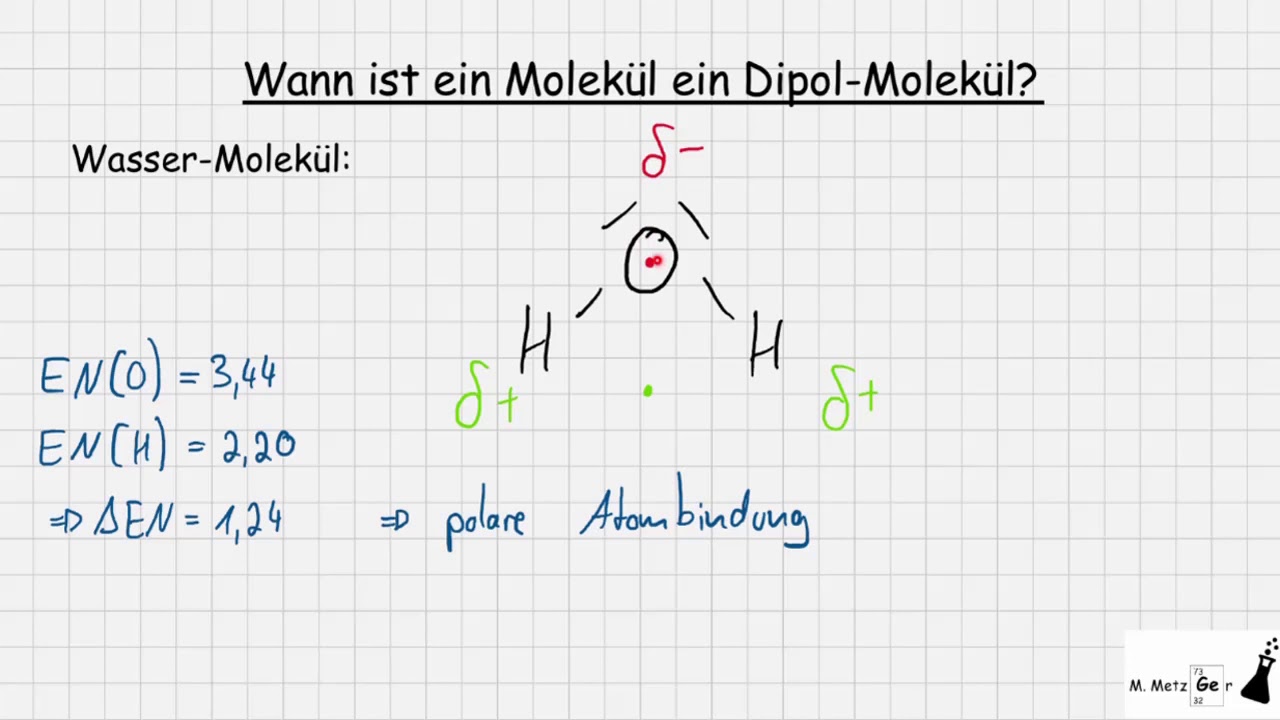
- Polare Bindung: Wenn zwei Atome mit unterschiedlicher Elektronegativität eine Bindung eingehen, zieht das elektronegativere Atom die Elektronen stärker an sich. Dadurch entsteht eine partielle negative Ladung (δ-) an diesem Atom und eine partielle positive Ladung (δ+) am weniger elektronegativen Atom. Diese Ladungstrennung führt zu einer polaren Bindung. Ein bekanntes Beispiel ist die Bindung zwischen Sauerstoff und Wasserstoff (O-H) im Wassermolekül. Sauerstoff ist deutlich elektronegativer als Wasserstoff und zieht daher die Elektronen stärker an sich.
Die Elektronegativität ist ein Maß dafür, wie stark ein Atom Elektronen in einer chemischen Bindung an sich zieht. Je größer der Unterschied in der Elektronegativität zwischen zwei Atomen, desto polarer ist die Bindung.
Dipolmoment und Molekülgeometrie
Ob ein Molekül als Ganzes ein Dipolmoment besitzt, hängt nicht nur von der Polarität der einzelnen Bindungen ab, sondern auch von der Molekülgeometrie. Die Dipolmomente der einzelnen Bindungen sind Vektoren. Das bedeutet, sie haben sowohl eine Größe (Stärke der Ladungstrennung) als auch eine Richtung (von der positiven zur negativen Ladung). Wenn sich die Dipolmomente der einzelnen Bindungen gegenseitig aufheben, ist das Molekül insgesamt unpolar, obwohl es polare Bindungen enthalten kann.
Betrachten wir folgende Beispiele:
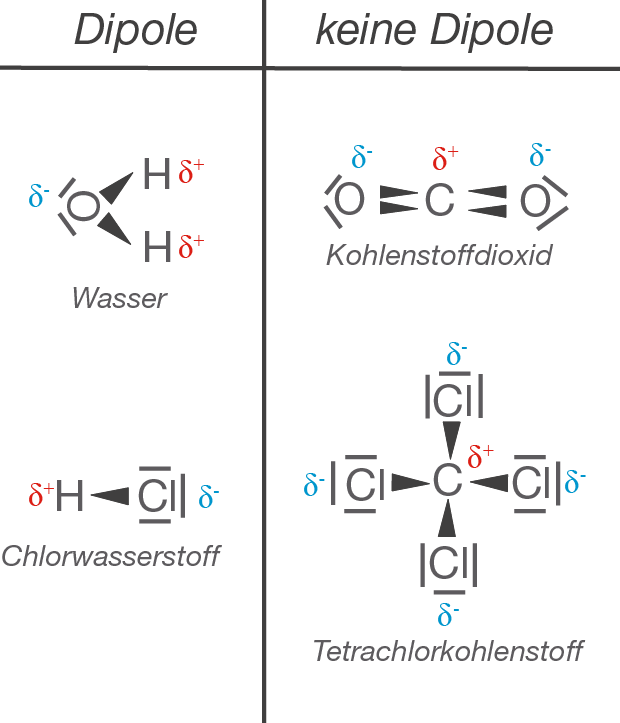
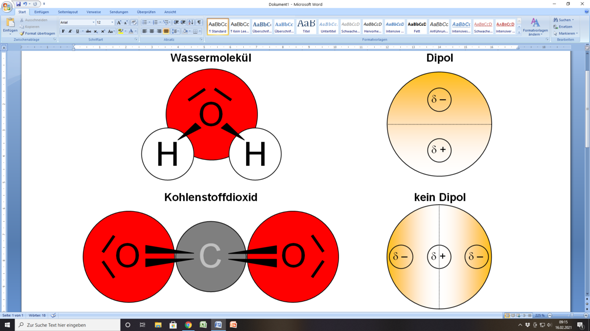
- Wasser (H2O): Das Wassermolekül hat eine gewinkelte Geometrie. Die beiden O-H-Bindungen sind polar, und ihre Dipolmomente addieren sich, anstatt sich aufzuheben. Daher ist Wasser ein polares Molekül und besitzt ein signifikantes Dipolmoment.
- Kohlenstoffdioxid (CO2): Kohlenstoffdioxid hat eine lineare Geometrie (O=C=O). Die beiden C=O-Bindungen sind polar, aber ihre Dipolmomente zeigen in entgegengesetzte Richtungen und heben sich somit auf. Daher ist Kohlenstoffdioxid ein unpolares Molekül, obwohl es polare Bindungen enthält.
- Tetrachlormethan (CCl4): Tetrachlormethan hat eine tetraedrische Geometrie. Die vier C-Cl-Bindungen sind polar, aber aufgrund der Symmetrie des Moleküls heben sich die Dipolmomente der einzelnen Bindungen auf. Daher ist Tetrachlormethan ein unpolares Molekül.
Zusammenfassend lässt sich sagen: Ein Molekül ist nur dann polar, wenn es polare Bindungen enthält und die Molekülgeometrie so ist, dass sich die Dipolmomente der einzelnen Bindungen nicht aufheben.
Messung des Dipolmoments
Das Dipolmoment (μ) ist eine physikalische Größe, die die Polarität eines Moleküls quantitativ beschreibt. Es wird definiert als das Produkt aus der Größe der Ladung (q) und dem Abstand (r) zwischen den Ladungen:
μ = q * r
Die Einheit des Dipolmoments ist das Debye (D). Ein Debye entspricht 3.336 × 10-30 Coulombmeter (C·m). Das Dipolmoment kann experimentell durch Messung der Dielektrizitätskonstante einer Substanz bestimmt werden. Die Dielektrizitätskonstante ist ein Maß dafür, wie gut ein Material ein elektrisches Feld speichern kann. Polare Substanzen haben in der Regel höhere Dielektrizitätskonstanten als unpolare Substanzen.
Bedeutung von Dipolen in der Chemie
Dipole spielen eine entscheidende Rolle in vielen chemischen und physikalischen Prozessen. Hier sind einige wichtige Beispiele:
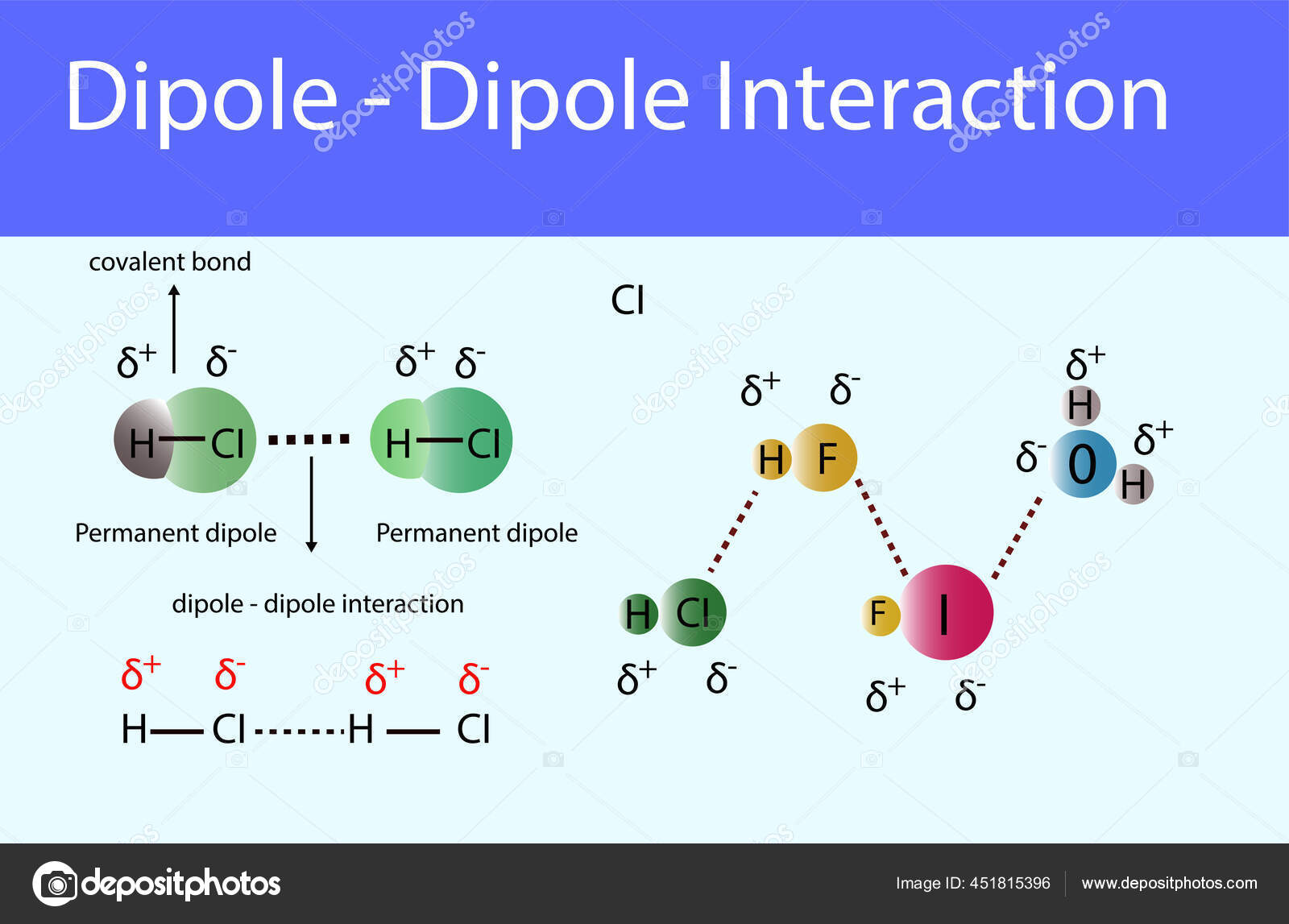
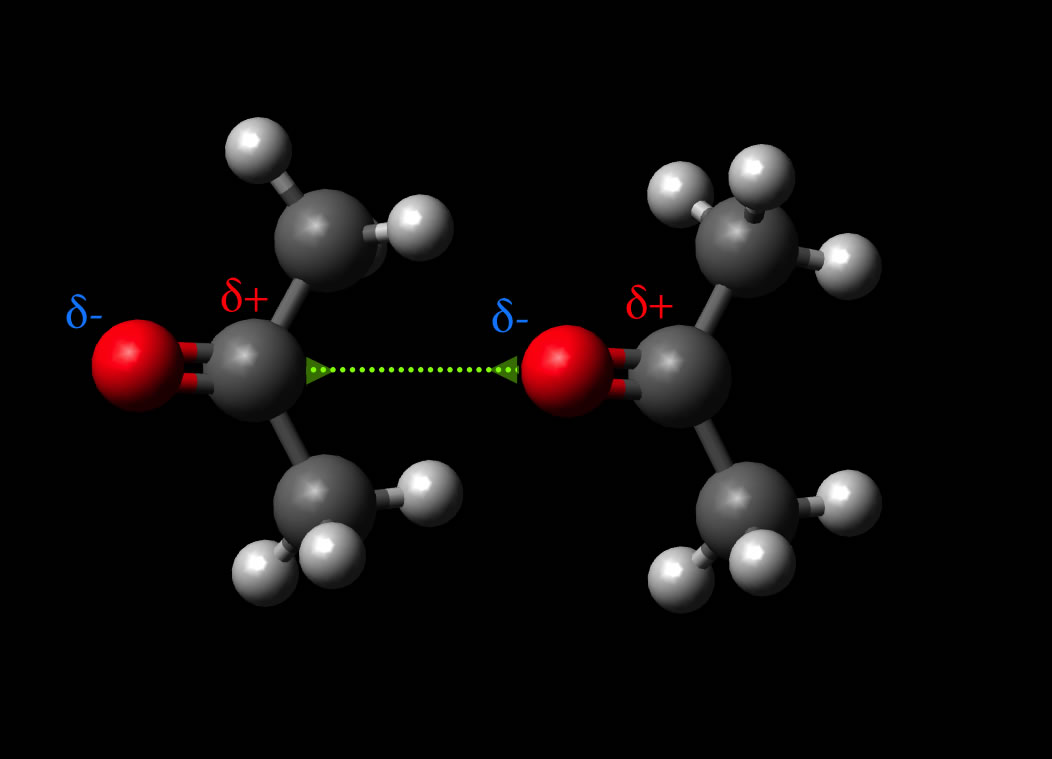
- Zwischenmolekulare Kräfte: Polare Moleküle können aufgrund von Dipol-Dipol-Wechselwirkungen, Wasserstoffbrückenbindungen und Dipol-induzierte Dipol-Wechselwirkungen stärkere zwischenmolekulare Kräfte ausbilden als unpolare Moleküle. Diese stärkeren Kräfte beeinflussen Eigenschaften wie Siedepunkt, Schmelzpunkt, Viskosität und Oberflächenspannung. Beispielsweise hat Wasser (H2O) aufgrund seiner Polarität und der Bildung von Wasserstoffbrücken einen relativ hohen Siedepunkt im Vergleich zu Molekülen ähnlicher Größe.
- Löslichkeit: "Gleiches löst Gleiches" ist ein bekannter Grundsatz in der Chemie. Polare Substanzen lösen sich gut in polaren Lösungsmitteln, während unpolare Substanzen sich gut in unpolaren Lösungsmitteln lösen. Dies liegt daran, dass polare Lösungsmittel die zwischenmolekularen Kräfte zwischen den polaren Molekülen der gelösten Substanz überwinden können. Unpolare Lösungsmittel können die zwischenmolekularen Kräfte zwischen den unpolaren Molekülen der gelösten Substanz ebenfalls effektiv überwinden. Öl (unpolar) und Wasser (polar) mischen sich beispielsweise nicht, da die zwischenmolekularen Kräfte zwischen den Wassermolekülen stärker sind als die Wechselwirkungen zwischen Öl- und Wassermolekülen.
- Chemische Reaktionen: Die Polarität von Molekülen beeinflusst die Art und Weise, wie sie miteinander reagieren. Beispielsweise können polare Moleküle leichter an nucleophilen oder elektrophilen Angriffen teilnehmen. Die Ladungsverteilung in polaren Molekülen macht bestimmte Stellen anfälliger für Angriffe durch reaktive Spezies.
- Biologische Systeme: Dipole sind in biologischen Systemen allgegenwärtig. Wasser ist das Lösungsmittel des Lebens und seine Polarität ist entscheidend für die Struktur und Funktion von Biomolekülen wie Proteinen und Nukleinsäuren. Die Lipiddoppelschicht von Zellmembranen besteht aus polaren "Köpfen" und unpolaren "Schwänzen", was ihre Struktur und Permeabilität bestimmt.
Ein kurzes Beispiel: Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen sind ein besonders starker Typ der Dipol-Dipol-Wechselwirkung, der auftritt, wenn ein Wasserstoffatom an ein stark elektronegatives Atom wie Sauerstoff, Stickstoff oder Fluor gebunden ist. Das Wasserstoffatom trägt eine signifikante positive Partialladung (δ+), und das elektronegative Atom trägt eine signifikante negative Partialladung (δ-). Diese starke Ladungstrennung führt zu einer starken Anziehung zwischen dem Wasserstoffatom und einem anderen elektronegativen Atom in einem benachbarten Molekül. Wasserstoffbrückenbindungen sind für viele wichtige Eigenschaften von Wasser verantwortlich, wie z. B. seinen hohen Siedepunkt, seine hohe Oberflächenspannung und seine Fähigkeit, viele Substanzen zu lösen. Sie spielen auch eine entscheidende Rolle bei der Stabilisierung der Struktur von Proteinen und DNA.
Fazit
Das Konzept des Dipols ist grundlegend für das Verständnis vieler chemischer und physikalischer Eigenschaften von Molekülen und Stoffen. Die Ladungstrennung innerhalb eines Moleküls, die durch Unterschiede in der Elektronegativität und die Molekülgeometrie bestimmt wird, beeinflusst die zwischenmolekularen Kräfte, die Löslichkeit, die Reaktivität und viele andere wichtige Phänomene. Indem Sie die Prinzipien des Dipols verstehen, können Sie die Welt der Chemie besser erfassen und die Eigenschaften von Stoffen vorhersagen und erklären.
![Was Ist Ein Dipol Chemie Dipol • Induzierter Dipol, Dipolmoleküle, Wasser · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/03/WP_Wassermolekuel-als-Dipol-1024x576.jpg)
![Was Ist Ein Dipol Chemie Dipol • Induzierter Dipol, Dipolmoleküle, Wasser · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/03/WP_Wasser-als-Dipolmolekuel-1024x576.jpg)


![Was Ist Ein Dipol Chemie Dipol • Induzierter Dipol, Dipolmoleküle, Wasser · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/03/WP_Molekuel-Symmetrie-1024x576.jpg)


![Was Ist Ein Dipol Chemie Dipol-Dipol-Wechselwirkung • Ursache, Dipolmoment · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/03/WordPress_temporaer-vs.-induziert-1024x576.jpg)



![Was Ist Ein Dipol Chemie Dipol-Dipol-Wechselwirkung • Ursache, Dipolmoment · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/03/WordPress_Dipol_Dipol-Salzsaeure-1024x576.jpg)

