Was Ist Eine Kovalente Bindung
Herzlich willkommen in der faszinierenden Welt der Chemie! Vielleicht planst du einen Aufenthalt in Deutschland, bist gerade erst angekommen, oder interessierst dich einfach für die Sprache und die wissenschaftlichen Konzepte, die dahinter stecken. In diesem Artikel tauchen wir in ein spannendes Thema ein: die kovalente Bindung. Keine Sorge, wir werden es einfach und verständlich erklären, sodass du auch ohne Vorkenntnisse alles nachvollziehen kannst.
Was ist überhaupt eine chemische Bindung?
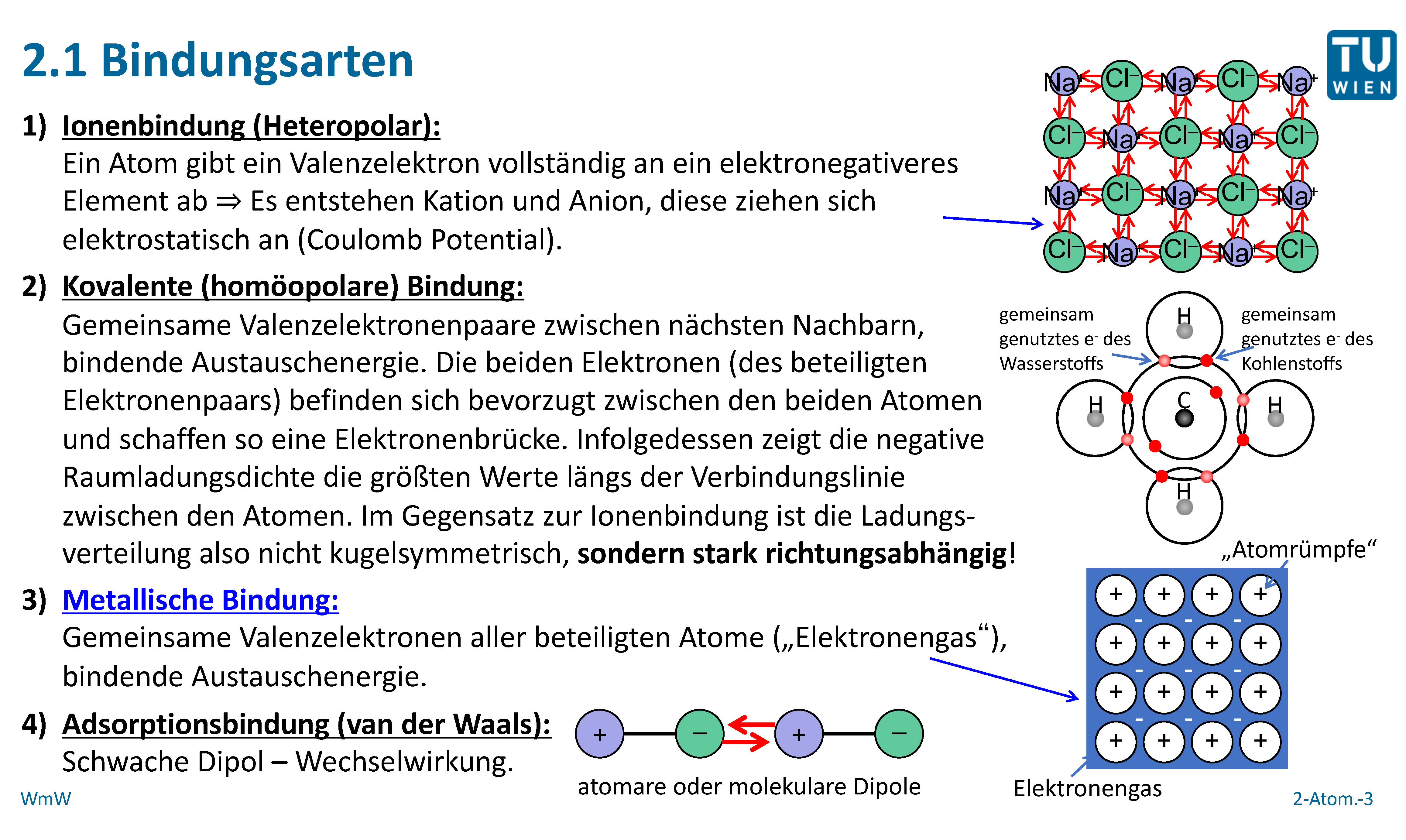
Bevor wir uns der kovalenten Bindung widmen, lass uns kurz klären, was eine chemische Bindung im Allgemeinen ist. Stell dir vor, Atome sind wie winzige Bausteine, die sich verbinden müssen, um stabil zu werden und größere Strukturen – Moleküle – zu bilden. Diese Verbindung erfolgt durch chemische Bindungen. Es gibt verschiedene Arten von chemischen Bindungen, und jede hat ihre eigenen Eigenschaften.
Chemische Bindungen entstehen, weil Atome danach streben, eine stabile Elektronenkonfiguration zu erreichen. Das bedeutet, dass sie ihre äußere Elektronenschale, auch Valenzschale genannt, vollständig füllen wollen. Die Edelgase, wie Helium, Neon und Argon, haben von Natur aus eine solche voll besetzte Schale und sind daher sehr reaktionsträge. Alle anderen Atome müssen sich etwas einfallen lassen, um diesen Zustand zu erreichen. Eine Möglichkeit ist die Bildung von chemischen Bindungen.
Die kovalente Bindung: Das Teilen macht stark!
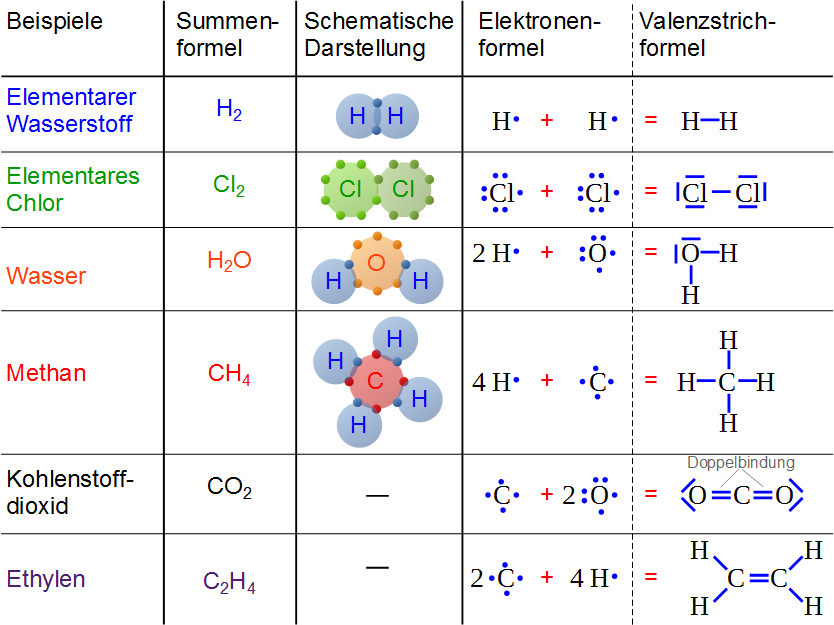
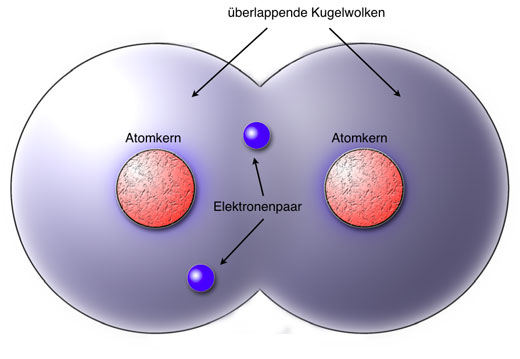
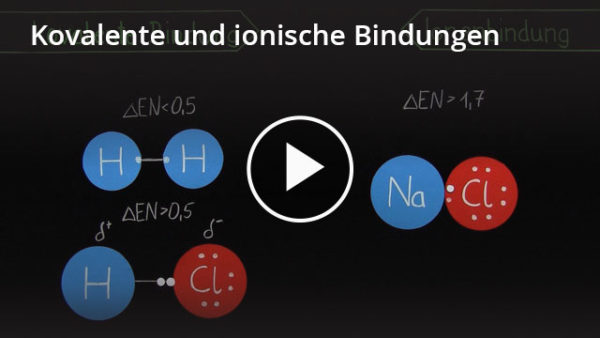
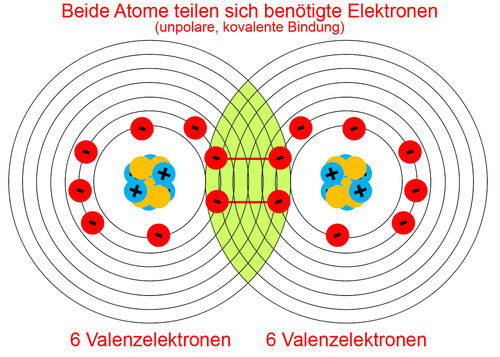
Nun zum eigentlichen Thema: Die kovalente Bindung, auf Deutsch auch Atombindung genannt, ist eine Art der chemischen Bindung, bei der sich zwei oder mehr Atome Elektronenpaare teilen, um eine stabile Elektronenkonfiguration zu erreichen. Denk daran, dass Atome ihre Valenzschale füllen wollen. Anstatt also Elektronen vollständig abzugeben oder aufzunehmen (wie es bei der Ionenbindung der Fall ist), tun sie sich zusammen und teilen sich die benötigten Elektronen.
Stell dir vor, zwei Freunde haben zusammen nur einen Kuchen. Anstatt sich darum zu streiten, teilen sie ihn fair auf. Genauso teilen sich Atome Elektronen, um eine Win-Win-Situation zu schaffen und eine stabilere Verbindung einzugehen.
Wie funktioniert das Teilen von Elektronen?
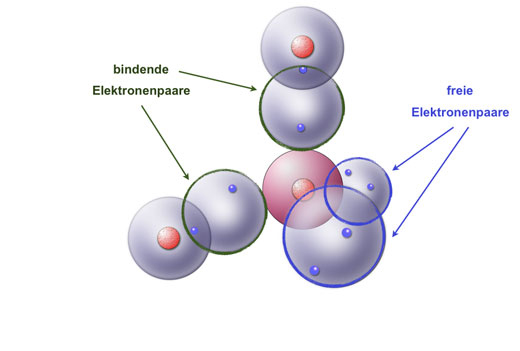
Die Elektronen, die geteilt werden, gehören nun beiden Atomen "gemeinsam". Das bedeutet, dass jedes Atom die geteilten Elektronen in seiner Valenzschale mitzählt, um seine gewünschte Anzahl an Elektronen zu erreichen. Die anziehende Kraft zwischen den positiv geladenen Atomkernen und den negativ geladenen, geteilten Elektronenpaaren hält die Atome zusammen und bildet die kovalente Bindung.
Beispiele für kovalente Bindungen
Kovalente Bindungen sind unglaublich häufig. Hier sind einige Beispiele, die du vielleicht kennst:
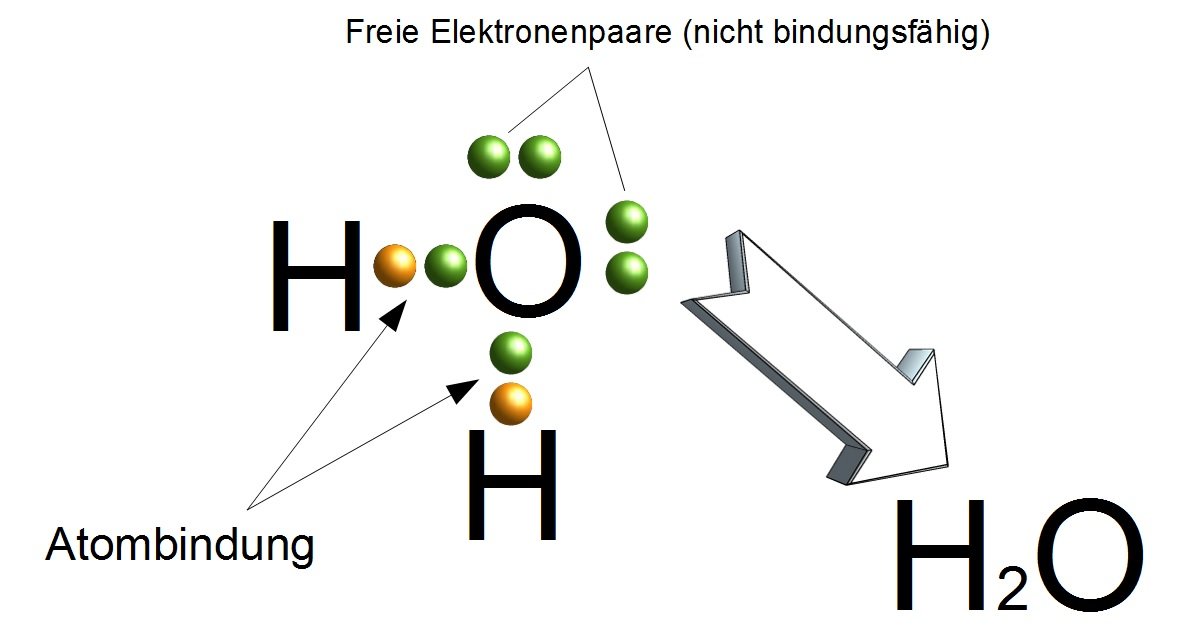
- Wasser (H2O): Jedes Sauerstoffatom teilt sich Elektronen mit zwei Wasserstoffatomen. Das Sauerstoffatom braucht zwei weitere Elektronen, um seine Valenzschale zu füllen, und jedes Wasserstoffatom braucht eines. Das Teilen führt zu einer stabilen Konfiguration für alle drei Atome.
- Methan (CH4): Ein Kohlenstoffatom teilt sich Elektronen mit vier Wasserstoffatomen. Kohlenstoff braucht vier weitere Elektronen, um seine Valenzschale zu füllen, und jedes Wasserstoffatom braucht eines.
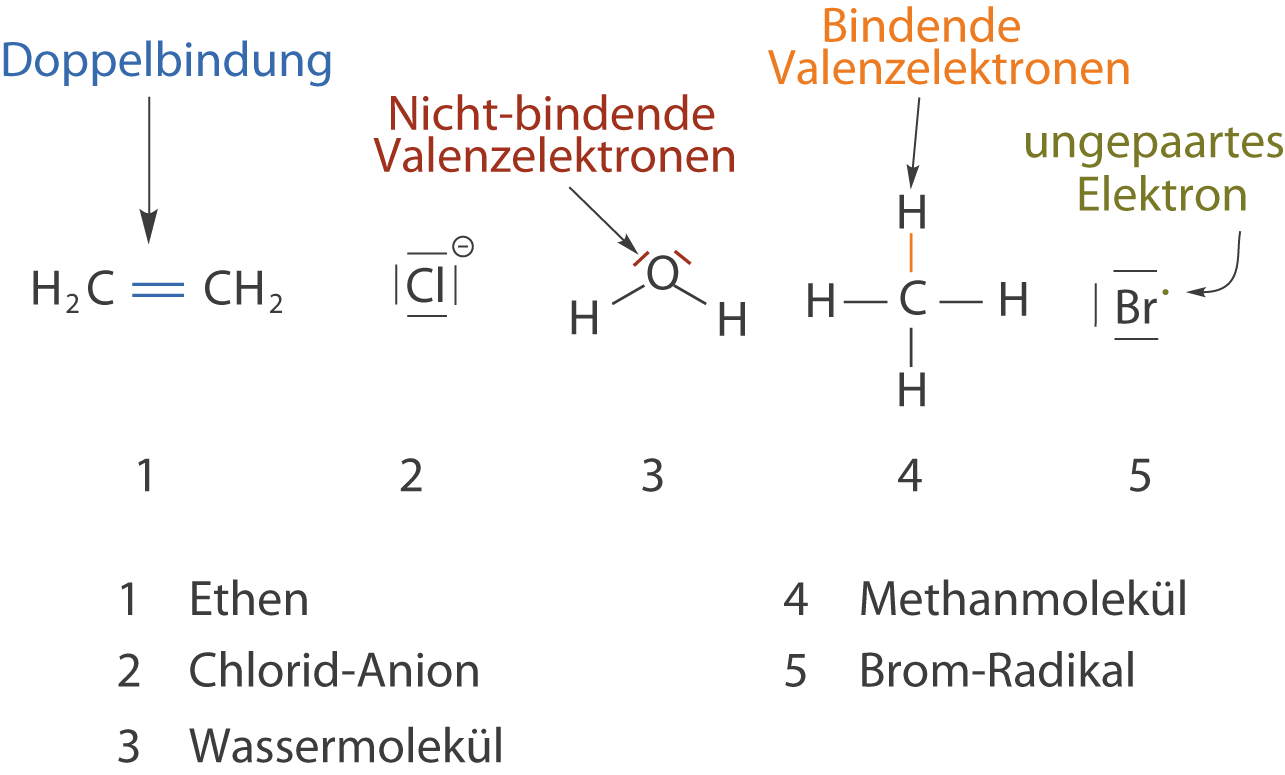
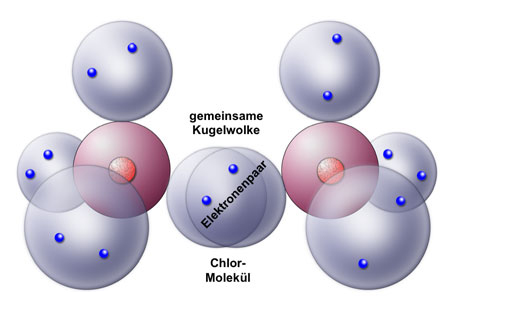
- Sauerstoffgas (O2): Zwei Sauerstoffatome teilen sich zwei Elektronenpaare (eine Doppelbindung) miteinander. Jedes Sauerstoffatom braucht zwei weitere Elektronen.
- Stickstoffgas (N2): Zwei Stickstoffatome teilen sich drei Elektronenpaare (eine Dreifachbindung) miteinander. Jedes Stickstoffatom braucht drei weitere Elektronen.
Polar und Unpolar: Nicht jede Teilung ist gleich!
Kovalente Bindungen können in zwei Haupttypen unterteilt werden: polare und unpolare.
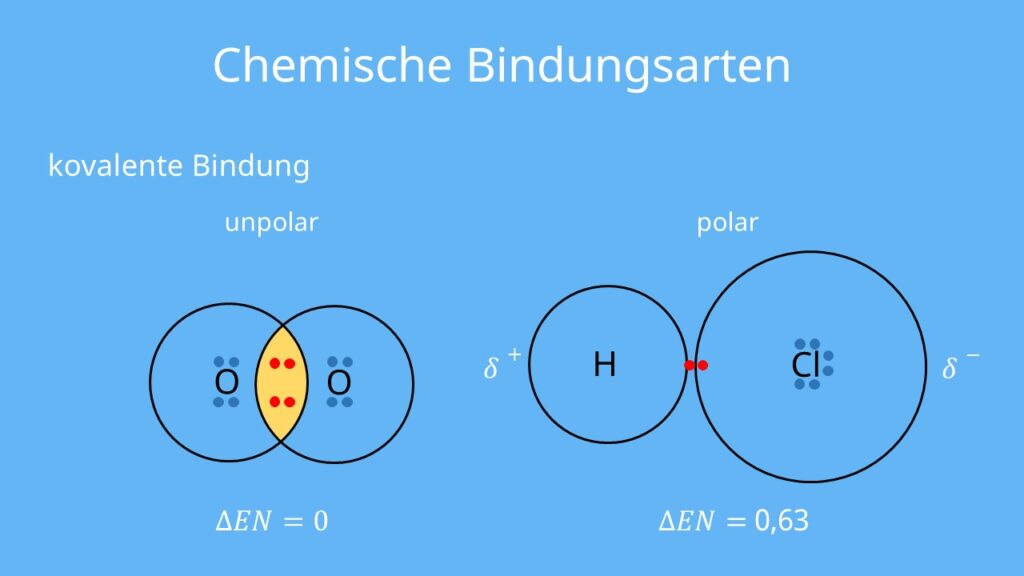
Unpolare kovalente Bindungen
Bei einer unpolaren kovalenten Bindung werden die Elektronen gleichmäßig zwischen den Atomen geteilt. Dies geschieht, wenn die Atome, die sich verbinden, die gleiche oder eine sehr ähnliche Elektronegativität haben. Elektronegativität ist ein Maß dafür, wie stark ein Atom Elektronen an sich zieht. Wenn zwei Atome die gleiche Elektronegativität haben, ziehen sie gleich stark an den Elektronen, und die Teilung ist fair. Ein gutes Beispiel hierfür ist die Bindung zwischen zwei gleichen Atomen, wie in Sauerstoffgas (O2) oder Wasserstoffgas (H2).
Polare kovalente Bindungen
Bei einer polaren kovalenten Bindung werden die Elektronen ungleichmäßig geteilt. Dies geschieht, wenn die Atome, die sich verbinden, unterschiedliche Elektronegativitäten haben. Das Atom mit der höheren Elektronegativität zieht stärker an den Elektronen als das Atom mit der niedrigeren Elektronegativität. Dadurch entsteht eine ungleiche Ladungsverteilung im Molekül. Das Atom, das stärker an den Elektronen zieht, erhält eine leicht negative Partialladung (δ-), während das Atom, das weniger stark zieht, eine leicht positive Partialladung (δ+) erhält.
Ein gutes Beispiel hierfür ist Wasser (H2O). Sauerstoff ist elektronegativer als Wasserstoff. Daher zieht das Sauerstoffatom die geteilten Elektronen stärker an sich als die Wasserstoffatome. Dadurch erhält das Sauerstoffatom eine leicht negative Partialladung (δ-) und die Wasserstoffatome jeweils eine leicht positive Partialladung (δ+). Diese ungleiche Ladungsverteilung macht das Wassermolekül polar.
Die Bedeutung der Polarität
Die Polarität von Molekülen hat einen großen Einfluss auf ihre Eigenschaften. Polare Moleküle können beispielsweise Wasserstoffbrückenbindungen bilden, die für viele biologische Prozesse von entscheidender Bedeutung sind. Die Polarität beeinflusst auch die Löslichkeit von Stoffen. "Gleiches löst Gleiches" ist ein wichtiger Grundsatz in der Chemie. Polare Stoffe lösen sich gut in polaren Lösungsmitteln (wie Wasser), während unpolare Stoffe sich gut in unpolaren Lösungsmitteln lösen (wie Öl).
Kovalente Bindungen und ihre Stärke
Die Stärke einer kovalenten Bindung hängt von verschiedenen Faktoren ab, unter anderem von der Anzahl der geteilten Elektronenpaare und der Größe der Atome.
- Einfachbindungen: Hier werden ein Elektronenpaar geteilt.
- Doppelbindungen: Hier werden zwei Elektronenpaare geteilt. Sie sind stärker und kürzer als Einfachbindungen.
- Dreifachbindungen: Hier werden drei Elektronenpaare geteilt. Sie sind die stärksten und kürzesten kovalenten Bindungen.
Im Allgemeinen sind kürzere Bindungen stärker als längere. Dies liegt daran, dass die anziehende Kraft zwischen den Atomkernen und den Elektronen umso größer ist, je näher sie sich sind.
Kovalente Bindungen im Alltag
Kovalente Bindungen sind überall um uns herum! Sie sind die Grundlage für das Leben, wie wir es kennen. Von den Molekülen, aus denen unser Körper besteht (wie Proteine, DNA und Kohlenhydrate), bis hin zu den Materialien, die wir in unserem täglichen Leben verwenden (wie Kunststoffe, Holz und Textilien) – fast alles enthält kovalente Bindungen.
Hier sind ein paar Beispiele:
- Kunststoffe: Viele Kunststoffe bestehen aus langen Ketten von Kohlenstoffatomen, die durch kovalente Bindungen verbunden sind.
- Medikamente: Die meisten Medikamente wirken, indem sie an bestimmte Moleküle in unserem Körper binden. Diese Bindungen sind oft kovalenter Natur.
- Nahrung: Die Nährstoffe, die wir aus unserer Nahrung gewinnen (wie Kohlenhydrate, Fette und Proteine), bestehen aus Molekülen, die durch kovalente Bindungen zusammengehalten werden.
Fazit
Die kovalente Bindung ist ein grundlegendes Konzept in der Chemie und spielt eine entscheidende Rolle in der Welt um uns herum. Sie ist eine Art der chemischen Bindung, bei der sich Atome Elektronenpaare teilen, um eine stabile Elektronenkonfiguration zu erreichen. Kovalente Bindungen können polar oder unpolar sein, je nachdem, wie gleichmäßig die Elektronen geteilt werden. Die Eigenschaften von Molekülen, die durch kovalente Bindungen zusammengehalten werden, hängen von der Stärke und Polarität der Bindungen ab. Wir hoffen, dieser kleine Ausflug in die Welt der Chemie hat dir gefallen! Wenn du dich für Wissenschaft interessierst, gibt es in Deutschland viele tolle Museen und Forschungseinrichtungen zu entdecken. Viel Spaß bei deiner Reise!

![Was Ist Eine Kovalente Bindung Kovalente Bindung • Polare Atombindung, Bindungsarten · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/09/Kovalente_Bindung_WP_3-1024x576.jpg)



![Was Ist Eine Kovalente Bindung Chemische Bindungen · Alle Bindungstypen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2018/12/WP-Bild_Chemische-Bindungsarten_1-1024x576.jpg)