Was Ist Eine Oxidation Chemie
Oxidation ist ein grundlegendes Konzept in der Chemie, das eine Vielzahl von Prozessen in unserer Umwelt und in industriellen Anwendungen erklärt. Für Neuankömmlinge in Deutschland oder Personen, die ihr chemisches Wissen auffrischen möchten, bietet dieser Artikel eine verständliche Einführung in das Thema.
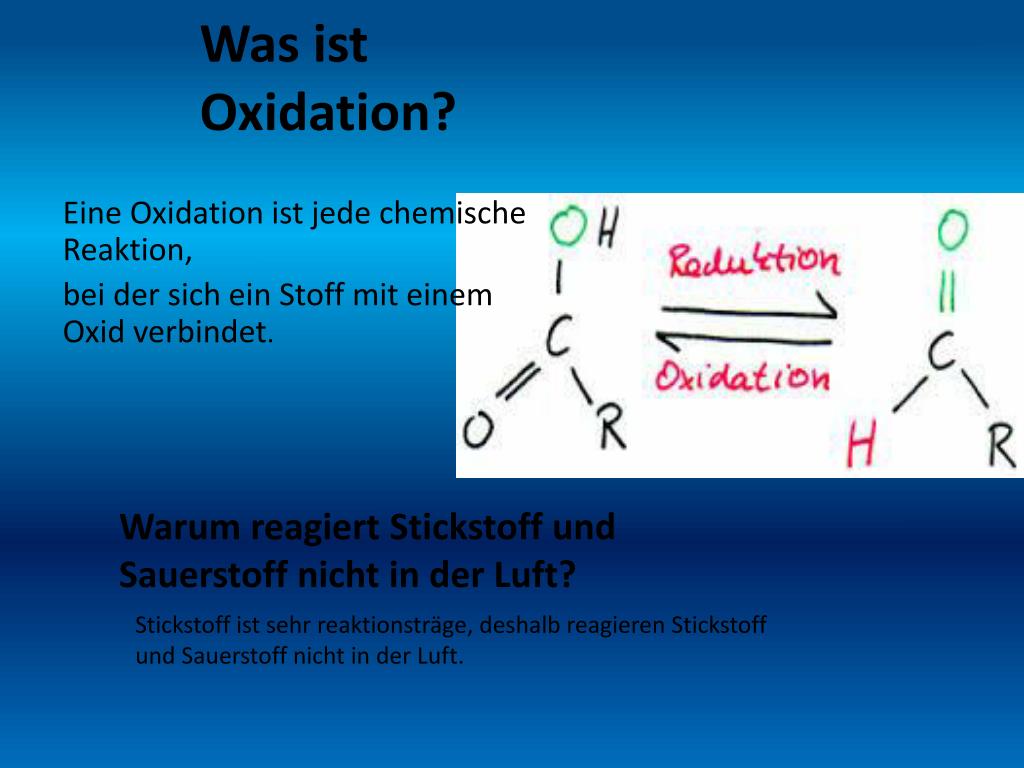
Was ist Oxidation?
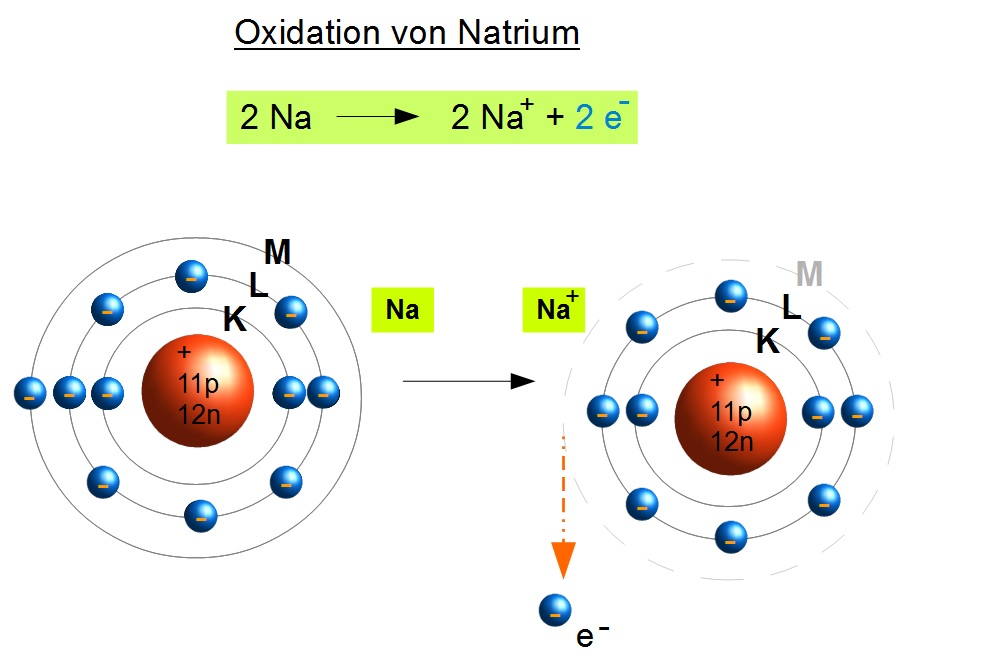
Im einfachsten Sinne beschreibt Oxidation den Prozess, bei dem ein Stoff Elektronen abgibt. Dieser Prozess geht fast immer mit der Reaktion eines Stoffes mit Sauerstoff einher, daher der Name. Allerdings ist die Definition von Oxidation umfassender als nur die Reaktion mit Sauerstoff. Es ist wichtig zu verstehen, dass Oxidation immer mit einer Reduktion einhergeht; zusammen bilden sie eine Redoxreaktion.
Vereinfachte Definition:
Oxidation ist die Abgabe von Elektronen durch einen Stoff.
Historischer Kontext
Ursprünglich wurde Oxidation tatsächlich nur als die Reaktion eines Stoffes mit Sauerstoff definiert. Dies liegt daran, dass viele der frühesten beobachteten Oxidationsreaktionen, wie das Verbrennen von Holz oder das Rosten von Eisen, Reaktionen mit Sauerstoff involvierten. Mit dem Fortschritt der Chemie und dem Verständnis der Atomstruktur und der Elektronen wurde die Definition erweitert, um alle Prozesse einzubeziehen, bei denen Elektronen übertragen werden.
Wie funktioniert Oxidation?
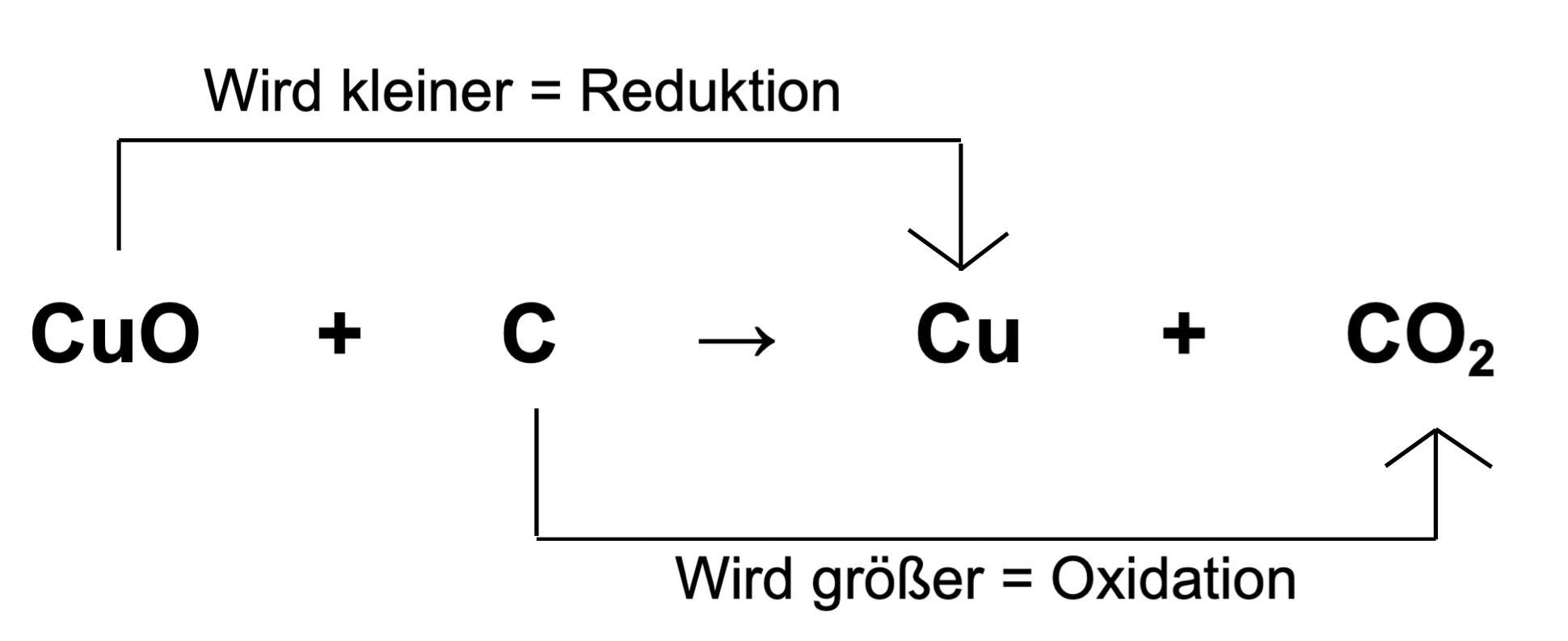
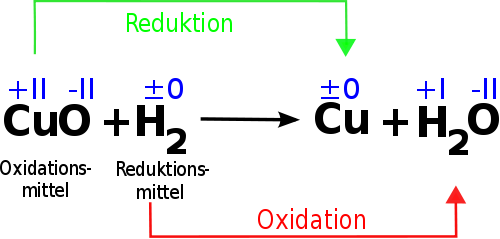
Um Oxidation wirklich zu verstehen, ist es wichtig, das Konzept der Oxidationszahlen zu kennen. Die Oxidationszahl eines Atoms ist eine Zahl, die die hypothetische Ladung angibt, die ein Atom hätte, wenn alle Bindungen ionisch wären. Bei der Oxidation erhöht sich die Oxidationszahl eines Atoms.
Beispiel: Rostbildung (Eisenoxidation)
Eisen (Fe) reagiert mit Sauerstoff (O2) und Wasser (H2O) zu Eisenoxid (Fe2O3), allgemein bekannt als Rost. In dieser Reaktion gibt Eisen Elektronen ab und wird oxidiert. Die Oxidationszahl von Eisen steigt von 0 (im elementaren Eisen) auf +3 (im Eisenoxid). Gleichzeitig nimmt Sauerstoff Elektronen auf und wird reduziert. Die Oxidationszahl von Sauerstoff sinkt von 0 (im elementaren Sauerstoff) auf -2 (im Eisenoxid). Die gesamte Reaktion lässt sich vereinfacht darstellen:
4 Fe (s) + 3 O2 (g) → 2 Fe2O3 (s)
Erklärung der Elektronenübertragung:
Eisenatome (Fe) verlieren jeweils drei Elektronen. Diese Elektronen werden von Sauerstoffatomen (O) aufgenommen. Der Verlust von Elektronen ist die Oxidation von Eisen, und die Aufnahme von Elektronen ist die Reduktion von Sauerstoff. Die Reduktion geht immer Hand in Hand mit der Oxidation.
Reduktion – Die Kehrseite der Medaille
Wie bereits erwähnt, ist Oxidation untrennbar mit der Reduktion verbunden. Reduktion ist der Prozess, bei dem ein Stoff Elektronen aufnimmt. Bei der Reduktion verringert sich die Oxidationszahl eines Atoms.
Vereinfachte Definition:
Reduktion ist die Aufnahme von Elektronen durch einen Stoff.
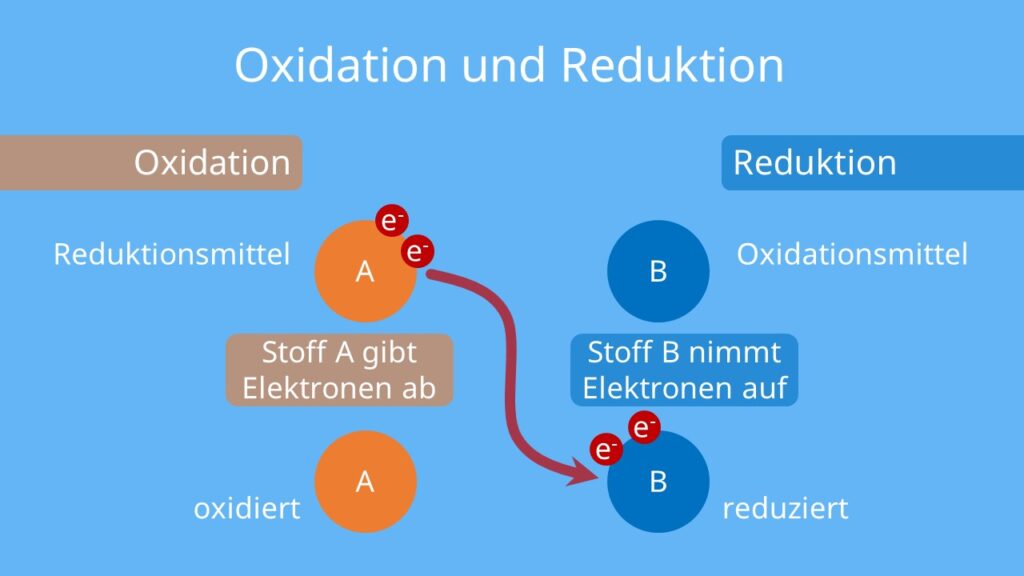
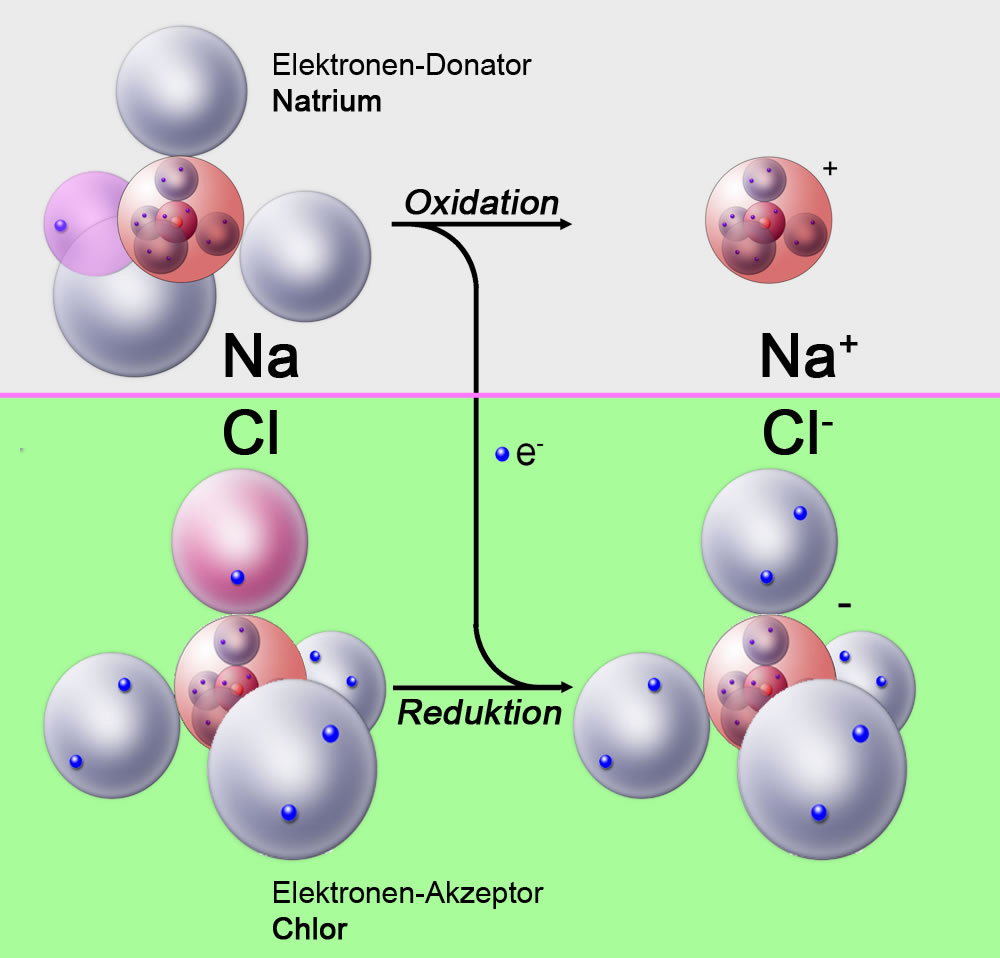
Da Elektronen weder verloren noch gewonnen werden können, ohne dass ein anderer Stoff sie aufnimmt oder abgibt, muss es immer einen Stoff geben, der oxidiert wird (Elektronen abgibt), und einen Stoff, der reduziert wird (Elektronen aufnimmt). Diese beiden Prozesse treten simultan auf und bilden die Grundlage für Redoxreaktionen.
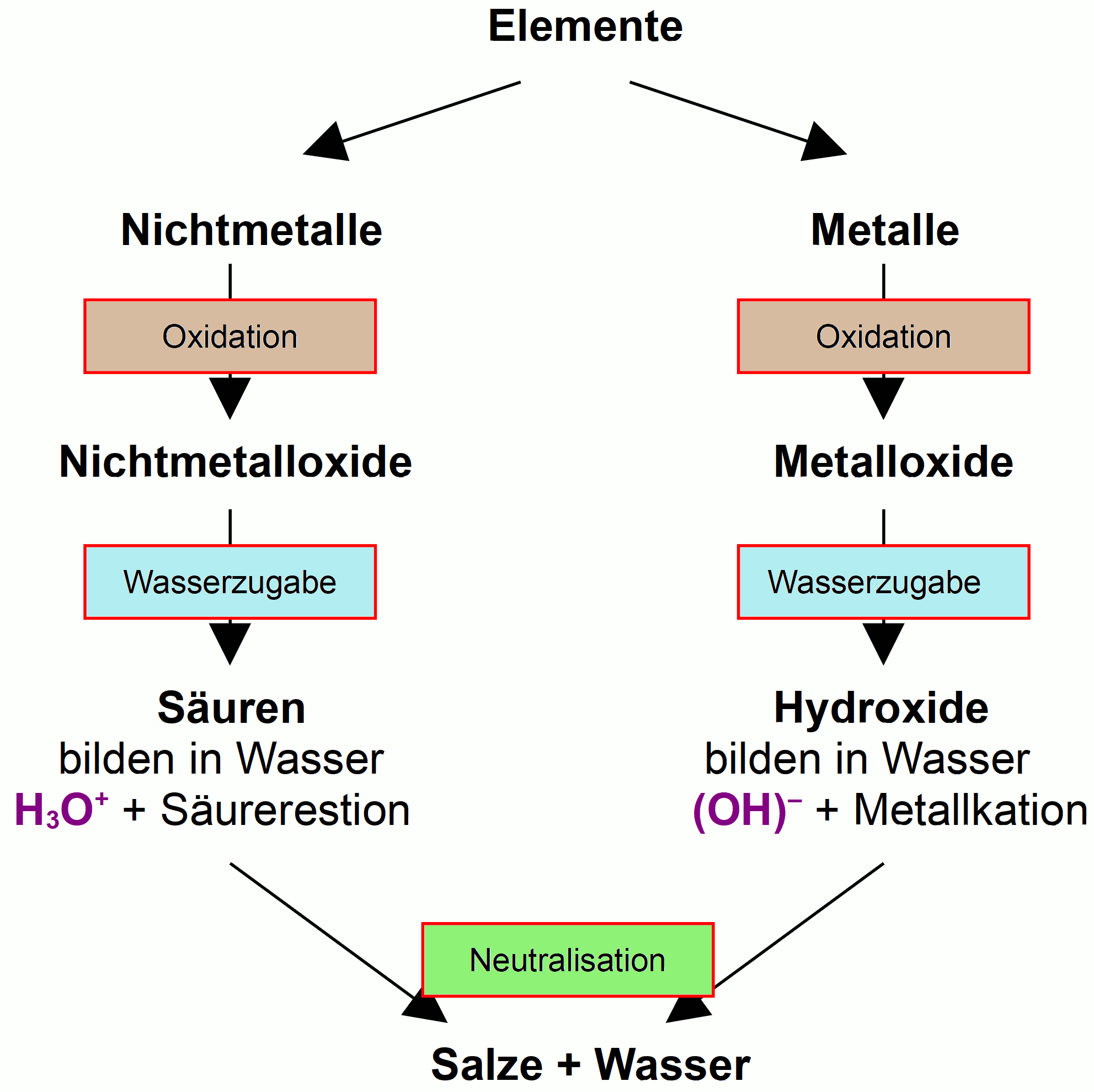
Redoxreaktionen (Oxidations-Reduktions-Reaktionen)
Der Begriff Redoxreaktion ist eine Zusammenfassung von Reduktion und Oxidation. Es beschreibt jede chemische Reaktion, bei der es zu einer Übertragung von Elektronen zwischen Atomen kommt.
Merkmale von Redoxreaktionen:
- Immer gekoppelte Prozesse: Oxidation und Reduktion treten gleichzeitig auf.
- Elektronenübertragung: Elektronen werden von einem Reaktanten zum anderen übertragen.
- Veränderung der Oxidationszahlen: Die Oxidationszahlen der beteiligten Atome ändern sich.
Beispiele für Redoxreaktionen
- Verbrennung: Das Verbrennen von Holz, Gas oder anderen Brennstoffen ist eine Redoxreaktion, bei der der Brennstoff mit Sauerstoff reagiert, Wärme und Licht freisetzt und oxidiert wird. Sauerstoff wird gleichzeitig reduziert.
- Batterien: Batterien nutzen Redoxreaktionen, um elektrische Energie zu erzeugen. In einer Batterie findet eine kontrollierte Redoxreaktion statt, bei der Elektronen von einer Elektrode zur anderen fließen und so einen elektrischen Strom erzeugen.
- Photosynthese: Pflanzen nutzen Photosynthese, um Sonnenlicht in chemische Energie umzuwandeln. Dabei wird Wasser oxidiert und Kohlendioxid reduziert, um Zucker (Glucose) zu bilden.
- Metallurgie: Viele metallurgische Prozesse, wie die Gewinnung von Metallen aus ihren Erzen, basieren auf Redoxreaktionen. Beispielsweise wird Eisen aus Eisenerz durch Reduktion von Eisenoxiden mit Kohlenstoff gewonnen.
Oxidationsmittel und Reduktionsmittel
In einer Redoxreaktion werden die beteiligten Stoffe als Oxidationsmittel und Reduktionsmittel bezeichnet.
- Oxidationsmittel: Ein Oxidationsmittel ist ein Stoff, der einen anderen Stoff oxidiert. Das Oxidationsmittel selbst wird dabei reduziert. Sauerstoff ist ein häufiges Oxidationsmittel.
- Reduktionsmittel: Ein Reduktionsmittel ist ein Stoff, der einen anderen Stoff reduziert. Das Reduktionsmittel selbst wird dabei oxidiert. Metalle wie Zink oder Eisen sind oft Reduktionsmittel.
Merke: Das Oxidationsmittel *nimmt* Elektronen auf und wird reduziert, während das Reduktionsmittel Elektronen *abgibt* und oxidiert wird.
Bedeutung der Oxidation in der Chemie und im Alltag
Oxidation ist ein allgegenwärtiger Prozess, der eine wichtige Rolle in vielen Bereichen spielt:
- Energiegewinnung: Viele Energieerzeugungsprozesse, wie die Verbrennung fossiler Brennstoffe und die Zellatmung, basieren auf Oxidationsreaktionen.
- Korrosion: Die Korrosion von Metallen, wie das Rosten von Eisen, ist eine unerwünschte Oxidationsreaktion, die Materialschäden verursacht.
- Biochemie: Redoxreaktionen spielen eine zentrale Rolle in vielen biochemischen Prozessen, wie der Photosynthese, der Zellatmung und der Enzymkatalyse.
- Industrie: Oxidation wird in vielen industriellen Prozessen eingesetzt, z.B. bei der Herstellung von Chemikalien, der Reinigung von Wasser und der Oberflächenbehandlung von Materialien.
- Lebensmittelchemie: Oxidation spielt eine Rolle beim Verderb von Lebensmitteln, kann aber auch in positiver Weise zur Entwicklung von Aromen beitragen (z.B. beim Reifen von Wein oder Käse).
Wie man Oxidation verhindert oder kontrolliert
Da Oxidation in vielen Fällen unerwünscht ist (z.B. bei Korrosion oder dem Verderb von Lebensmitteln), gibt es verschiedene Methoden, um Oxidation zu verhindern oder zu kontrollieren:
- Schutzschichten: Das Auftragen von Schutzschichten auf Metalle (z.B. Lacke, Farben, Öle) verhindert den Kontakt mit Sauerstoff und Wasser und somit die Korrosion.
- Antioxidantien: Antioxidantien sind Stoffe, die die Oxidation anderer Stoffe verlangsamen oder verhindern. Sie werden in Lebensmitteln, Kunststoffen und anderen Materialien eingesetzt, um deren Haltbarkeit zu verlängern. Vitamin C und Vitamin E sind bekannte Antioxidantien.
- Reduktionsmittel: Der Einsatz von Reduktionsmitteln kann unerwünschte Oxidationsreaktionen rückgängig machen.
- Kontrollierte Atmosphäre: Das Lagern von Lebensmitteln oder anderen Materialien in einer sauerstoffarmen oder sauerstofffreien Atmosphäre kann die Oxidation verlangsamen.
Zusammenfassend lässt sich sagen, dass Oxidation ein grundlegendes und allgegenwärtiges Konzept in der Chemie ist, das viele Prozesse in unserer Umwelt und in industriellen Anwendungen beeinflusst. Ein grundlegendes Verständnis von Oxidation und Reduktion ist daher unerlässlich, um die Welt um uns herum besser zu verstehen.
![Was Ist Eine Oxidation Chemie Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-von-sekundären-Alkohol-3-1024x576.jpg)
![Was Ist Eine Oxidation Chemie Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-Kohlenstoff-2-1024x576.jpg)
![Was Ist Eine Oxidation Chemie Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Vollständige-Oxidation-2-1024x576.jpg)


![Was Ist Eine Oxidation Chemie Was sind Redoxreaktionen? [Erläuterung & Beispiele]](https://images.cdn.sofatutor.net/content_images/images/17322/normal/Redoxreaktion.jpg?1702628607)
![Was Ist Eine Oxidation Chemie Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Ethanol-Oxidation-2-1024x576.jpg)

![Was Ist Eine Oxidation Chemie Redoxreaktion einfach erklärt • Oxidation & Reduktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/03_Redoxreaktion-als-Elektronenübertragung-1-1024x576.jpg)