Was Ist Eine Oxidation Und Reduktion

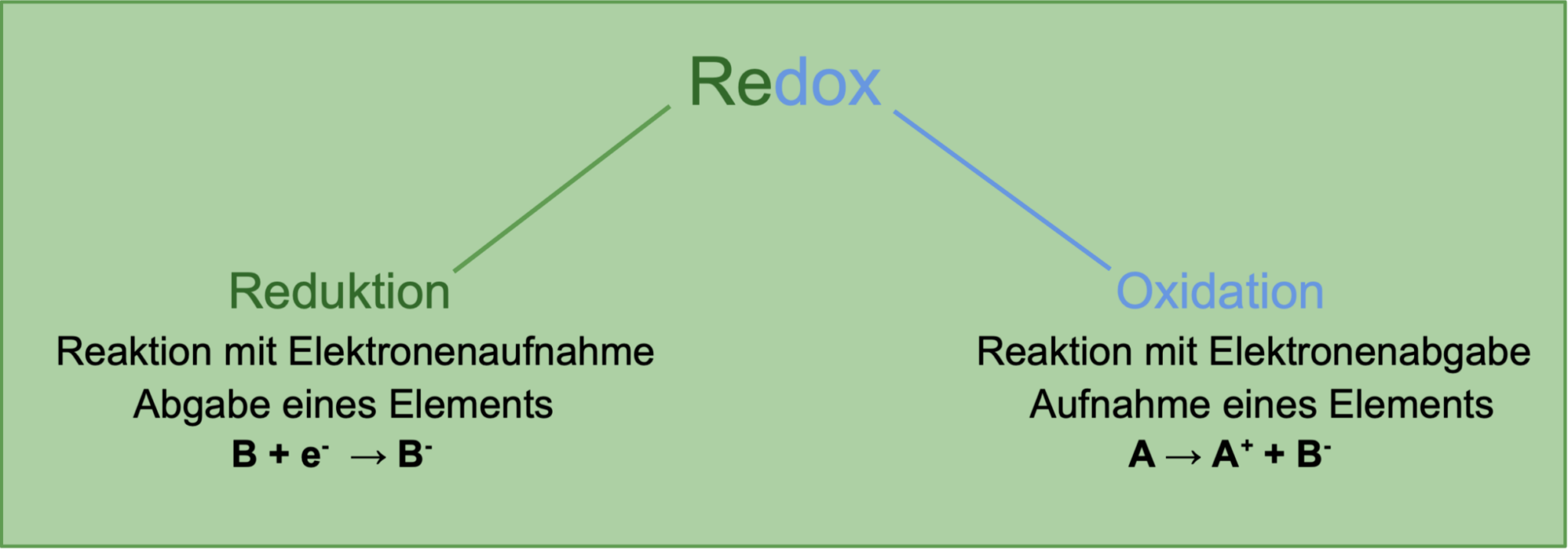
Oxidation und Reduktion, oft zusammenfassend als Redoxreaktionen bezeichnet, sind grundlegende chemische Prozesse, die in einer Vielzahl von Bereichen unseres Lebens eine Rolle spielen – von der Energieerzeugung in Batterien bis hin zur Korrosion von Metallen. Um diese Prozesse zu verstehen, ist es wichtig, die Kernkonzepte klar zu definieren.
Was ist Oxidation?
Oxidation ist im Kern ein chemischer Prozess, bei dem ein Atom, Ion oder Molekül Elektronen abgibt. Traditionell wurde Oxidation als die Reaktion einer Substanz mit Sauerstoff definiert, wie beispielsweise beim Rosten von Eisen (Eisen reagiert mit Sauerstoff). Obwohl Reaktionen mit Sauerstoff immer noch als Oxidationsreaktionen gelten, hat sich die Definition erweitert, um alle Reaktionen einzuschließen, bei denen Elektronen abgegeben werden, unabhängig davon, ob Sauerstoff beteiligt ist oder nicht.
Ein einfaches Beispiel: Betrachten wir die Reaktion von Magnesium (Mg) mit Sauerstoff (O2):
2 Mg(s) + O2(g) → 2 MgO(s)
In dieser Reaktion gibt jedes Magnesiumatom zwei Elektronen ab, um Magnesiumionen (Mg2+) zu bilden. Daher wird Magnesium oxidiert. Das Magnesium verliert Elektronen und erhöht seine Oxidationszahl.
Wichtige Punkte zur Oxidation:
- Elektronenabgabe
- Erhöhung der Oxidationszahl
- Kann, muss aber nicht Sauerstoff beinhalten
Was ist Reduktion?
Reduktion ist der gegenläufige Prozess zur Oxidation. Es ist der chemische Prozess, bei dem ein Atom, Ion oder Molekül Elektronen aufnimmt. Auch hier hat sich die traditionelle Definition erweitert. Früher wurde Reduktion oft mit der Entfernung von Sauerstoff in Verbindung gebracht, aber heute beschreibt sie jeden Prozess, bei dem Elektronen aufgenommen werden.
Betrachten wir wieder das obige Beispiel der Reaktion von Magnesium mit Sauerstoff. In dieser Reaktion nimmt der Sauerstoff Elektronen auf, um Oxidionen (O2-) zu bilden. Daher wird Sauerstoff reduziert. Der Sauerstoff nimmt Elektronen auf und verringert seine Oxidationszahl.
Wichtige Punkte zur Reduktion:
- Elektronenaufnahme
- Verringerung der Oxidationszahl
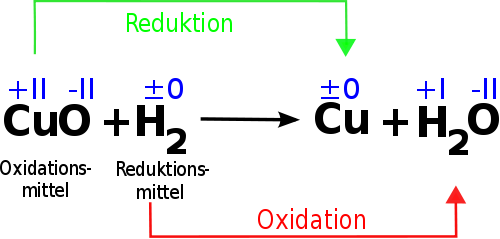
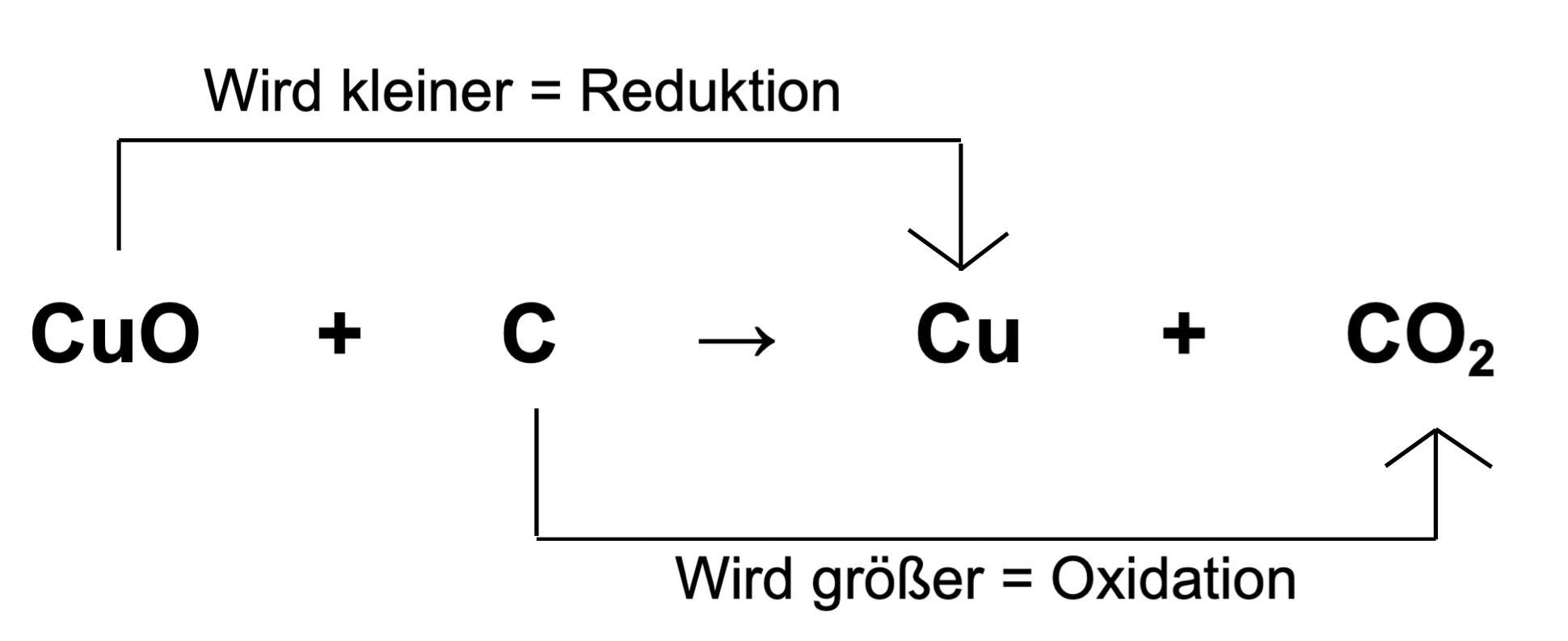
Redoxreaktionen: Oxidation und Reduktion als Paar
Oxidation und Reduktion treten niemals isoliert voneinander auf. Wenn eine Substanz Elektronen abgibt (oxidiert wird), muss eine andere Substanz diese Elektronen aufnehmen (reduziert werden). Diese gekoppelten Prozesse werden als Redoxreaktionen bezeichnet. Der Begriff "Redox" ist eine Kombination aus "Reduktion" und "Oxidation".
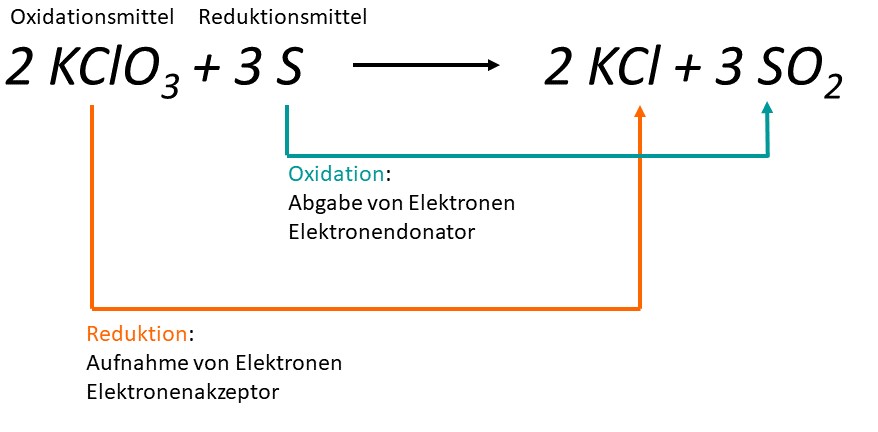
In einer Redoxreaktion gibt es immer einen Reduktionsmittel und ein Oxidationsmittel.
- Reduktionsmittel: Die Substanz, die Elektronen abgibt und somit eine andere Substanz reduziert. Das Reduktionsmittel wird selbst oxidiert. Im obigen Beispiel ist Magnesium (Mg) das Reduktionsmittel.
- Oxidationsmittel: Die Substanz, die Elektronen aufnimmt und somit eine andere Substanz oxidiert. Das Oxidationsmittel wird selbst reduziert. Im obigen Beispiel ist Sauerstoff (O2) das Oxidationsmittel.
Eselsbrücke: OIL RIG (Oxidation Is Loss, Reduction Is Gain) – Oxidation bedeutet Elektronenverlust, Reduktion bedeutet Elektronengewinn.
Oxidationszahlen
Um zu verfolgen, welche Atome in einer chemischen Reaktion oxidiert und reduziert werden, verwendet man das Konzept der Oxidationszahlen (auch Oxidationsstufen genannt). Die Oxidationszahl ist eine hypothetische Ladung, die ein Atom hätte, wenn alle Bindungen zu anderen Atomen in der Verbindung als ionisch betrachtet würden. Die Oxidationszahl ist nicht die tatsächliche Ladung, sondern eher ein Hilfsmittel zur Bestimmung des Elektronentransfers.
Hier sind einige allgemeine Regeln zur Bestimmung von Oxidationszahlen:
- Die Oxidationszahl eines Elements in seinem elementaren Zustand (z. B. Cu, H2, O2) ist 0.
- Die Oxidationszahl eines einatomigen Ions entspricht seiner Ladung (z. B. Na+ hat eine Oxidationszahl von +1, Cl- hat eine Oxidationszahl von -1).
- Die Summe der Oxidationszahlen aller Atome in einer neutralen Verbindung ist 0.
- Die Summe der Oxidationszahlen aller Atome in einem Polyatom-Ion entspricht der Ladung des Ions.
- Fluor (F) hat immer die Oxidationszahl -1 in Verbindungen.
- Sauerstoff (O) hat in der Regel die Oxidationszahl -2 in Verbindungen, außer in Peroxiden (z. B. H2O2), wo er die Oxidationszahl -1 hat, und in Verbindungen mit Fluor, wo er positive Oxidationszahlen haben kann.
- Wasserstoff (H) hat in der Regel die Oxidationszahl +1 in Verbindungen, außer in Metallhydriden (z. B. NaH), wo er die Oxidationszahl -1 hat.
Beispiel: Bestimmung der Oxidationszahlen in Kaliumpermanganat (KMnO4)
Wir wissen, dass die Summe der Oxidationszahlen aller Atome in KMnO4 gleich 0 sein muss. Wir kennen auch die Oxidationszahlen von Kalium (K) und Sauerstoff (O):
- K hat eine Oxidationszahl von +1.
- O hat eine Oxidationszahl von -2.
Sei x die Oxidationszahl von Mangan (Mn). Dann gilt:
+1 + x + 4(-2) = 0
+1 + x - 8 = 0
x = +7
Daher hat Mangan (Mn) in KMnO4 eine Oxidationszahl von +7.
Beispiele für Redoxreaktionen im Alltag
Redoxreaktionen sind allgegenwärtig und spielen eine wichtige Rolle in verschiedenen Aspekten unseres Lebens:
- Verbrennung: Das Verbrennen von Brennstoffen (z. B. Holz, Erdgas) ist eine Redoxreaktion, bei der der Brennstoff mit Sauerstoff reagiert und Wärme und Licht freisetzt.
- Korrosion: Das Rosten von Eisen ist ein Beispiel für Korrosion, eine Redoxreaktion, bei der Eisen mit Sauerstoff und Wasser reagiert und Eisenoxid (Rost) bildet.
- Atmung: Die Zellatmung, der Prozess, durch den Lebewesen Energie aus Nahrung gewinnen, ist eine Redoxreaktion, bei der Glucose oxidiert und Sauerstoff reduziert wird.
- Photosynthese: Pflanzen nutzen Photosynthese, um Sonnenlicht in chemische Energie umzuwandeln. Dies ist eine Redoxreaktion, bei der Kohlendioxid reduziert und Wasser oxidiert wird.
- Batterien: Batterien nutzen Redoxreaktionen, um elektrische Energie zu erzeugen. Beispielsweise beinhaltet eine Lithium-Ionen-Batterie die Oxidation von Lithium an der Anode und die Reduktion von Metalloxiden an der Kathode.
- Bleichen: Bleichmittel wie Natriumhypochlorit (NaClO) wirken, indem sie farbige Substanzen oxidieren und sie somit farblos machen.
Zusammenfassung
Oxidation und Reduktion sind fundamentale chemische Prozesse, die stets gekoppelt auftreten. Das Verständnis dieser Konzepte ist essenziell, um die Chemie hinter vielen alltäglichen Phänomenen und technologischen Anwendungen zu verstehen.
Wichtige Punkte im Überblick:
- Oxidation: Elektronenabgabe, Erhöhung der Oxidationszahl.
- Reduktion: Elektronenaufnahme, Verringerung der Oxidationszahl.
- Redoxreaktion: Gekoppelte Oxidations- und Reduktionsprozesse.
- Reduktionsmittel: Substanz, die Elektronen abgibt und selbst oxidiert wird.
- Oxidationsmittel: Substanz, die Elektronen aufnimmt und selbst reduziert wird.
- Oxidationszahl: Hypothetische Ladung eines Atoms in einer Verbindung.
Durch das Verständnis dieser Grundlagen können Sie die chemischen Prozesse besser nachvollziehen, die unsere Welt formen.
![Was Ist Eine Oxidation Und Reduktion Redoxreaktionen · aufstellen und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-und-Reduktion-1-1024x576.jpg)








![Was Ist Eine Oxidation Und Reduktion Reduktion • einfach erklärt, Definition, Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/11/Reduktion_WP-1-1024x576.jpg)
![Was Ist Eine Oxidation Und Reduktion Redoxreaktionen · aufstellen und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2018/12/WP-Bilder_Redoxgleichungen-aufstellen_2-1024x576.jpg)
![Was Ist Eine Oxidation Und Reduktion Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-von-sekundären-Alkohol-3-1024x576.jpg)