Was Ist Reduktion Und Oxidation

Die Welt, die uns umgibt, ist in ständiger Veränderung begriffen. Prozesse, die scheinbar unsichtbar ablaufen, formen Materialien, erzeugen Energie und ermöglichen Leben. Zu diesen fundamentalen Prozessen gehören die Reduktion und die Oxidation – zwei untrennbar miteinander verbundene Reaktionen, die das Fundament für eine Vielzahl von Phänomenen bilden, von der Rostbildung an einem alten Eisenzaun bis zur Verbrennung von Brennstoffen in unseren Autos.
Was genau verbirgt sich hinter Reduktion und Oxidation?
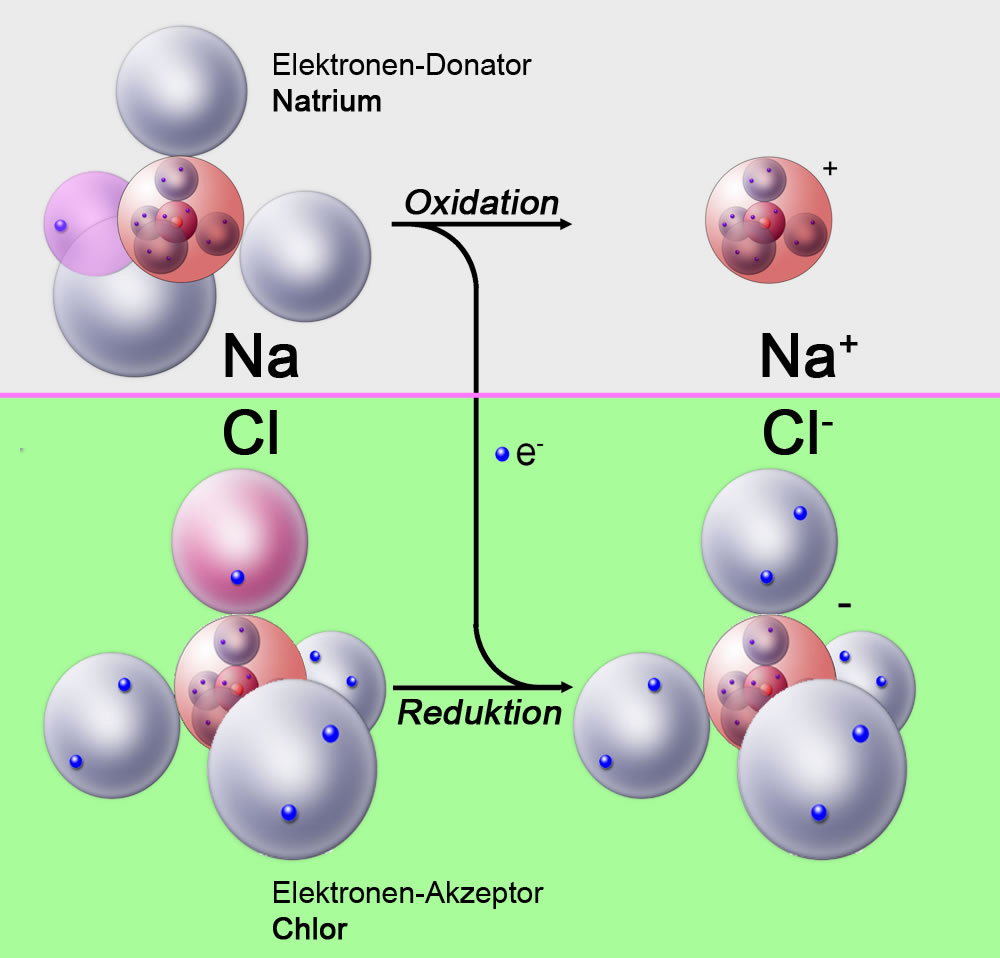
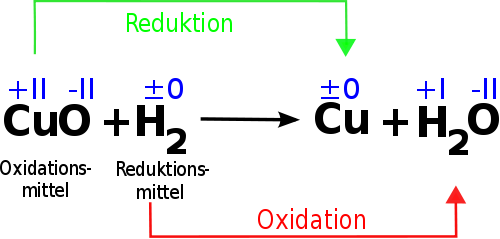
Im Kern beschreiben Reduktion und Oxidation den Transfer von Elektronen zwischen chemischen Spezies. Ursprünglich basierten die Definitionen auf der Reaktion mit Sauerstoff (Oxidation) bzw. dem Verlust von Sauerstoff (Reduktion). Heutzutage ist die Definition jedoch präziser und umfassender:
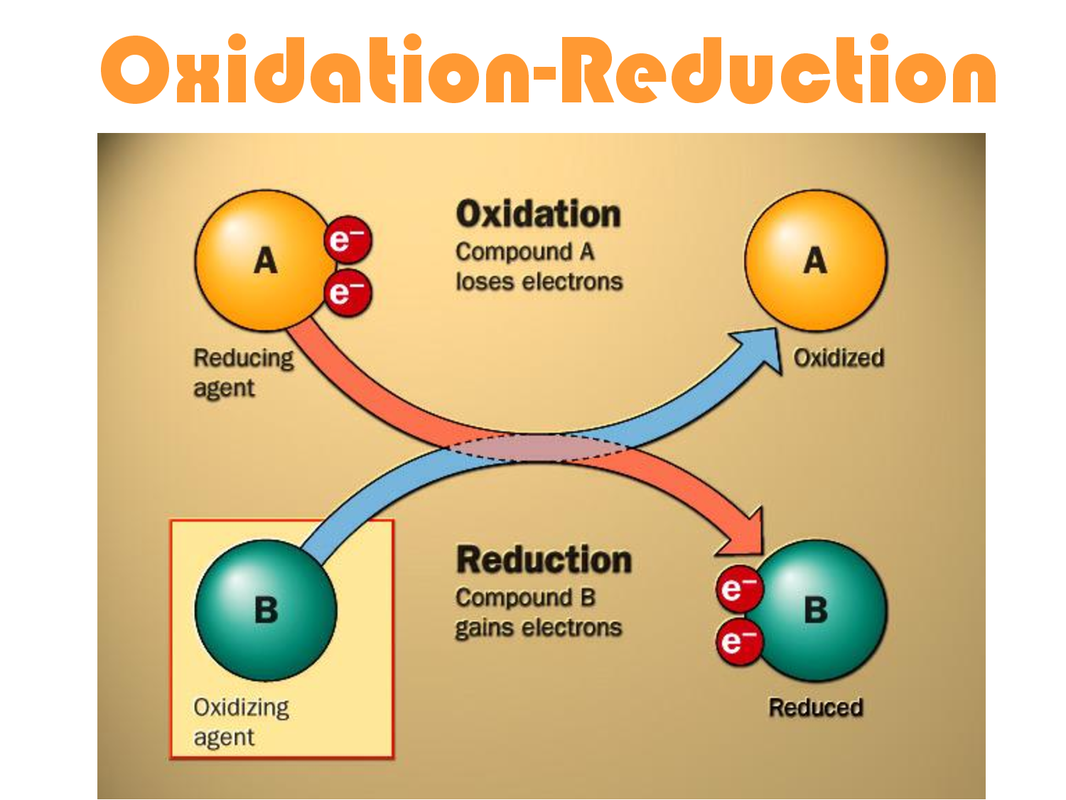
- Oxidation: Der Prozess, bei dem ein Atom, Ion oder Molekül Elektronen abgibt. Dadurch ändert sich die Oxidationszahl der Spezies, sie wird positiver.
- Reduktion: Der Prozess, bei dem ein Atom, Ion oder Molekül Elektronen aufnimmt. Dadurch ändert sich die Oxidationszahl der Spezies, sie wird negativer.
Es ist wichtig zu betonen, dass Oxidation und Reduktion immer gleichzeitig stattfinden. Man spricht daher auch von Redoxreaktionen. Eine Spezies kann nur Elektronen abgeben (oxidiert werden), wenn eine andere Spezies bereit ist, diese Elektronen aufzunehmen (reduziert zu werden). Die Spezies, die die Oxidation verursacht (also Elektronen aufnimmt), wird als Oxidationsmittel bezeichnet, während die Spezies, die die Reduktion verursacht (also Elektronen abgibt), als Reduktionsmittel bezeichnet wird.
Beispiele aus dem Alltag und der Wissenschaft
Um die Bedeutung von Redoxreaktionen zu verdeutlichen, betrachten wir einige Beispiele:
Die Rostbildung: Ein klassisches Beispiel für Oxidation
Die Rostbildung ist ein alltägliches Phänomen, das auf einer Redoxreaktion beruht. Eisen (Fe) reagiert mit Sauerstoff (O2) in Gegenwart von Wasser (H2O) zu Eisenoxid (Fe2O3), dem Rost. Dabei wird das Eisen oxidiert (es gibt Elektronen ab und wird zu Eisenionen), während der Sauerstoff reduziert wird (er nimmt Elektronen auf und bildet Oxidionen). Das Wasser dient hier als Elektrolyt und beschleunigt die Reaktion. Die chemische Gleichung für diesen vereinfachten Prozess lautet:
4 Fe(s) + 3 O2(g) + 6 H2O(l) → 4 Fe(OH)3(s)
Die braune Farbe des Rosts ist auf das Eisenoxid zurückzuführen. Die Rostbildung ist ein unerwünschter Prozess, da er Materialien schwächt und zerstört. Schutzmaßnahmen, wie das Auftragen von Farbe oder das Verzinken von Stahl, zielen darauf ab, die Oxidation des Eisens zu verhindern.
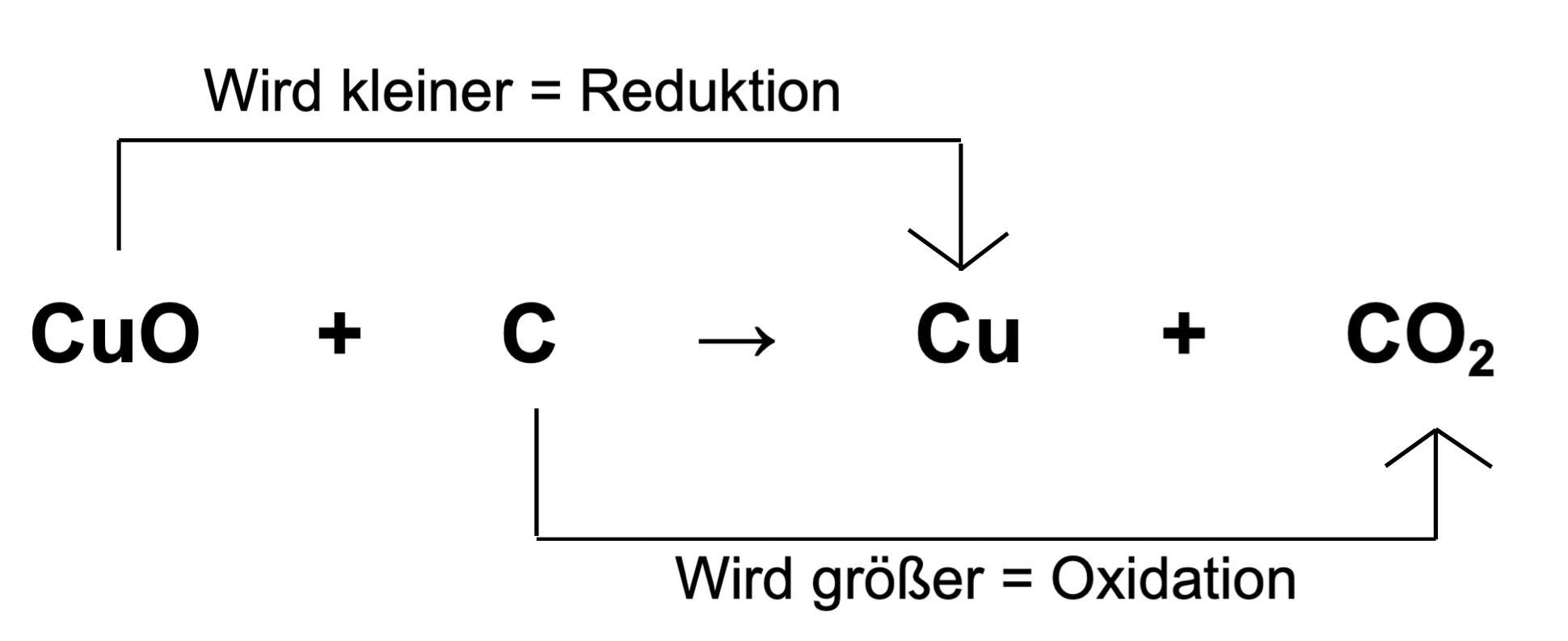
Die Verbrennung: Energie durch Redoxreaktionen
Die Verbrennung von Holz, Erdgas oder anderen Brennstoffen ist ein weiteres Beispiel für eine Redoxreaktion. Bei der Verbrennung reagiert der Brennstoff mit Sauerstoff, wobei Wärme und Licht freigesetzt werden. Beispielsweise reagiert Methan (CH4), der Hauptbestandteil von Erdgas, mit Sauerstoff (O2) zu Kohlenstoffdioxid (CO2) und Wasser (H2O). Dabei wird der Kohlenstoff im Methan oxidiert, während der Sauerstoff reduziert wird.
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) + Energie
Die freigesetzte Energie kann genutzt werden, um beispielsweise Wasser zu erhitzen und Dampf zu erzeugen, der dann Turbinen antreibt und Strom erzeugt. Die Verbrennung ist ein wichtiger Prozess zur Energiegewinnung, birgt aber auch Risiken, wie die Freisetzung von Schadstoffen in die Atmosphäre.
Die Photosynthese: Redoxreaktionen in der Natur
Die Photosynthese, der Prozess, durch den Pflanzen und Algen Sonnenlicht nutzen, um Kohlenstoffdioxid (CO2) und Wasser (H2O) in Zucker (Glucose, C6H12O6) und Sauerstoff (O2) umzuwandeln, ist ein komplexer Prozess, der eine Reihe von Redoxreaktionen beinhaltet. Dabei wird der Kohlenstoff im Kohlenstoffdioxid reduziert, während das Wasser oxidiert wird.
6 CO2(g) + 6 H2O(l) + Lichtenergie → C6H12O6(aq) + 6 O2(g)
Die Photosynthese ist von entscheidender Bedeutung für das Leben auf der Erde, da sie Sauerstoff erzeugt und organische Stoffe produziert, die als Nahrungsgrundlage für viele Organismen dienen.
Batterien: Chemische Energie in elektrische Energie
Batterien nutzen Redoxreaktionen, um chemische Energie in elektrische Energie umzuwandeln. Eine typische Batterie besteht aus zwei Elektroden, einer Anode (negativer Pol) und einer Kathode (positiver Pol), die in einem Elektrolyten eingetaucht sind. An der Anode findet die Oxidation statt, während an der Kathode die Reduktion stattfindet. Die Elektronen fließen von der Anode zur Kathode durch einen externen Stromkreis, wodurch ein elektrischer Strom entsteht. Beispielsweise nutzt eine Zink-Kohle-Batterie die Oxidation von Zink und die Reduktion von Mangandioxid.
Die Bedeutung für Forschung und Technologie
Das Verständnis von Redoxreaktionen ist nicht nur für das Verständnis grundlegender chemischer Prozesse wichtig, sondern auch für die Entwicklung neuer Technologien. In der Materialwissenschaft werden Redoxreaktionen genutzt, um neue Materialien mit spezifischen Eigenschaften herzustellen. In der Energietechnik werden Redoxreaktionen zur Entwicklung effizienterer Batterien und Brennstoffzellen eingesetzt. In der Umwelttechnik werden Redoxreaktionen zur Behandlung von Abwasser und zur Reinigung von verschmutzten Böden genutzt.
Die Erforschung von Redoxreaktionen ist ein dynamisches Feld mit vielen spannenden Herausforderungen. Die Entwicklung neuer Katalysatoren, die Redoxreaktionen beschleunigen und selektiver machen, ist ein wichtiges Ziel der Forschung. Auch die Entwicklung neuer Methoden zur Energiespeicherung auf Basis von Redoxreaktionen ist von großer Bedeutung für die Energiewende.
Fazit: Eine unsichtbare Kraft, die die Welt bewegt
Reduktion und Oxidation sind zwei untrennbar miteinander verbundene Reaktionen, die das Fundament für eine Vielzahl von Phänomenen bilden. Vom Rosten eines alten Eisenzauns bis zur Energieerzeugung in Batterien und Brennstoffzellen – Redoxreaktionen spielen eine entscheidende Rolle in unserem Alltag und in der modernen Technologie. Ein tiefes Verständnis dieser Prozesse ist unerlässlich, um die Welt um uns herum zu verstehen und neue Technologien zu entwickeln, die unsere Lebensqualität verbessern und die Umwelt schützen.



![Was Ist Reduktion Und Oxidation Reduktion • einfach erklärt, Definition, Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/11/Reduktion_WP-1-1024x576.jpg)
![Was Ist Reduktion Und Oxidation Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-und-Reduktion-1-1024x576.jpg)




![Was Ist Reduktion Und Oxidation Carbonylgruppe • Verbindungen, Reaktionen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/10/Carbonylgruppe_WP_Bilder_Reduktion-Oxidation-von-Aldehyd-Keton-1024x576.jpg)

![Was Ist Reduktion Und Oxidation Redoxreaktion einfach erklärt • Oxidation & Reduktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/03_Redoxreaktion-als-Elektronenübertragung-1-1024x576.jpg)
![Was Ist Reduktion Und Oxidation Redoxreaktionen · aufstellen und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2018/12/WP-Bilder_Redoxgleichungen-aufstellen_2-1024x576.jpg)
![Was Ist Reduktion Und Oxidation Redoxreaktionen · aufstellen und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2018/12/WP-Bild_Oxidation-und-Reduktion_2-1024x576.jpg)