Was Passiert Bei Einer Oxidation
Oxidation ist ein allgegenwärtiger chemischer Prozess, der in vielen Bereichen unseres Lebens eine Rolle spielt, von der Energieerzeugung in Batterien bis hin zum Rosten von Metall. Für viele mag der Begriff abstrakt erscheinen, aber das Verständnis der Grundlagen der Oxidation ist entscheidend, um die Welt um uns herum besser zu verstehen. Dieser Artikel erklärt auf einfache und verständliche Weise, was bei einer Oxidation passiert.
Die Grundlagen der Oxidation
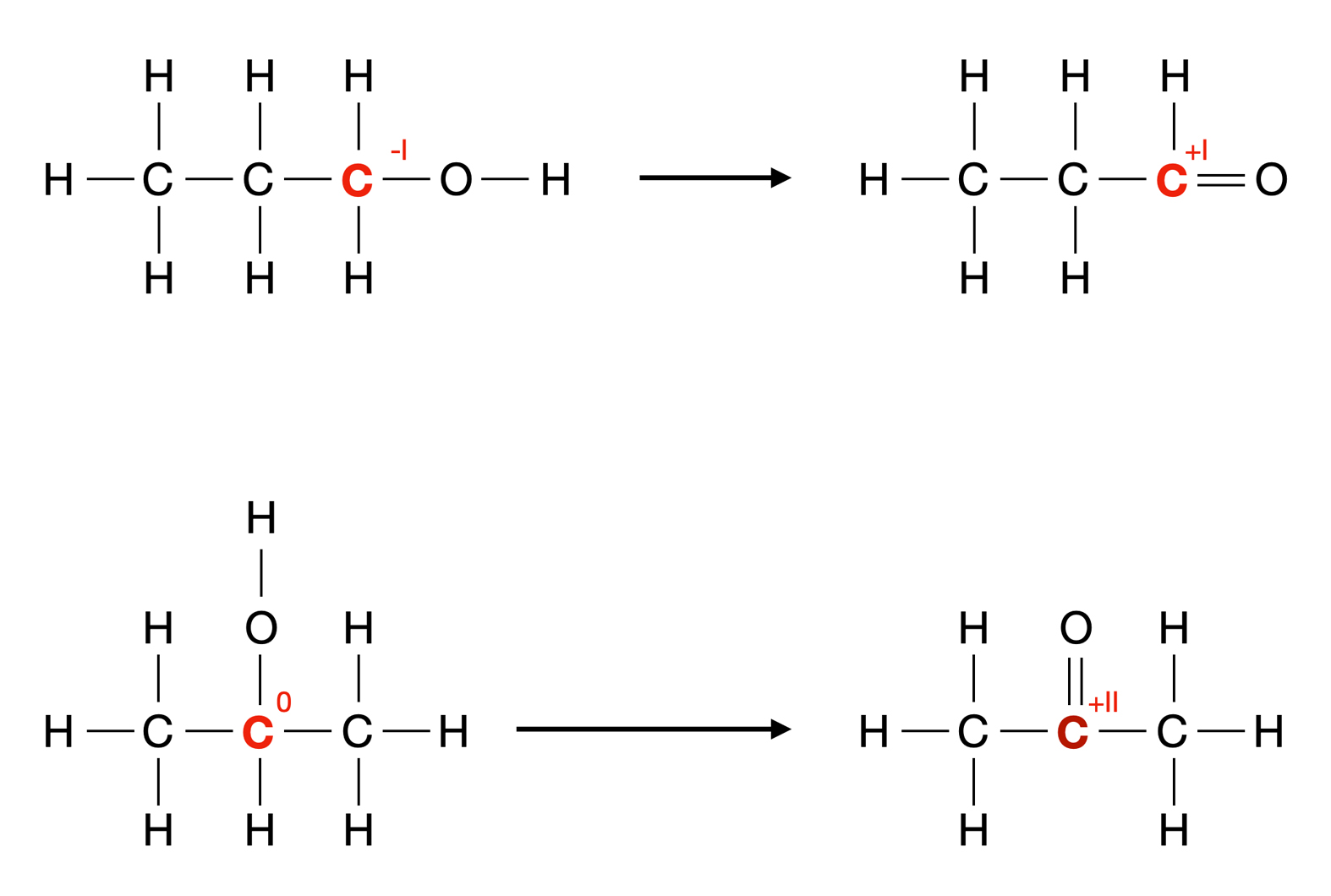
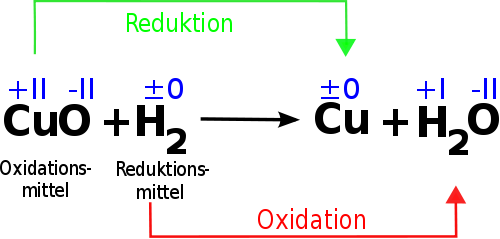
Im Kern ist Oxidation eine chemische Reaktion, bei der ein Stoff Elektronen abgibt. Um dies zu verstehen, muss man sich kurz an die Struktur von Atomen erinnern: Atome bestehen aus einem Kern mit Protonen (positiv geladen) und Neutronen (neutral) sowie Elektronen (negativ geladen), die den Kern umkreisen. Die Anzahl der Elektronen bestimmt die chemischen Eigenschaften eines Atoms. Atome streben oft nach einer stabilen Elektronenkonfiguration, meistens einer vollständig gefüllten äußeren Elektronenschale.
Wenn ein Atom oder Molekül oxidiert wird, verliert es also ein oder mehrere Elektronen. Dieser Elektronenverlust führt dazu, dass sich die Oxidationszahl des Stoffes erhöht. Die Oxidationszahl ist im Prinzip eine fiktive Ladung, die einem Atom zugewiesen wird, wenn man annimmt, dass alle Bindungen ionisch sind. Eine Erhöhung der Oxidationszahl bedeutet also, dass das Atom "positiver" wird, da es negative Ladungen (Elektronen) verloren hat.
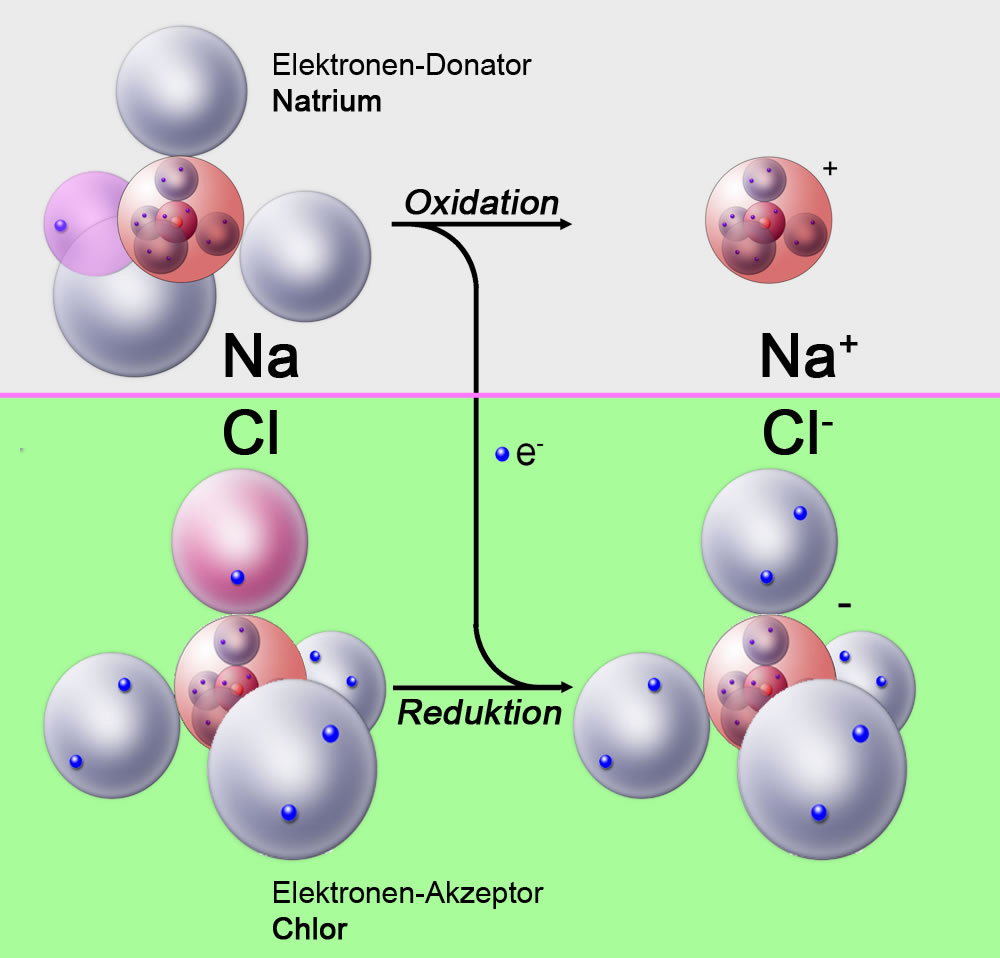
Beispiel: Stellen Sie sich ein Eisenatom (Fe) vor. Es kann Elektronen abgeben und zu einem Eisen-Ion (Fe2+ oder Fe3+) werden. Dieser Übergang von Fe zu Fe2+ oder Fe3+ ist eine Oxidation. Das Eisenatom hat Elektronen abgegeben und seine Oxidationszahl hat sich erhöht.
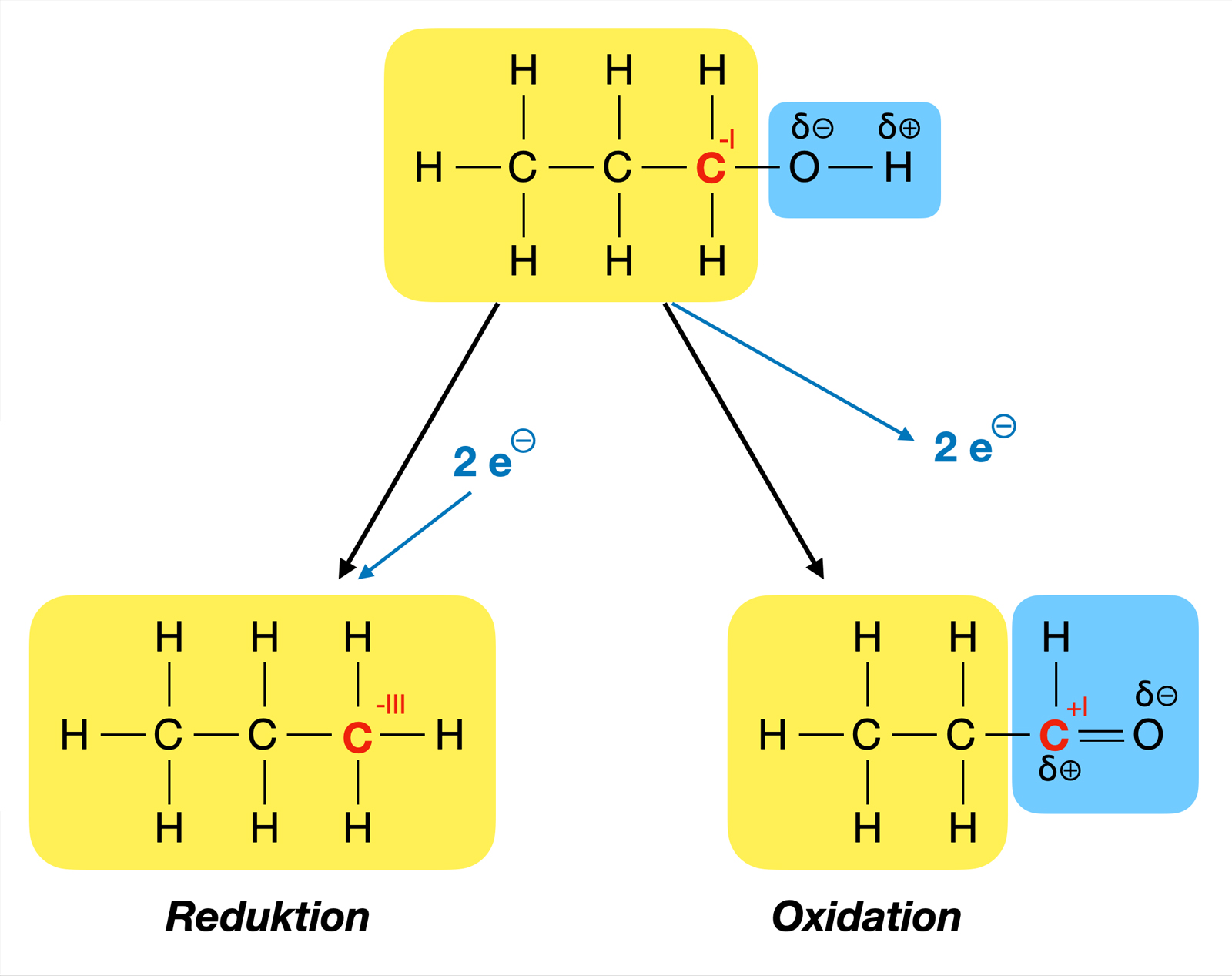
Reduktion – Die Kehrseite der Medaille
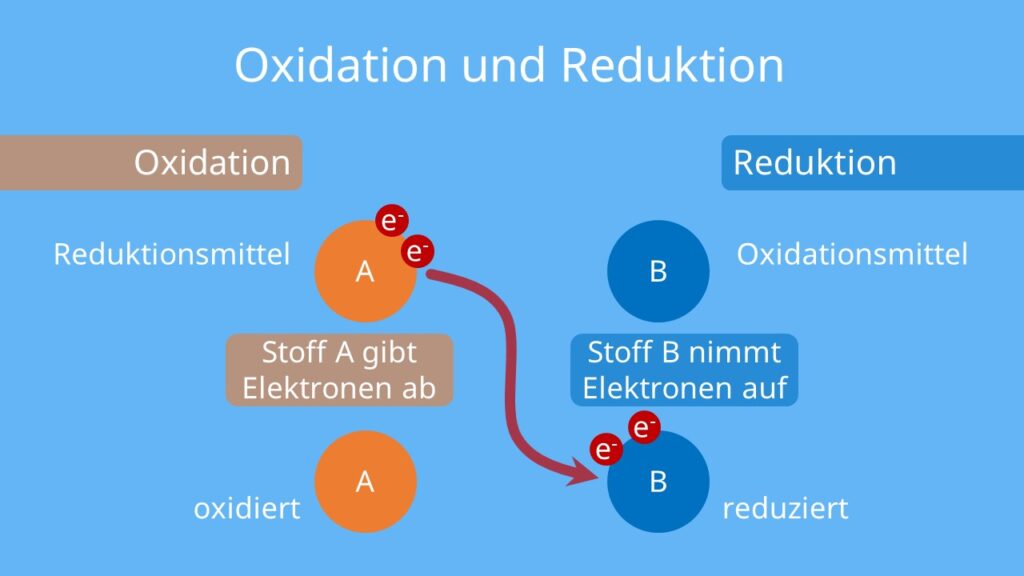
Oxidation tritt niemals alleine auf. Sie ist immer mit einer anderen Reaktion gekoppelt, der Reduktion. Reduktion ist das Gegenteil von Oxidation: Hier nimmt ein Stoff Elektronen auf. Der Stoff, der Elektronen aufnimmt, wird also "negativer", und seine Oxidationszahl verringert sich.
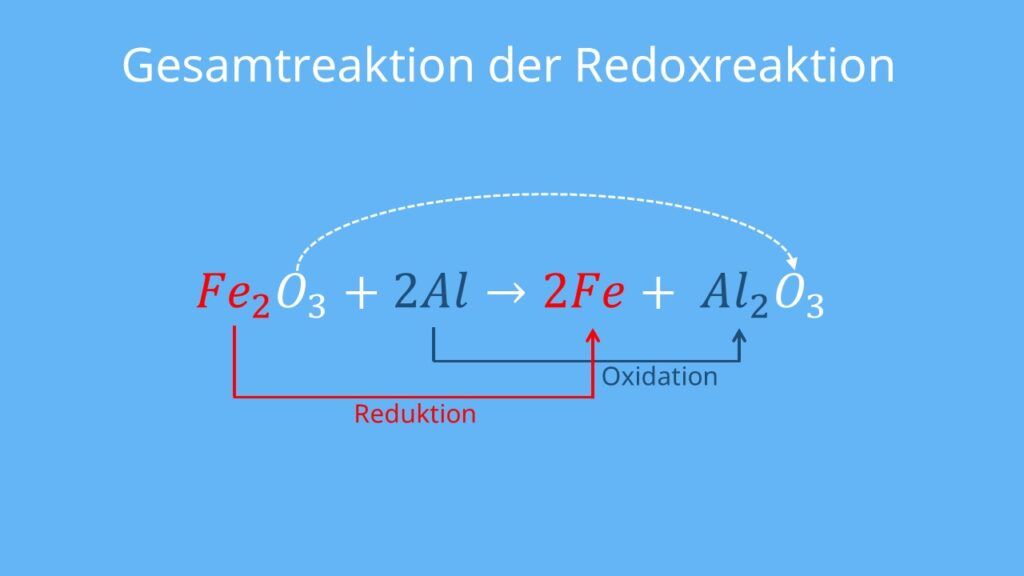
Zusammen bilden Oxidation und Reduktion eine Redoxreaktion (Reduktions-Oxidations-Reaktion). In jeder Redoxreaktion gibt es einen Stoff, der oxidiert wird (der Elektronendonator), und einen Stoff, der reduziert wird (der Elektronenakzeptor).
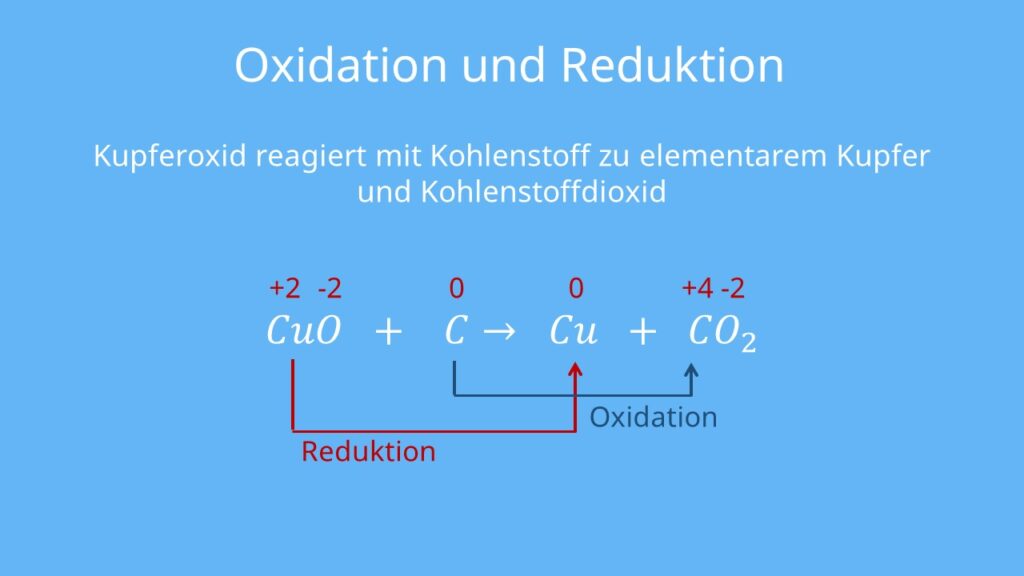
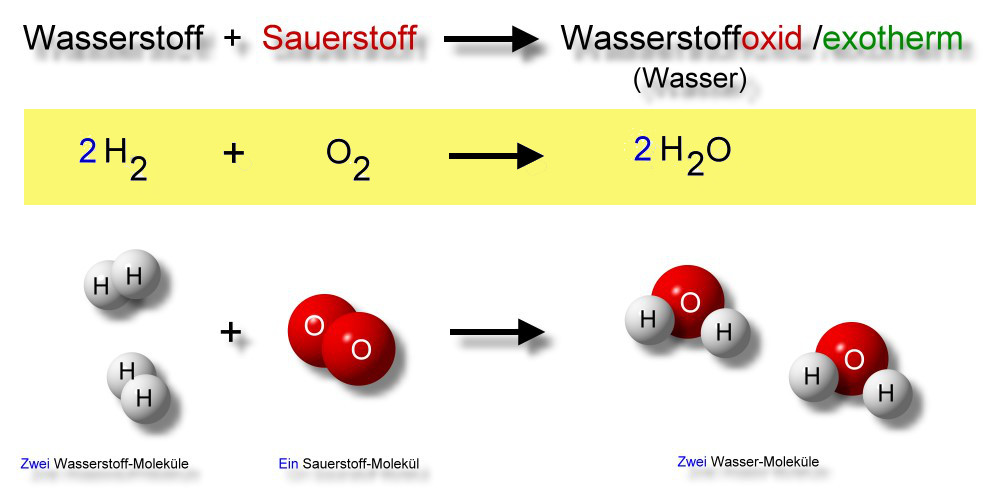
Beispiel: Nehmen wir die Reaktion von Eisen mit Sauerstoff (Rosten) als Beispiel:
Eisen (Fe) wird oxidiert: Fe → Fe2+ + 2e-
Sauerstoff (O2) wird reduziert: O2 + 4e- → 2O2-
In dieser Reaktion gibt Eisen Elektronen ab (wird oxidiert), und Sauerstoff nimmt Elektronen auf (wird reduziert). Das Ergebnis ist Eisenoxid (Rost), ein Produkt, das aus der Kombination von Eisen-Ionen und Oxid-Ionen entsteht.
Wichtige Oxidationsmittel und Reduktionsmittel
Bestimmte Stoffe sind besonders gut darin, andere Stoffe zu oxidieren oder zu reduzieren. Diese Stoffe werden als Oxidationsmittel bzw. Reduktionsmittel bezeichnet.
- Oxidationsmittel: Oxidationsmittel sind Stoffe, die leicht Elektronen aufnehmen und dadurch andere Stoffe oxidieren. Häufige Beispiele sind:
- Sauerstoff (O2): Eines der bekanntesten und wichtigsten Oxidationsmittel. Es ist für das Rosten von Metallen, die Verbrennung und viele biologische Prozesse verantwortlich.
- Chlor (Cl2): Wird häufig zur Desinfektion von Wasser verwendet, da es Mikroorganismen oxidieren und dadurch abtöten kann.
- Fluor (F2): Ein sehr starkes Oxidationsmittel, das sogar Edelgase oxidieren kann.
- Wasserstoffperoxid (H2O2): Wird als Bleichmittel und Desinfektionsmittel verwendet.
- Kaliumpermanganat (KMnO4): Ein starkes Oxidationsmittel, das in der Chemie und Medizin eingesetzt wird.
- Reduktionsmittel: Reduktionsmittel sind Stoffe, die leicht Elektronen abgeben und dadurch andere Stoffe reduzieren. Häufige Beispiele sind:
- Wasserstoff (H2): Wird in der chemischen Industrie häufig als Reduktionsmittel eingesetzt.
- Kohlenstoffmonoxid (CO): Kann als Reduktionsmittel in der Metallurgie verwendet werden, um Metalle aus ihren Oxiden zu gewinnen.
- Natrium (Na): Ein starkes Reduktionsmittel, das in speziellen chemischen Reaktionen eingesetzt wird.
- Metalle (z.B. Zink, Eisen): Viele Metalle können als Reduktionsmittel wirken, indem sie Elektronen abgeben und zu positiven Ionen werden.
Beispiele für Oxidation im Alltag
Oxidation ist kein abstraktes Konzept, sondern ein Prozess, der ständig um uns herum stattfindet. Hier sind einige Beispiele:
- Rosten von Metallen: Wie bereits erwähnt, ist das Rosten von Eisen ein klassisches Beispiel für Oxidation. Eisen reagiert mit Sauerstoff und Wasser, um Eisenoxid (Rost) zu bilden.
- Verbrennung: Verbrennung ist eine schnelle Oxidationsreaktion, bei der ein Brennstoff (z.B. Holz, Gas) mit Sauerstoff reagiert und Wärme und Licht freisetzt.
- Verwesung: Der Abbau organischer Stoffe (z.B. von Lebensmitteln) ist ebenfalls eine Oxidationsreaktion, die durch Mikroorganismen beschleunigt wird.
- Batterien: Batterien nutzen Redoxreaktionen, um elektrische Energie zu erzeugen. In einer Batterie werden chemische Stoffe oxidiert und reduziert, wodurch ein Elektronenfluss entsteht, der als Strom genutzt werden kann.
- Atmung: Die Zellatmung, der Prozess, durch den Lebewesen Energie aus Nahrung gewinnen, ist eine Reihe von Redoxreaktionen. Glukose (Zucker) wird oxidiert, und Sauerstoff wird reduziert, um Energie, Wasser und Kohlendioxid zu erzeugen.
- Bleichen: Bleichmittel enthalten Oxidationsmittel, die Farbstoffe in Textilien oder anderen Materialien oxidieren und dadurch entfärben.
Oxidation und Gesundheit
Oxidation spielt auch eine wichtige Rolle in biologischen Systemen. Einerseits ist sie für die Energieerzeugung und viele Stoffwechselprozesse unerlässlich. Andererseits kann unkontrollierte Oxidation auch schädlich sein.
Freie Radikale sind Moleküle mit ungepaarten Elektronen, die sehr reaktiv sind und Zellen schädigen können. Sie entstehen als Nebenprodukte normaler Stoffwechselprozesse oder durch äußere Einflüsse wie UV-Strahlung, Umweltverschmutzung und Rauchen. Freie Radikale können DNA, Proteine und Lipide oxidieren und so zu Zellschäden und Alterung beitragen. Sie werden auch mit der Entstehung von Krankheiten wie Krebs, Herzkrankheiten und Alzheimer in Verbindung gebracht.
Antioxidantien sind Stoffe, die freie Radikale neutralisieren und so Zellschäden verhindern können. Sie wirken, indem sie Elektronen an freie Radikale abgeben, ohne selbst zu instabil zu werden. Viele Vitamine (z.B. Vitamin C, Vitamin E), Mineralstoffe (z.B. Selen) und pflanzliche Stoffe (z.B. Polyphenole in Obst und Gemüse) wirken als Antioxidantien.
Fazit
Oxidation ist ein grundlegender chemischer Prozess, der in vielen Bereichen unseres Lebens eine Rolle spielt. Von der Energieerzeugung bis hin zum Rosten von Metallen ist Oxidation allgegenwärtig. Das Verständnis der Grundlagen der Oxidation und Reduktion ist entscheidend, um die Welt um uns herum besser zu verstehen und die Auswirkungen dieser Prozesse auf unsere Gesundheit und Umwelt zu erkennen. Obwohl Oxidation in einigen Fällen schädlich sein kann (z.B. durch die Bildung freier Radikale), ist sie auch für viele lebenswichtige Prozesse unerlässlich.
![Was Passiert Bei Einer Oxidation Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-von-sekundären-Alkohol-3-1024x576.jpg)

![Was Passiert Bei Einer Oxidation Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-Kohlenstoff-2-1024x576.jpg)

![Was Passiert Bei Einer Oxidation Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Vollständige-Oxidation-2-1024x576.jpg)

![Was Passiert Bei Einer Oxidation Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Ethanol-Oxidation-2-1024x576.jpg)