Was Sind Basen Und Säuren

Basen und Säuren sind allgegenwärtig in unserem Alltag. Sie spielen eine wichtige Rolle in vielen chemischen Prozessen, von der Verdauung unserer Nahrung bis zur Reinigung unserer Häuser. Dieses Dokument bietet eine leicht verständliche Einführung in das Konzept von Basen und Säuren, um Ihnen ein besseres Verständnis ihrer Eigenschaften und Anwendungen zu vermitteln.
Was sind Säuren?
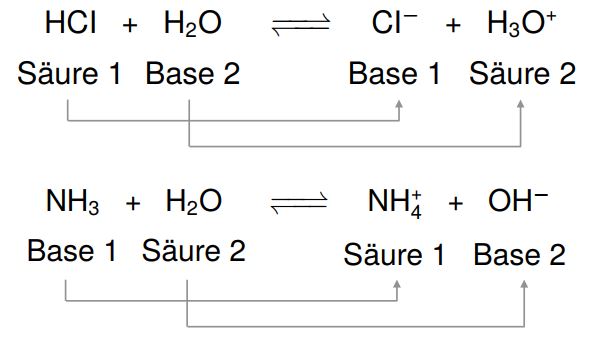
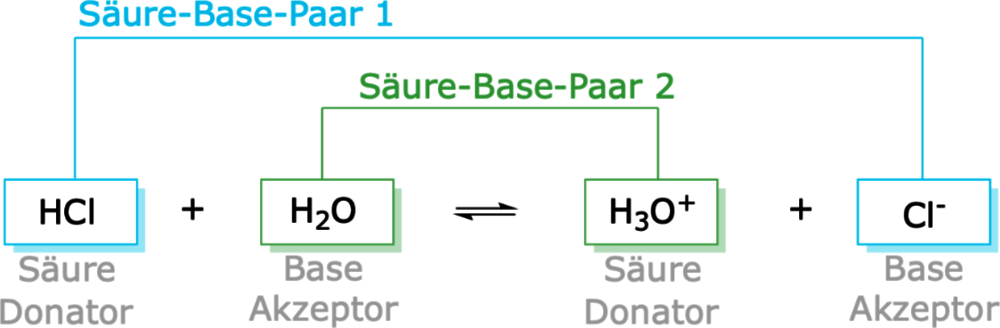
Eine Säure ist eine Substanz, die in der Lage ist, Protonen (H+ Ionen) abzugeben. In wässriger Lösung führt die Abgabe von Protonen zu einer Erhöhung der Konzentration von H+ Ionen. Diese Erhöhung der H+ Ionen-Konzentration ist das, was eine Lösung sauer macht.
Eigenschaften von Säuren
Säuren weisen typische Eigenschaften auf:
- Saurer Geschmack: Viele Säuren schmecken sauer. Achtung: Verkosten Sie niemals Chemikalien unbekannter Herkunft!
- Korrosive Wirkung: Starke Säuren können Metalle und andere Materialien angreifen und zerstören.
- Leitfähigkeit: Säuren leiten elektrischen Strom in wässriger Lösung, da sie Ionen bilden.
- pH-Wert: Säuren haben einen pH-Wert kleiner als 7. Je niedriger der pH-Wert, desto saurer ist die Lösung.
- Reaktion mit Basen: Säuren reagieren mit Basen unter Bildung von Salz und Wasser (Neutralisation).
Beispiele für Säuren
Säuren kommen in vielen alltäglichen Produkten und natürlichen Stoffen vor:
- Zitronensäure: In Zitronen und anderen Zitrusfrüchten enthalten.
- Essigsäure: Hauptbestandteil von Essig.
- Salzsäure (HCl): Befindet sich im Magensaft und hilft bei der Verdauung von Nahrung. Wird auch in der Industrie verwendet.
- Schwefelsäure (H2SO4): Eine starke Säure, die in Autobatterien und in der chemischen Industrie verwendet wird.
- Kohlensäure (H2CO3): Entsteht, wenn Kohlendioxid in Wasser gelöst wird (z.B. in kohlensäurehaltigen Getränken).
Was sind Basen?
Eine Base ist eine Substanz, die in der Lage ist, Protonen (H+ Ionen) aufzunehmen. In wässriger Lösung führt die Aufnahme von Protonen zu einer Verringerung der Konzentration von H+ Ionen (oder anders ausgedrückt, zu einer Erhöhung der Konzentration von OH- Ionen, Hydroxidionen). Diese Verringerung der H+ Ionen-Konzentration ist das, was eine Lösung basisch (oder alkalisch) macht.
Eigenschaften von Basen
Basen weisen typische Eigenschaften auf:
- Seifiges Gefühl: Basen fühlen sich oft seifig an. Achtung: Vermeiden Sie direkten Hautkontakt mit starken Basen!
- Bitterer Geschmack: Viele Basen schmecken bitter. Achtung: Verkosten Sie niemals Chemikalien unbekannter Herkunft!
- Korrosive Wirkung: Starke Basen können ebenfalls ätzend sein und Gewebe schädigen.
- Leitfähigkeit: Basen leiten elektrischen Strom in wässriger Lösung, da sie Ionen bilden.
- pH-Wert: Basen haben einen pH-Wert größer als 7. Je höher der pH-Wert, desto basischer ist die Lösung.
- Reaktion mit Säuren: Basen reagieren mit Säuren unter Bildung von Salz und Wasser (Neutralisation).
Beispiele für Basen
Basen kommen in vielen alltäglichen Produkten und industriellen Anwendungen vor:
- Natriumhydroxid (NaOH): Auch bekannt als Ätznatron. Wird zur Herstellung von Seife, Papier und Reinigungsmitteln verwendet.
- Kaliumhydroxid (KOH): Auch bekannt als Ätzkali. Wird in Batterien und zur Herstellung von Seife verwendet.
- Ammoniak (NH3): Wird in Düngemitteln, Reinigungsmitteln und zur Herstellung von Kunststoffen verwendet.
- Calciumhydroxid (Ca(OH)2): Auch bekannt als gelöschter Kalk. Wird im Bauwesen und zur Neutralisation von sauren Böden verwendet.
- Natriumcarbonat (Na2CO3): Auch bekannt als Soda. Wird als Reinigungsmittel und in der Glasherstellung verwendet.
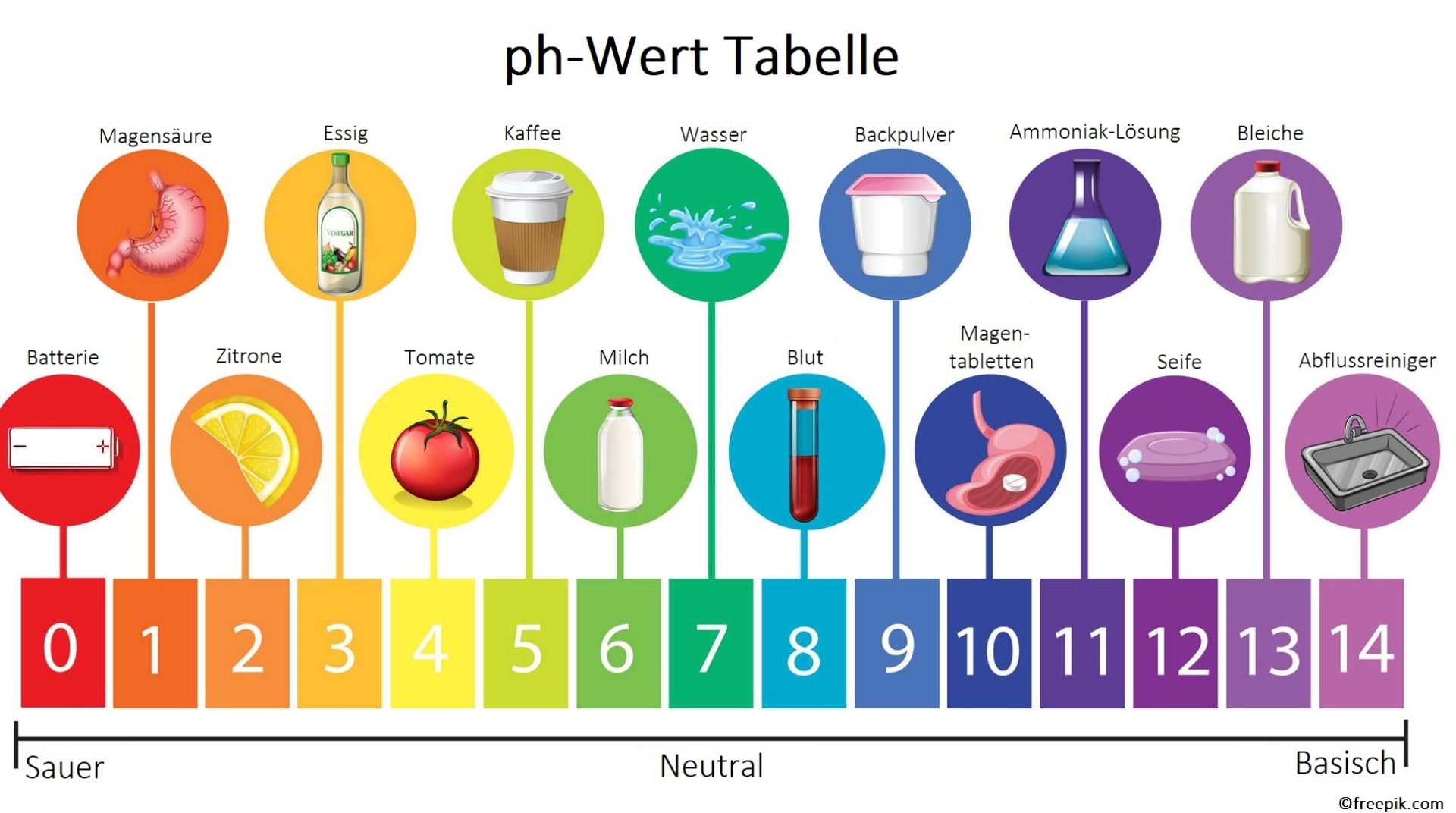
Der pH-Wert: Ein Maß für Säure und Basizität
Der pH-Wert ist eine Skala, die verwendet wird, um den Säure- oder Basengehalt einer wässrigen Lösung zu bestimmen. Die Skala reicht von 0 bis 14, wobei:
- pH < 7: Säure
- pH = 7: Neutral (z.B. reines Wasser)
- pH > 7: Base
Der pH-Wert wird logarithmisch gemessen, was bedeutet, dass eine Veränderung von einem pH-Wert um eine Einheit eine zehnfache Veränderung der Konzentration von H+ Ionen bedeutet. Zum Beispiel ist eine Lösung mit einem pH-Wert von 3 zehnmal saurer als eine Lösung mit einem pH-Wert von 4 und hundertmal saurer als eine Lösung mit einem pH-Wert von 5.
pH-Wert Messung
Der pH-Wert kann mit verschiedenen Methoden gemessen werden:
- pH-Papier: Ein Indikatorpapier, das seine Farbe in Abhängigkeit vom pH-Wert ändert. Eine einfache und kostengünstige Methode, aber nicht sehr genau.
- pH-Meter: Ein elektronisches Gerät, das den pH-Wert sehr genau misst. Verwendet eine Elektrode, die in die Lösung getaucht wird.
- Indikatoren: Chemische Substanzen, die ihre Farbe in Abhängigkeit vom pH-Wert ändern. Werden oft in Titrationen verwendet.
Neutralisation
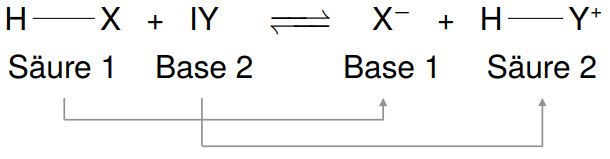
Die Reaktion einer Säure mit einer Base wird als Neutralisation bezeichnet. Bei dieser Reaktion reagieren die H+ Ionen der Säure mit den OH- Ionen der Base unter Bildung von Wasser (H2O). Gleichzeitig entsteht ein Salz, das aus den verbleibenden Ionen der Säure und der Base besteht.
Ein einfaches Beispiel für eine Neutralisationsreaktion ist die Reaktion von Salzsäure (HCl) mit Natriumhydroxid (NaOH):
HCl + NaOH → NaCl + H2O
In dieser Reaktion reagiert die Salzsäure (HCl) mit dem Natriumhydroxid (NaOH) unter Bildung von Natriumchlorid (NaCl, Kochsalz) und Wasser (H2O). Wenn die Säure und die Base in äquivalenten Mengen vorliegen, ist die resultierende Lösung neutral (pH = 7).
Anwendungen von Säuren und Basen im Alltag
Säuren und Basen spielen eine wichtige Rolle in vielen Bereichen unseres Lebens:
- Reinigung: Viele Reinigungsmittel enthalten Säuren oder Basen, um Schmutz und Fett zu lösen. Beispielsweise enthalten Rohrreiniger oft Natriumhydroxid (NaOH), um Verstopfungen zu beseitigen.
- Lebensmittelverarbeitung: Säuren werden verwendet, um Lebensmittel zu konservieren (z.B. Essig in eingelegtem Gemüse) oder um den Geschmack zu verbessern (z.B. Zitronensäure in Limonaden). Basen werden in der Lebensmittelindustrie verwendet, um den pH-Wert von Lebensmitteln zu regulieren oder um bestimmte Reaktionen zu katalysieren.
- Medizin: Säuren und Basen werden in vielen Medikamenten und medizinischen Behandlungen eingesetzt. Beispielsweise wird Magensäure (Salzsäure) verwendet, um Nahrung zu verdauen. Antazida enthalten Basen, um überschüssige Magensäure zu neutralisieren.
- Landwirtschaft: Säuren und Basen werden verwendet, um den pH-Wert des Bodens zu regulieren. Saurer Boden kann mit Kalk (Calciumhydroxid) neutralisiert werden.
- Industrie: Säuren und Basen werden in einer Vielzahl von industriellen Prozessen eingesetzt, z.B. zur Herstellung von Chemikalien, Kunststoffen, Papier und Metallen.
Sicherheitsvorkehrungen im Umgang mit Säuren und Basen
Der Umgang mit Säuren und Basen erfordert Vorsicht, da viele von ihnen ätzend und gesundheitsschädlich sind. Beachten Sie die folgenden Sicherheitsvorkehrungen:
- Schutzkleidung: Tragen Sie beim Umgang mit Säuren und Basen immer Schutzkleidung, einschließlich Schutzbrille, Handschuhe und Laborkittel.
- Belüftung: Arbeiten Sie in gut belüfteten Bereichen, um das Einatmen von Dämpfen zu vermeiden.
- Verdünnung: Verdünnen Sie Säuren immer, indem Sie die Säure langsam in das Wasser gießen, niemals umgekehrt. Dadurch wird verhindert, dass die Lösung spritzt und Wärme entsteht.
- Neutralisation von Verschüttungen: Verschüttete Säuren können mit einer Base (z.B. Natriumcarbonat) neutralisiert werden. Verschüttete Basen können mit einer Säure (z.B. Essigsäure) neutralisiert werden.
- Erste Hilfe: Bei Hautkontakt mit Säuren oder Basen die betroffene Stelle sofort mit viel Wasser abspülen. Bei Augenkontakt sofort mit viel Wasser spülen und einen Arzt aufsuchen. Bei Verschlucken sofort einen Arzt aufsuchen.
- Lagerung: Säuren und Basen getrennt voneinander und an einem sicheren Ort lagern, außerhalb der Reichweite von Kindern.
Zusammenfassend lässt sich sagen, dass das Verständnis von Säuren und Basen für viele Aspekte unseres Lebens von Bedeutung ist. Ihre Eigenschaften und Anwendungen sind vielfältig und allgegenwärtig. Durch das Beachten der Sicherheitsvorkehrungen kann ein sicherer Umgang mit diesen wichtigen Substanzen gewährleistet werden.

![Was Sind Basen Und Säuren Basen • Definition und Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/04/WP_BasenUe_Basen-als-Protonenakzeptoren-1024x576.png)
![Was Sind Basen Und Säuren DNA Abiwissen • Aufbau, Bestandteile, Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/01/WP_DNA_Abiwissen_3_basen-1024x576.jpg)
![Was Sind Basen Und Säuren Basen • Definition und Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/04/WP_BasenUe_Lewis-Base-1024x576.png)




![Was Sind Basen Und Säuren mRNA • Aufbau, Funktion und Degradation · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/10/Bau_der_organischen_Basen_WP-1-1024x576.jpg)