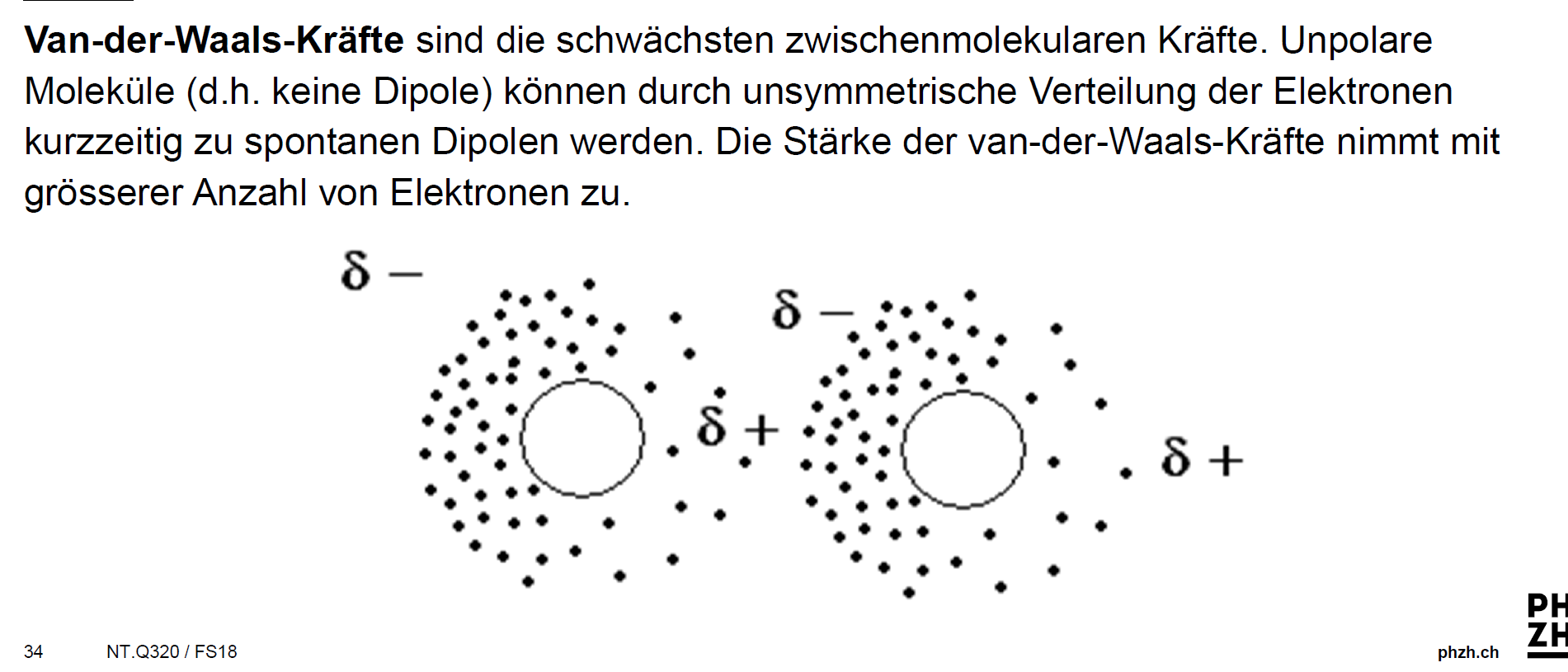
Was Sind Van Der Waals Kräfte
Willkommen! Wenn Sie neu in Deutschland sind oder einfach nur Ihr naturwissenschaftliches Wissen auffrischen möchten, sind Sie hier genau richtig. Dieser Artikel erklärt die Van-der-Waals-Kräfte auf einfache und verständliche Weise.
Was sind Van-der-Waals-Kräfte?
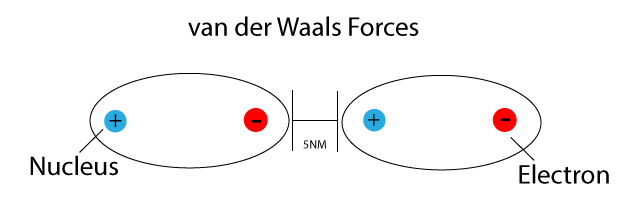
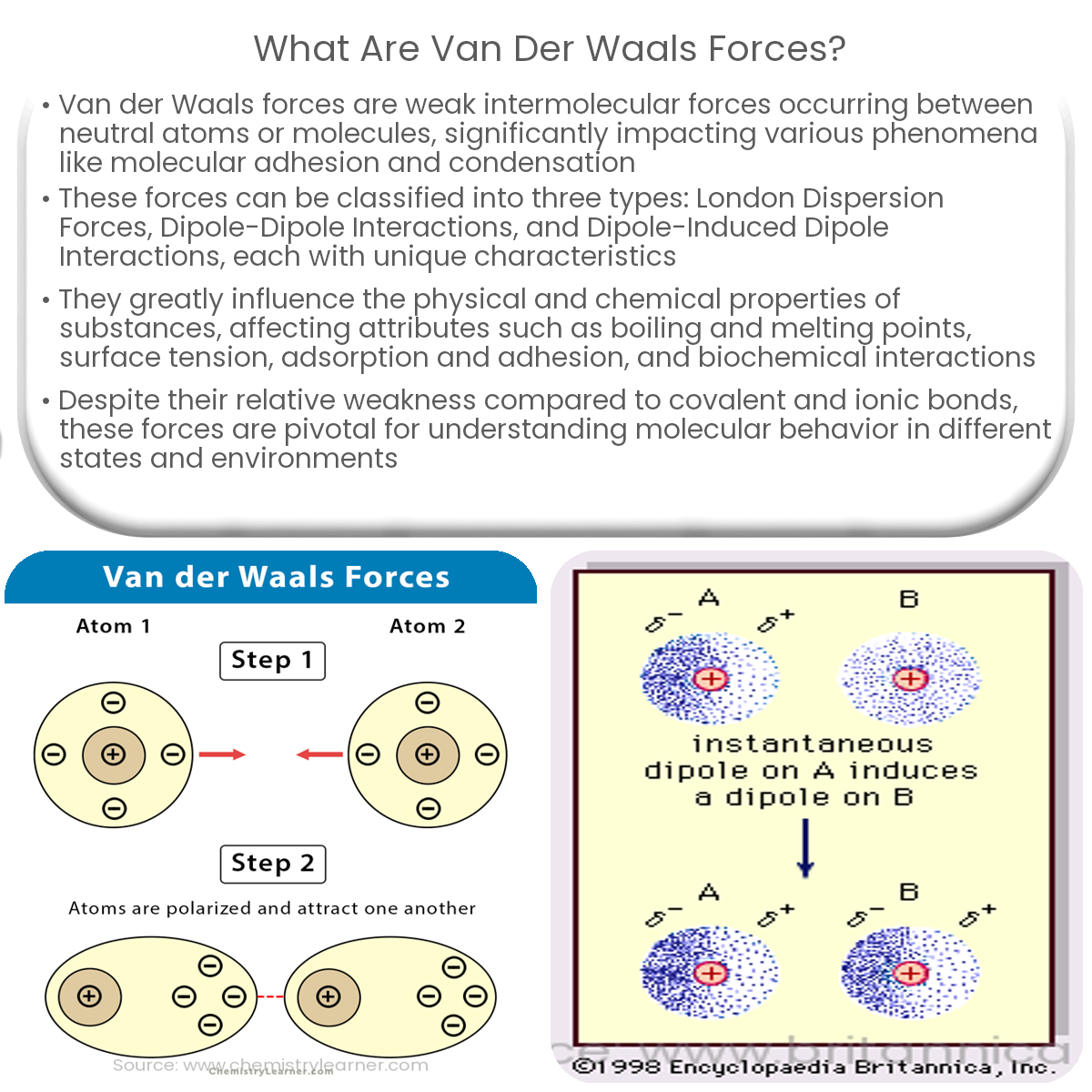
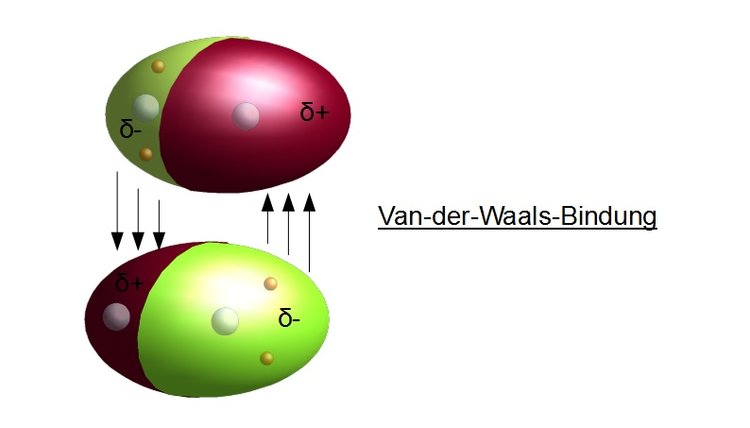
Van-der-Waals-Kräfte sind schwache, nicht-kovalente intermolekulare Kräfte, die zwischen Atomen und Molekülen wirken. Im Klartext: Sie sind Kräfte, die dafür sorgen, dass Moleküle sich gegenseitig anziehen oder abstoßen, ohne dass dabei Elektronen geteilt oder übertragen werden (wie bei kovalenten oder ionischen Bindungen). Diese Kräfte sind wesentlich schwächer als chemische Bindungen, spielen aber eine entscheidende Rolle in vielen physikalischen und chemischen Eigenschaften von Stoffen.
Der Name "Van-der-Waals-Kräfte" ehrt den niederländischen Physiker Johannes Diderik van der Waals, der diese Kräfte im 19. Jahrhundert erkannte und ihre Bedeutung für das Verhalten von Gasen und Flüssigkeiten erklärte.
Die verschiedenen Arten von Van-der-Waals-Kräften
Es gibt verschiedene Arten von Van-der-Waals-Kräften, die sich in ihrer Ursache und Stärke unterscheiden:
- Dipol-Dipol-Wechselwirkungen: Diese Kräfte treten zwischen polaren Molekülen auf. Ein polares Molekül hat eine ungleiche Verteilung der elektronischen Ladung, was zu einem positiven und einem negativen Ende führt (einem Dipol). Der positive Teil eines Moleküls wird vom negativen Teil eines anderen Moleküls angezogen. Denken Sie an zwei kleine Magnete, die sich gegenseitig anziehen, wenn Sie die richtigen Pole aneinanderhalten. Ein gutes Beispiel ist Aceton (Nagellackentferner).
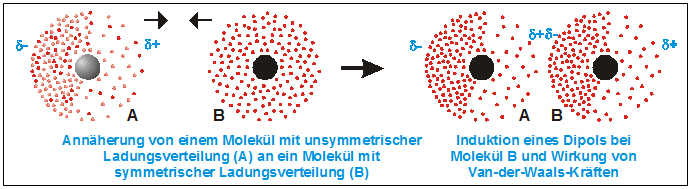
- Dipol-induzierte Dipol-Wechselwirkungen: Hierbei interagiert ein polares Molekül mit einem unpolaren Molekül. Das polare Molekül induziert (verursacht) eine vorübergehende Ladungsverschiebung im unpolaren Molekül, wodurch dieses ebenfalls polarisiert wird. Diese induzierte Polarisation führt zu einer Anziehungskraft. Stellen Sie sich vor, Sie halten einen Magneten (polares Molekül) in die Nähe eines Stücks Eisen (unpolares Molekül). Der Magnet wird das Eisen magnetisieren und anziehen. Ein Beispiel wäre die Wechselwirkung zwischen Wasser (polar) und Sauerstoff (unpolar) im Wasser.
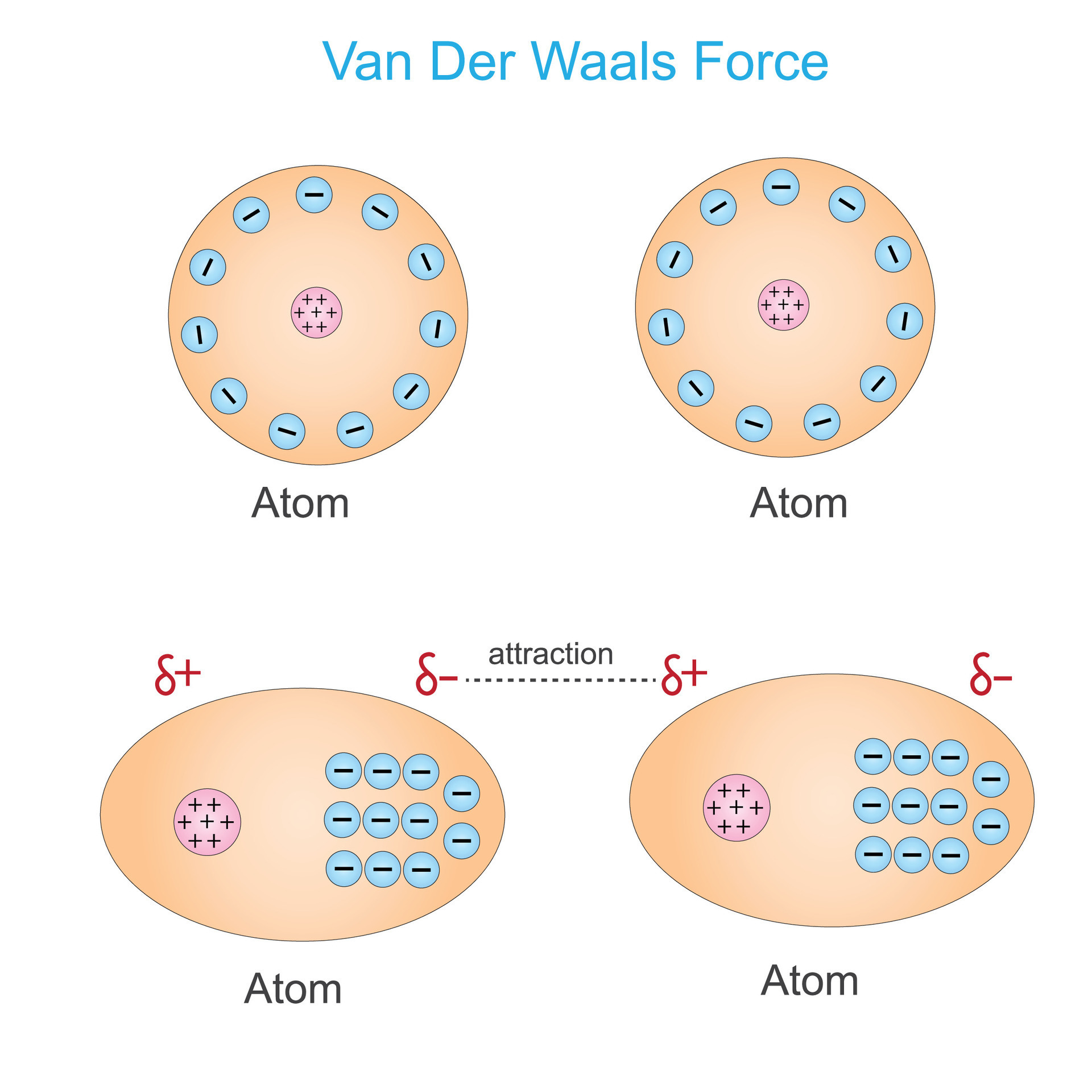
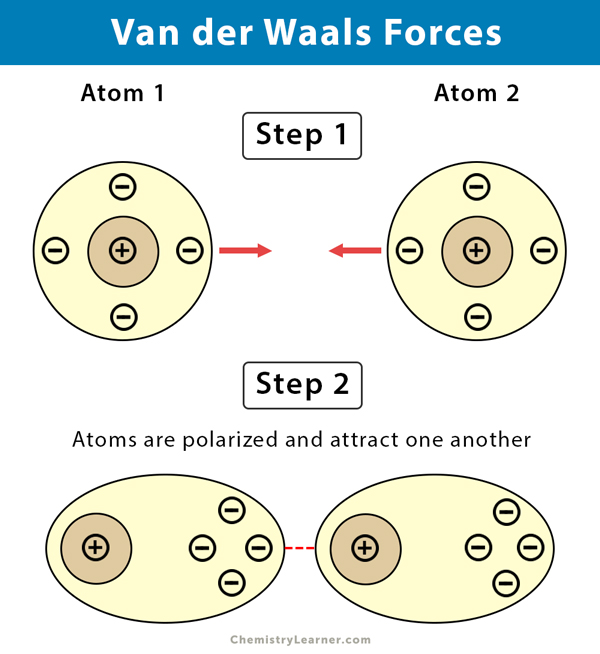
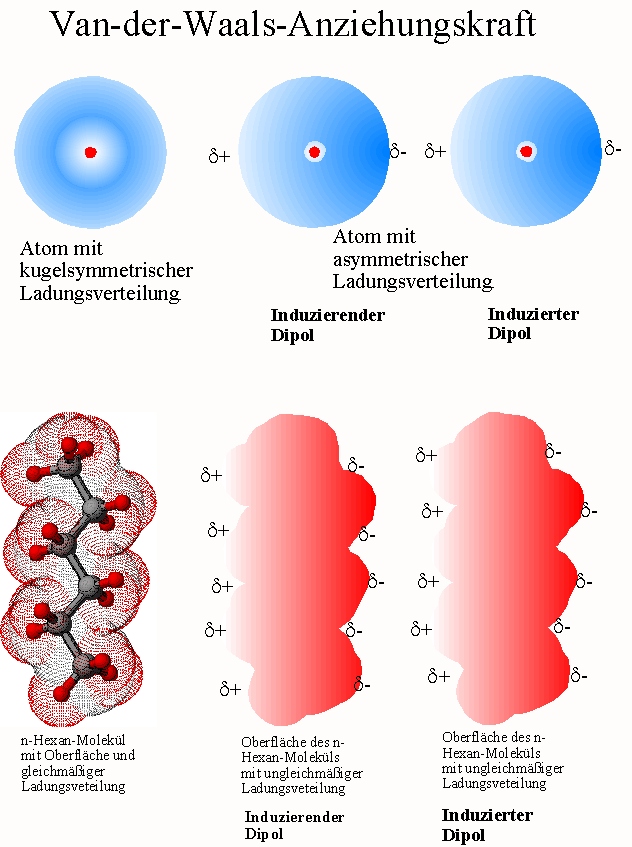
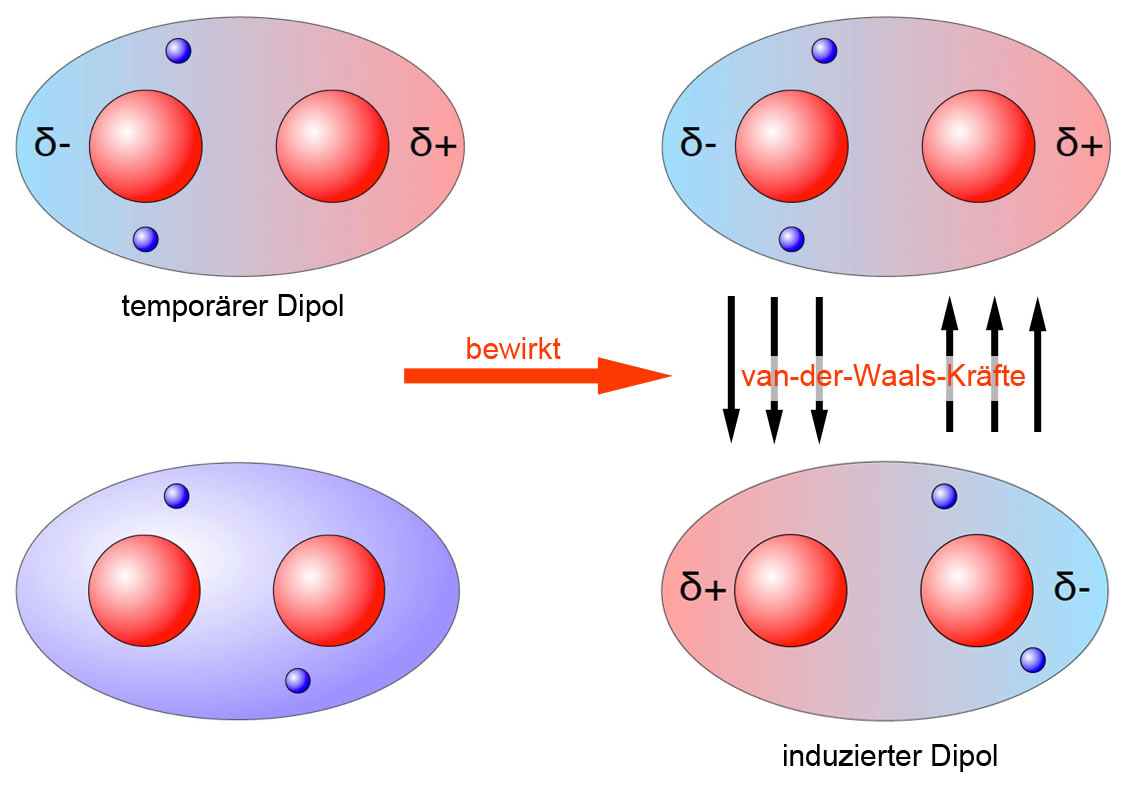
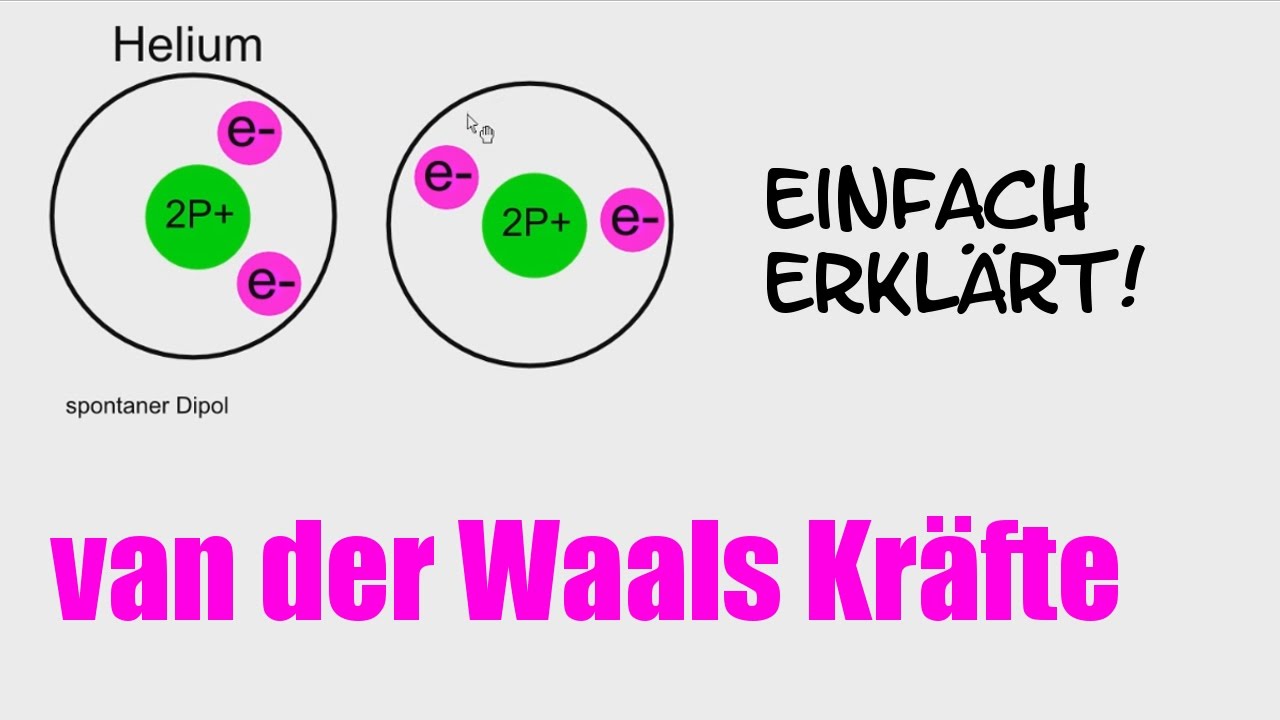
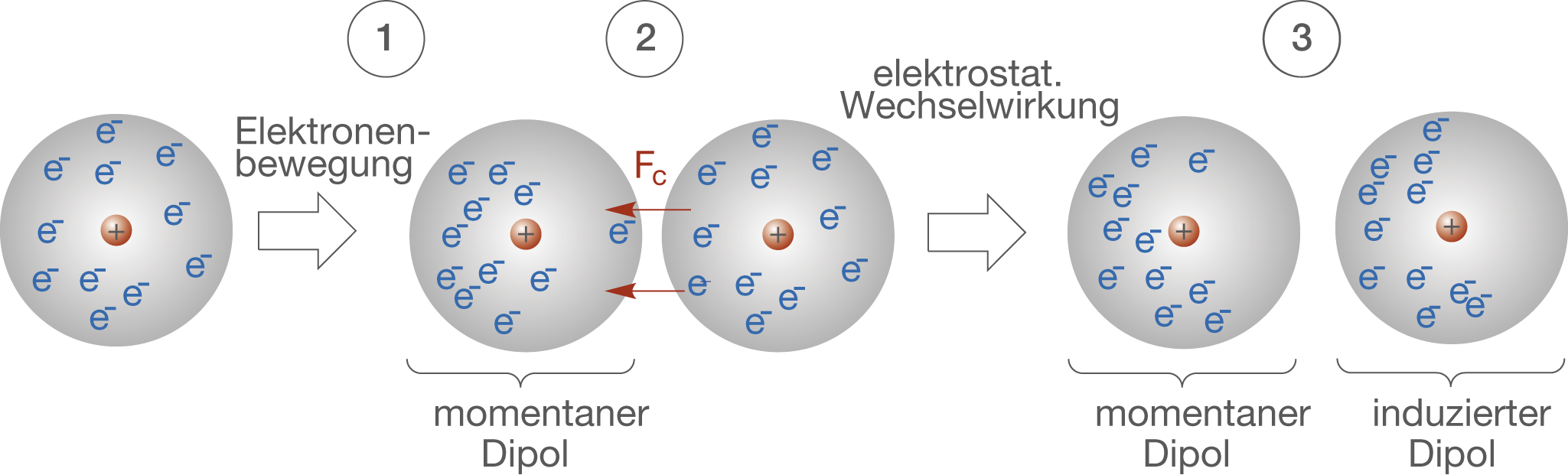
- London-Dispersionskräfte (auch Van-der-Waals-Kräfte im engeren Sinne): Diese Kräfte sind immer vorhanden, zwischen allen Atomen und Molekülen, ob polar oder unpolar. Sie entstehen durch vorübergehende, zufällige Schwankungen der Elektronenverteilung innerhalb eines Atoms oder Moleküls. Diese Schwankungen erzeugen kurzlebige, momentane Dipole, die benachbarte Atome oder Moleküle beeinflussen und weitere momentane Dipole induzieren. Diese Dipole ziehen sich kurzzeitig an. Obwohl jede einzelne dieser Kräfte sehr schwach ist, können sie in der Summe einen erheblichen Einfluss haben, insbesondere bei großen Molekülen mit vielen Elektronen. Je größer das Molekül und je mehr Elektronen es besitzt, desto stärker sind die London-Dispersionskräfte. Denken Sie an das Beispiel von Gecko-Füßen, die sich an glatten Oberflächen festhalten. Die enorme Anzahl winziger Härchen an ihren Füßen erzeugt genügend London-Dispersionskräfte, um das Gewicht des Geckos zu tragen.
Faktoren, die die Stärke der Van-der-Waals-Kräfte beeinflussen
Die Stärke der Van-der-Waals-Kräfte hängt von mehreren Faktoren ab:
- Molekülgröße und -form: Größere Moleküle haben in der Regel stärkere Van-der-Waals-Kräfte, da sie mehr Elektronen besitzen und somit größere momentane Dipole bilden können. Die Form des Moleküls spielt ebenfalls eine Rolle. Moleküle mit einer größeren Oberfläche haben mehr Kontaktpunkte und somit stärkere intermolekulare Kräfte.
- Polarisierbarkeit: Die Polarisierbarkeit ist ein Maß dafür, wie leicht die Elektronenwolke eines Atoms oder Moleküls durch ein elektrisches Feld verzerrt werden kann. Je polarisierbarer ein Molekül ist, desto stärker sind die induzierten Dipol-Dipol-Wechselwirkungen und London-Dispersionskräfte.
- Abstand zwischen den Molekülen: Van-der-Waals-Kräfte nehmen mit zunehmendem Abstand zwischen den Molekülen rasch ab. Sie sind daher besonders wichtig in kondensierten Phasen wie Flüssigkeiten und Feststoffen, wo die Moleküle dicht gepackt sind.
Die Bedeutung von Van-der-Waals-Kräften
Obwohl Van-der-Waals-Kräfte relativ schwach sind, spielen sie eine enorm wichtige Rolle in vielen Bereichen der Chemie, Physik und Biologie. Einige Beispiele:
- Siedepunkte und Schmelzpunkte: Die Stärke der intermolekularen Kräfte, einschließlich Van-der-Waals-Kräfte, beeinflusst die Temperatur, bei der eine Substanz siedet oder schmilzt. Stoffe mit stärkeren Van-der-Waals-Kräften haben tendenziell höhere Siedepunkte und Schmelzpunkte. Dies erklärt, warum beispielsweise Methan (CH4) bei Raumtemperatur gasförmig ist (schwache Dispersionskräfte), während Octan (C8H18), das eine längere Kohlenstoffkette und somit stärkere Dispersionskräfte besitzt, eine Flüssigkeit ist.
- Oberflächenspannung: Van-der-Waals-Kräfte tragen zur Oberflächenspannung von Flüssigkeiten bei, der Tendenz von Flüssigkeiten, ihre Oberfläche zu minimieren. Dies ermöglicht es beispielsweise kleinen Insekten, auf der Wasseroberfläche zu laufen.
- Adhäsion und Kohäsion: Adhäsion ist die Anziehungskraft zwischen verschiedenen Stoffen, während Kohäsion die Anziehungskraft zwischen gleichen Stoffen ist. Van-der-Waals-Kräfte spielen eine Rolle bei beiden Phänomenen. Sie sind beispielsweise wichtig für das Haften von Klebstoffen und das Zusammenhalten von Materialien.
- Proteinfaltung: Die dreidimensionale Struktur von Proteinen, die für ihre Funktion entscheidend ist, wird maßgeblich durch Van-der-Waals-Kräfte stabilisiert. Diese Kräfte helfen, die verschiedenen Teile des Proteins zusammenzuhalten und die korrekte Faltung zu gewährleisten.
- DNA-Struktur: Van-der-Waals-Kräfte tragen zur Stabilität der DNA-Doppelhelix bei, indem sie die Basenpaare zusammenhalten.
- Pharmazeutische Wirkstoffe: Die Art und Weise, wie ein Medikament an ein Zielprotein im Körper bindet, hängt oft von Van-der-Waals-Kräften ab. Die Optimierung dieser Wechselwirkungen ist ein wichtiger Aspekt der Arzneimittelentwicklung.
- Chromatographie: Verschiedene chromatographische Trenntechniken nutzen Van-der-Waals-Kräfte, um Substanzen voneinander zu trennen. Die unterschiedlichen Wechselwirkungen der Substanzen mit der stationären Phase der Chromatographie führen zu unterschiedlichen Retentionszeiten.
Zusammenfassung
Van-der-Waals-Kräfte sind schwache, aber wichtige intermolekulare Kräfte, die das Verhalten von Stoffen maßgeblich beeinflussen. Sie umfassen Dipol-Dipol-Wechselwirkungen, Dipol-induzierte Dipol-Wechselwirkungen und London-Dispersionskräfte. Die Stärke dieser Kräfte hängt von der Molekülgröße, -form, Polarisierbarkeit und dem Abstand zwischen den Molekülen ab. Van-der-Waals-Kräfte spielen eine entscheidende Rolle bei Siedepunkten, Oberflächenspannung, Adhäsion, Proteinfaltung, DNA-Struktur und vielen anderen Phänomenen.
Merke: Obwohl Van-der-Waals-Kräfte einzeln schwach sind, können sie in der Summe eine erhebliche Wirkung haben, insbesondere bei großen Molekülen. Verstehen Sie diese Kräfte, um die Eigenschaften von Materie besser zu verstehen.
Wir hoffen, dieser Artikel hat Ihnen geholfen, die Van-der-Waals-Kräfte besser zu verstehen. Wenn Sie weitere Fragen haben, zögern Sie nicht, sich weiter zu informieren!


![Was Sind Van Der Waals Kräfte Van-der-Waals-Kräfte · Entstehung & Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/08/Van-der-Waals-Kräfte_1-1-1024x576.jpg)