Was Versteht Man Unter Einer Oxidation
Oxidation ist ein fundamentaler chemischer Prozess, der in unzähligen Bereichen unseres Lebens und in der Industrie eine wichtige Rolle spielt. Von der Rostbildung an Metallen bis zur Energiegewinnung in unserem Körper ist Oxidation allgegenwärtig. Dieses Konzept zu verstehen, ist essenziell, um viele Phänomene in unserer Umwelt zu erklären. Dieser Artikel bietet eine klare und verständliche Einführung in das Thema Oxidation.
Was ist Oxidation?
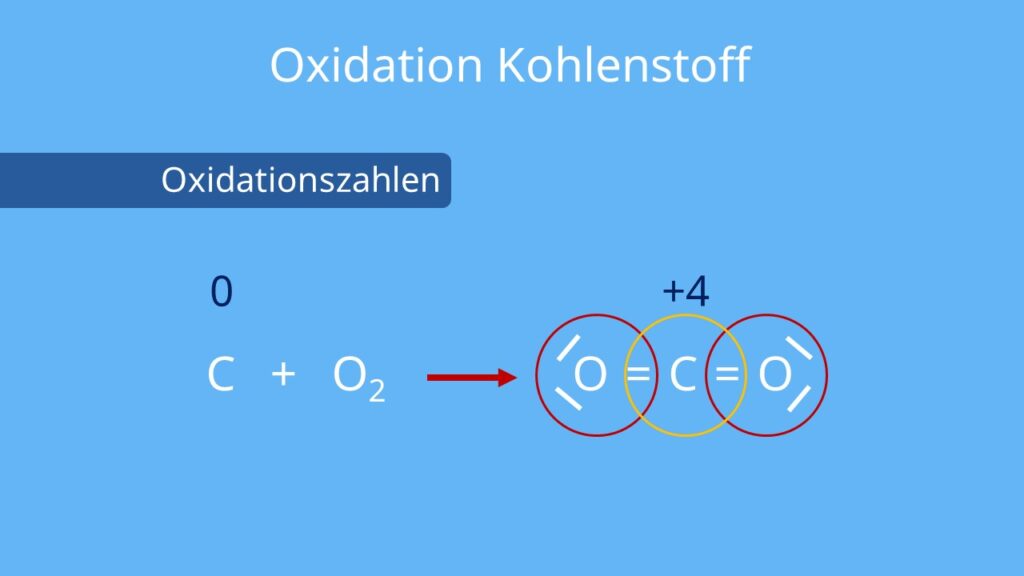
Im Kern beschreibt Oxidation den Verlust von Elektronen durch ein Atom, ein Molekül oder ein Ion während einer chemischen Reaktion. Traditionell wurde Oxidation mit der Reaktion einer Substanz mit Sauerstoff in Verbindung gebracht, beispielsweise die Verbrennung von Holz. Während Sauerstoff tatsächlich ein häufiges Oxidationsmittel ist, ist der Begriff der Oxidation deutlich breiter gefasst. Es geht vielmehr um den Elektronentransfer.
Um es einfacher auszudrücken: Stellen Sie sich vor, es gibt zwei Spieler, A und B. Oxidation ist, wenn Spieler A Elektronen an Spieler B abgibt. Spieler A wird oxidiert, weil er Elektronen verloren hat.
Das Konzept der Oxidationszahl
Um den Elektronentransfer und den Grad der Oxidation quantitativ zu beschreiben, wird das Konzept der Oxidationszahl verwendet. Die Oxidationszahl (auch Oxidationsstufe genannt) ist eine hypothetische Ladung, die ein Atom hätte, wenn alle Bindungen zu anderen Atomen ionisch wären. Sie dient als Buchhaltungssystem für Elektronen.
Die Regeln für die Bestimmung der Oxidationszahl sind wie folgt:
- Die Oxidationszahl eines Elements in seiner elementaren Form (z.B. O2, Cu, Fe) ist immer 0.
- Die Oxidationszahl eines einatomigen Ions entspricht seiner Ladung (z.B. Na+ hat eine Oxidationszahl von +1, Cl- hat eine Oxidationszahl von -1).
- Die Summe der Oxidationszahlen aller Atome in einem neutralen Molekül ist 0.
- Die Summe der Oxidationszahlen aller Atome in einem mehratomigen Ion entspricht der Ladung des Ions.
- In Verbindungen hat Fluor (F) immer die Oxidationszahl -1.
- Sauerstoff (O) hat normalerweise die Oxidationszahl -2, außer in einigen speziellen Fällen wie Peroxiden (z.B. H2O2), wo es -1 hat, oder in Verbindungen mit Fluor, wo es positiv sein kann.
- Wasserstoff (H) hat normalerweise die Oxidationszahl +1, außer in Metallhydriden (z.B. NaH), wo es -1 hat.
Beispiel: Betrachten wir Wasser (H2O). Sauerstoff hat eine Oxidationszahl von -2. Da es zwei Wasserstoffatome gibt und das Molekül neutral ist, muss jedes Wasserstoffatom eine Oxidationszahl von +1 haben, um die Ladung auszugleichen (2 * +1 + -2 = 0).
Reduktion – Der Partner der Oxidation
Oxidation tritt niemals alleine auf. Sie ist immer an eine Reduktion gekoppelt. Reduktion ist das Gegenteil von Oxidation: Sie beschreibt die Aufnahme von Elektronen durch ein Atom, ein Molekül oder ein Ion. Wenn also Spieler A Elektronen abgibt (Oxidation), muss Spieler B diese Elektronen aufnehmen (Reduktion). Die beiden Prozesse laufen immer gleichzeitig ab.
Eine chemische Reaktion, die sowohl Oxidation als auch Reduktion beinhaltet, wird als Redoxreaktion bezeichnet. In einer Redoxreaktion gibt es also immer eine Substanz, die oxidiert wird (der Elektronendonator, auch Reduktionsmittel genannt), und eine Substanz, die reduziert wird (der Elektronenakzeptor, auch Oxidationsmittel genannt).
Eselsbrücke: OIL RIG – Oxidation Is Loss (Elektronenverlust), Reduction Is Gain (Elektronengewinn).
Beispiele für Oxidation im Alltag
Oxidation ist ein allgegenwärtiges Phänomen mit vielen praktischen Anwendungen und Auswirkungen:
- Rostbildung: Die Korrosion von Eisen (Fe) zu Rost (Eisenoxid, Fe2O3) ist ein klassisches Beispiel für Oxidation. Eisen verliert Elektronen an Sauerstoff in der Luft und im Wasser, was zur Bildung von Rost führt.
- Verbrennung: Die Verbrennung von Holz, Erdgas oder anderen Brennstoffen ist eine Redoxreaktion, bei der der Brennstoff (z.B. Methan, CH4) oxidiert wird und Sauerstoff reduziert wird. Dabei wird Energie in Form von Wärme und Licht freigesetzt.
- Batterien: Batterien nutzen Redoxreaktionen, um elektrische Energie zu erzeugen. In einer Batterie findet eine kontrollierte Oxidation und Reduktion statt, wobei Elektronen von einer Elektrode zur anderen fließen und einen elektrischen Strom erzeugen.
- Atmung: Die Zellatmung in unserem Körper ist ein komplexer Prozess, bei dem Glukose (Zucker) oxidiert wird, um Energie zu gewinnen. Sauerstoff wird dabei reduziert.
- Lebensmittelverderb: Oxidation spielt eine Rolle beim Verderb von Lebensmitteln. Beispielsweise führt die Oxidation von Fetten zu Ranzigkeit.
- Bleichen: Bleichmittel wie Natriumhypochlorit (NaClO) wirken durch Oxidation von Farbstoffen.
- Fotografie: In der traditionellen Fotografie werden Silberhalogenide durch Licht oxidiert, um ein latentes Bild zu erzeugen.
Weitere Beispiele:
- Das Anbräunen eines Apfels, nachdem er angeschnitten wurde, ist ein Beispiel für Oxidation. Enzyme im Apfel katalysieren die Oxidation von Phenolen durch Sauerstoff, was zu braunen Pigmenten führt.
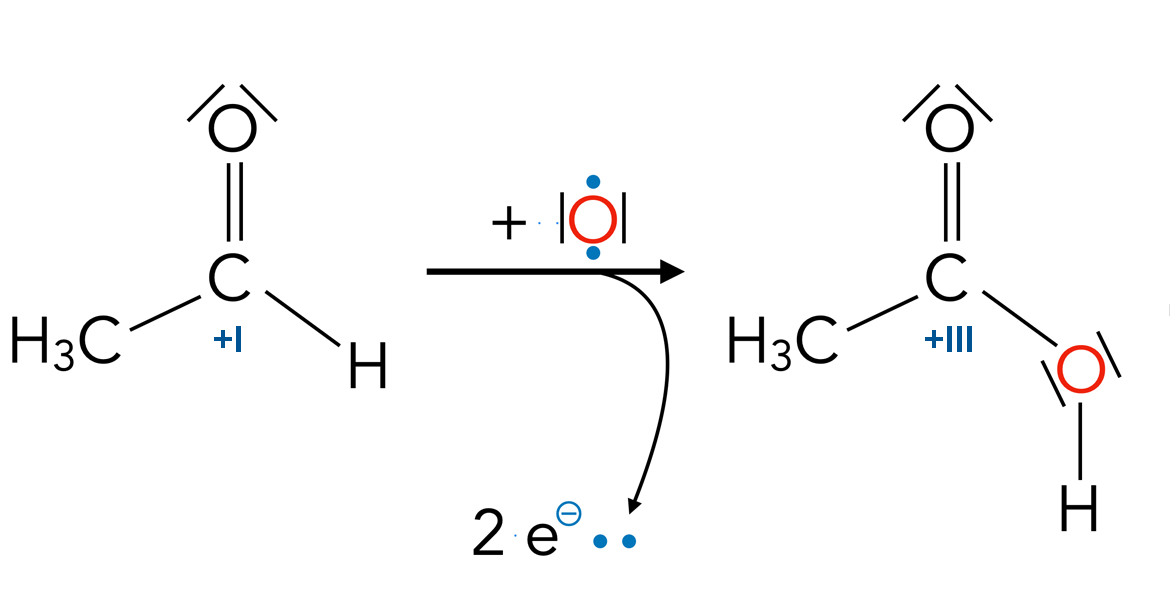
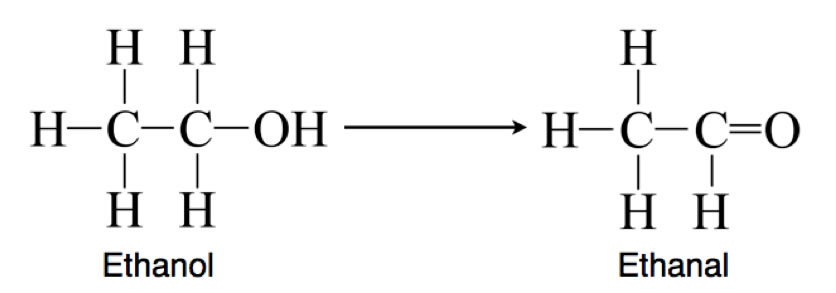
- Die Oxidation von Alkohol in der Leber ist ein wichtiger Schritt im Abbau von Alkohol im Körper.
- Die Oxidation von Schwefelwasserstoff (H2S) zu Schwefel (S) durch Bakterien in bestimmten Umgebungen ist ein wichtiger Bestandteil des Schwefelkreislaufs.
Oxidationsmittel und Reduktionsmittel
Wie bereits erwähnt, spielt es in einer Redoxreaktion zwei Schlüsselakteure: Das Oxidationsmittel und das Reduktionsmittel.
- Oxidationsmittel: Ein Oxidationsmittel ist eine Substanz, die andere Substanzen oxidiert. Das bedeutet, es nimmt Elektronen von anderen Substanzen auf und wird selbst reduziert. Sauerstoff (O2), Kaliumpermanganat (KMnO4) und Wasserstoffperoxid (H2O2) sind gängige Oxidationsmittel.
- Reduktionsmittel: Ein Reduktionsmittel ist eine Substanz, die andere Substanzen reduziert. Das bedeutet, es gibt Elektronen an andere Substanzen ab und wird selbst oxidiert. Wasserstoff (H2), Metalle wie Natrium (Na) und Zink (Zn) sowie organische Moleküle wie Ascorbinsäure (Vitamin C) sind gängige Reduktionsmittel.
Ein starkes Oxidationsmittel hat eine hohe Affinität zu Elektronen und kann leicht andere Substanzen oxidieren. Ein starkes Reduktionsmittel gibt leicht Elektronen ab und kann somit andere Substanzen leicht reduzieren.
Die Bedeutung von Oxidation in der Industrie
Oxidation spielt eine entscheidende Rolle in vielen industriellen Prozessen:
- Metallurgie: Die Gewinnung von Metallen aus ihren Erzen beinhaltet oft Redoxreaktionen. Zum Beispiel wird Eisenoxid (Fe2O3) mit Kohlenstoff (Koks) reduziert, um elementares Eisen zu gewinnen.
- Chemische Industrie: Viele chemische Reaktionen, die in der chemischen Industrie verwendet werden, sind Redoxreaktionen. Die Herstellung von Ammoniak (NH3) durch das Haber-Bosch-Verfahren ist ein Beispiel, bei dem Stickstoff und Wasserstoff unter Verwendung eines Katalysators reagieren.
- Energieerzeugung: Die Verbrennung von fossilen Brennstoffen in Kraftwerken und Verbrennungsmotoren ist eine Redoxreaktion, die zur Erzeugung von Energie genutzt wird.
- Abwasserbehandlung: Oxidationsprozesse werden in der Abwasserbehandlung eingesetzt, um organische Schadstoffe abzubauen. Beispielsweise kann Ozon (O3) als Oxidationsmittel verwendet werden.
- Kunststoffherstellung: Viele Kunststoffe werden durch Polymerisation hergestellt, ein Prozess, der oft durch Redoxreaktionen initiiert wird.
Kontrolle von Oxidation
In vielen Fällen ist es wünschenswert, die Oxidation zu kontrollieren oder zu verhindern, um unerwünschte Effekte wie Korrosion oder Lebensmittelverderb zu minimieren.
Methoden zur Kontrolle der Oxidation:
- Beschichtungen: Das Auftragen von Schutzschichten auf Metalloberflächen, wie z.B. Farbe, Lack oder Zink (Galvanisierung), kann verhindern, dass Sauerstoff und Wasser mit dem Metall in Kontakt kommen und es oxidieren.
- Antioxidantien: Antioxidantien sind Substanzen, die die Oxidation verlangsamen oder verhindern. Sie wirken, indem sie freie Radikale neutralisieren oder selbst oxidiert werden, wodurch die Oxidation der gewünschten Substanz verhindert wird. Antioxidantien werden in Lebensmitteln, Kunststoffen und anderen Produkten verwendet. Beispiele sind Vitamin C, Vitamin E und bestimmte synthetische Chemikalien.
- Reduzierung der Sauerstoffexposition: Durch die Lagerung von Produkten in einer sauerstoffarmen Umgebung kann die Oxidation verlangsamt werden. Dies wird oft in der Lebensmittelverpackung angewendet.
- Passivierung: Einige Metalle bilden auf ihrer Oberfläche eine dünne, dichte Oxidschicht, die sie vor weiterer Korrosion schützt. Dieses Phänomen wird als Passivierung bezeichnet. Edelstahl ist ein Beispiel für ein passiviertes Metall.
Fazit
Oxidation ist ein fundamentaler chemischer Prozess, der in vielen Bereichen unseres Lebens eine wichtige Rolle spielt. Das Verständnis des Konzepts der Oxidation und Reduktion ist entscheidend, um viele Phänomene in unserer Umwelt und in der Industrie zu erklären. Ob es sich um die Rostbildung, die Energiegewinnung in unserem Körper oder die Herstellung von Chemikalien handelt, Oxidation ist allgegenwärtig und von großer Bedeutung.
![Was Versteht Man Unter Einer Oxidation Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-und-Reduktion-1-1024x576.jpg)
![Was Versteht Man Unter Einer Oxidation Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Oxidation-von-sekundären-Alkohol-3-1024x576.jpg)





+Nennen+Sie+zwei+charakteristische+Reaktionen%2C+die+die+Thiolgruppe+von+Cystein+eingehen+kann..jpg)


![Was Versteht Man Unter Einer Oxidation Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/03/WP-Bild_Ethanol-Oxidation-2-1024x576.jpg)
.jpg)
.jpg)


